1 . 在抗击新冠病毒中“84消毒液(有效成分是NaClO)”发挥了重要作用。工业上,制备“84消毒液”的原理为:NaCl+H2O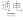 NaClO+H2↑。下列说法不正确的是
NaClO+H2↑。下列说法不正确的是
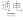 NaClO+H2↑。下列说法不正确的是
NaClO+H2↑。下列说法不正确的是| A.该反应每转移4mol电子生成149g的NaClO |
| B.NaClO的消毒原理利用了其强氧化性 |
C.NaCl的电子式为: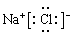 |
| D.上述制备消毒液的反应过程中只有离子键的断裂和形成 |
您最近一年使用:0次
解题方法
2 . 氮及其化合物在生产、生活中有重要的应用。回答下列问题:
(1)下列选项可作为比较氮和氧非金属性强弱的判断依据的是_______
a.氢化物稳定性:H2O>NH3 b.沸点:H2O>NH3
c.NO中N为+2价,O为-2价 d.碱性:NH3>H2O
(2)氢氰酸(HCN)可用于制造丙烯腈和丙烯酸树脂,HCN分子的电子式为_______ 。
(3)NaNO2是一种白色易溶于水的固体,俗称工业盐。其水溶液显碱性,则该溶液中离子浓度由大到小的顺序是_______ 。
(4)氰化钠是一种剧毒物质,处理该物质的方法之一是在碱性条件下通入氯气,其中CN-被氧化成CO 和N2,写出该反应的离子方式
和N2,写出该反应的离子方式_______ 。
(1)下列选项可作为比较氮和氧非金属性强弱的判断依据的是
a.氢化物稳定性:H2O>NH3 b.沸点:H2O>NH3
c.NO中N为+2价,O为-2价 d.碱性:NH3>H2O
(2)氢氰酸(HCN)可用于制造丙烯腈和丙烯酸树脂,HCN分子的电子式为
(3)NaNO2是一种白色易溶于水的固体,俗称工业盐。其水溶液显碱性,则该溶液中离子浓度由大到小的顺序是
(4)氰化钠是一种剧毒物质,处理该物质的方法之一是在碱性条件下通入氯气,其中CN-被氧化成CO
 和N2,写出该反应的离子方式
和N2,写出该反应的离子方式
您最近一年使用:0次
3 . 下列有关 型化合物的叙述正确的是
型化合物的叙述正确的是
 型化合物的叙述正确的是
型化合物的叙述正确的是A.若 可用于制造光导纤维,则 可用于制造光导纤维,则 属于两性氧化物 属于两性氧化物 |
B.若 是造成酸雨的主要物质,则 是造成酸雨的主要物质,则 一定是酸性氧化物 一定是酸性氧化物 |
C.若 为 为 ,常利用 ,常利用 的氧化性对饮用水杀菌消毒 的氧化性对饮用水杀菌消毒 |
D.若 为 为 , , 分子中每个原子最外层均满足8电子稳定结构 分子中每个原子最外层均满足8电子稳定结构 |
您最近一年使用:0次
解题方法
4 . 下图是元素周期表的一部分。按要求填写下列空白:
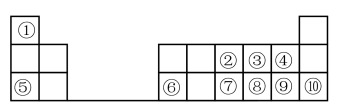
(1)元素⑦在周期表中的位置可表示为_______ 。
(2)④、⑧、⑨的简单离子半径的大小顺序为_______ (填离子符号)。
(3)①-⑩元素的最高价氧化物对应的水化物中,酸性最强的是_______ (填化学式)。
(4)④⑧⑨三种元素形成的气态氢化物稳定性由大到小的顺序是_______ (用化学式表示)。
(5)⑤的最高价氧化物对应的水化物的电子式为_______ ;⑧的氢化物的结构式为_______
(6)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是_______ 。
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱

(1)元素⑦在周期表中的位置可表示为
(2)④、⑧、⑨的简单离子半径的大小顺序为
(3)①-⑩元素的最高价氧化物对应的水化物中,酸性最强的是
(4)④⑧⑨三种元素形成的气态氢化物稳定性由大到小的顺序是
(5)⑤的最高价氧化物对应的水化物的电子式为
(6)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
您最近一年使用:0次
2022-12-21更新
|
348次组卷
|
2卷引用:海南省北京师范大学海口附属学校2020-2021学年高一下学期月考化学试题
名校
5 . 原子序数由小到大排列的四种短周期元素 、
、 、
、 、
、 ,其中
,其中 、
、 、
、 与氢元素可组成
与氢元素可组成 、
、 和
和 三种共价化合物;
三种共价化合物; 与氧元素可组成
与氧元素可组成 和
和 两种离子化合物。
两种离子化合物。
(1)写出 的电子式:
的电子式:___________ 。其中含有的化学键是___________ 。
(2)用电子式表示 的形成过程
的形成过程___________ 。
(3) 、
、 、
、 三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是
三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是___________ (填化学式)。
(4) 、
、 和
和 三种化合物,其中一种与另外两种都能反应的是
三种化合物,其中一种与另外两种都能反应的是___________ (填化学式)。
(5)由 、
、 组成的化合物分子中,
组成的化合物分子中, 、
、 原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式
原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式___________ 。
 、
、 、
、 、
、 ,其中
,其中 、
、 、
、 与氢元素可组成
与氢元素可组成 、
、 和
和 三种共价化合物;
三种共价化合物; 与氧元素可组成
与氧元素可组成 和
和 两种离子化合物。
两种离子化合物。(1)写出
 的电子式:
的电子式:(2)用电子式表示
 的形成过程
的形成过程(3)
 、
、 、
、 三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是
三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是(4)
 、
、 和
和 三种化合物,其中一种与另外两种都能反应的是
三种化合物,其中一种与另外两种都能反应的是(5)由
 、
、 组成的化合物分子中,
组成的化合物分子中, 、
、 原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式
原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式
您最近一年使用:0次
2022-04-01更新
|
204次组卷
|
13卷引用:海南省华中师范大学海南附属中学2021届高三上学期第四次月考化学试题
海南省华中师范大学海南附属中学2021届高三上学期第四次月考化学试题2015-2016学年江西省金溪一中高一下期中化学试卷2015-2016学年中国石油天然气管道局中学高一下第二次月考化学试卷2016-2017学年辽宁省庄河高级中学高二上开学测化学试卷2018版化学(苏教版)高考总复习专题五课时跟踪训练--微粒之间的相互作用力与物质的多样性山西省运城市康杰中学2017-2018学年高一下学期期中考试化学试题北京四中2017-2018学年高一下学期第二次月考化学试题新疆自治区和田地区和田县喀什塔什乡中学2019届高三年级四月调研考试理综化学试题百所名校联考-必修二模块综合检测黑龙江省哈尔滨市尚志市尚志中学2021届高三10月月考化学试题(已下线)第8单元 原子结构 元素周期律(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷河南省新野县第一高级中学校2021-2022学年高一下学期第三次考试化学试题四川省成都市树德中学2021-2022学年高一下学期5月阶段性测试化学试题
名校
6 . 下表为元素周期表的一部分,请参照给定元素的位置,回答下列问题:
(1)元素④、⑤、⑥的原子半径由大到小的顺序为_______ (用元素符号表示);
(2)元素③、⑦的最高价含氧酸的酸性由强到弱的顺序为_______ (用化学式表示);
(3)碱性强弱比较:元素⑤的氢氧化物_______ ⑥的氢氧化物(用<、=、>填空),两者相互反应的离子方程式为_______ ;
(4)由元素⑤和⑧共同组成的化合物的电子式为_______ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)元素③、⑦的最高价含氧酸的酸性由强到弱的顺序为
(3)碱性强弱比较:元素⑤的氢氧化物
(4)由元素⑤和⑧共同组成的化合物的电子式为
您最近一年使用:0次
7 . 下列表述正确的是
| A.原子半径:Na>Mg>O |
| B.还原性F->Cl->S2- |
| C.酸性:H3PO4>H2SO4>HClO4 |
D.乙烯比例模型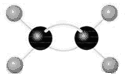 |
您最近一年使用:0次
名校
8 . 人们运用元素周期律和元素周期表,可以系统研究元素的性质。试回答:
(1)碱金属元素中,锂原子的结构示意图为_______ ,其中6Li、7Li互为_______ ;
(2)金属钾19K位于元素周期表中的第_______ 周期第_______ 族,钾的氧化物有多种,其中过氧化钾(K2O2)和超氧化钾(KO2)常作供氧剂,写出过氧化钾与CO2反应的化学方程式:_______ ;
(3)第三周期元素中,酸性最强的HClO4中氯元素的化合价为_______ 、可作半导体材料的元素是_______ (填名称),已知H2+Cl2 2HCl,请用电子式表达HCl的形成过程
2HCl,请用电子式表达HCl的形成过程_______ 。
(1)碱金属元素中,锂原子的结构示意图为
(2)金属钾19K位于元素周期表中的第
(3)第三周期元素中,酸性最强的HClO4中氯元素的化合价为
 2HCl,请用电子式表达HCl的形成过程
2HCl,请用电子式表达HCl的形成过程
您最近一年使用:0次
名校
解题方法
9 . 人们运用元素周期律和元素周期表,可以系统研究元素的性质。试回答:
(1)碱金属元素中,锂原子的结构示意图为__ 、其中6Li、7Li互为__ ,用电子式表示Li2O的形成过程___ 。
(2)金属钾19K位于元素周期表中的第__ 周期、第__ 族;钾的氧化物有多种,其中过氧化钾(K2O2)和超氧化钾(KO2)常作供氧剂,写出过氧化钾与CO2反应的化学方程式:___ ;超氧化钾与水反应如下,请配平该反应的化学方程式:
_ KO2+_ H2O=_ KOH+_ O2↑+_ H2O2
(3)第三周期元素中,酸性最强的HClO4中氯元素的化合价为__ 、可作半导体材料的元素是__ (填名称),当反应H2+Cl2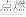 2HCl发生过程中,涉及到
2HCl发生过程中,涉及到___ 键断裂和__ 键的形成。(填:离子键或极性键或非极性键)
(1)碱金属元素中,锂原子的结构示意图为
(2)金属钾19K位于元素周期表中的第
(3)第三周期元素中,酸性最强的HClO4中氯元素的化合价为
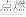 2HCl发生过程中,涉及到
2HCl发生过程中,涉及到
您最近一年使用:0次



