名校
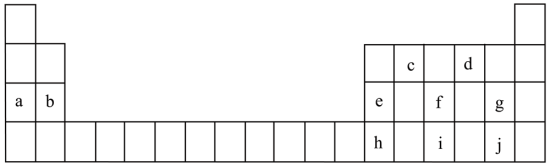
1 . 下表为元素周期表的一部分,表中所列的每个字母分别代表某一元素。
(1)元素 的原子结构示意图为
的原子结构示意图为______ ,a、b、e、g简单离子半径的大小顺序______ (用离子符号表示)。
(2)化合物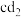 的电子式为
的电子式为______ ,化合物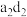 中含有的化学键为
中含有的化学键为______ 。
(3)写出e和g的最高价氧化物对应水化物相互反应的化学方程式______ 。
(4)由元素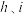 组成的化合物砷化镓(GaAs)是一种重要的半导体材料,其中元素h、i中失电子能力更强的是
组成的化合物砷化镓(GaAs)是一种重要的半导体材料,其中元素h、i中失电子能力更强的是______ (填元素符号)。元素 与
与 的最高价氧化物水化物的酸性更强的是
的最高价氧化物水化物的酸性更强的是______ (填化合物化学式,下同),元素 与
与 的简单气态氢化物还原性更强的是
的简单气态氢化物还原性更强的是______ 。
(5)设计实验证明 的得电子能力大于
的得电子能力大于 ,简述操作步骤和现象(可选用试剂:固体
,简述操作步骤和现象(可选用试剂:固体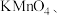 、稀盐酸、浓盐酸、溴水、
、稀盐酸、浓盐酸、溴水、 溶液、
溶液、 溶液):
溶液):______ 。
(1)元素
 的原子结构示意图为
的原子结构示意图为(2)化合物
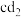 的电子式为
的电子式为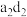 中含有的化学键为
中含有的化学键为(3)写出e和g的最高价氧化物对应水化物相互反应的化学方程式
(4)由元素
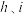 组成的化合物砷化镓(GaAs)是一种重要的半导体材料,其中元素h、i中失电子能力更强的是
组成的化合物砷化镓(GaAs)是一种重要的半导体材料,其中元素h、i中失电子能力更强的是 与
与 的最高价氧化物水化物的酸性更强的是
的最高价氧化物水化物的酸性更强的是 与
与 的简单气态氢化物还原性更强的是
的简单气态氢化物还原性更强的是(5)设计实验证明
 的得电子能力大于
的得电子能力大于 ,简述操作步骤和现象(可选用试剂:固体
,简述操作步骤和现象(可选用试剂:固体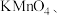 、稀盐酸、浓盐酸、溴水、
、稀盐酸、浓盐酸、溴水、 溶液、
溶液、 溶液):
溶液):
您最近一年使用:0次
2 . A、B、C、D、E四种元素,它们原子的核电荷数均小于18,且依次递增,A原子核内仅有一个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D的最外层电子数是次外层电子数的3倍;E的单质是用途最广泛的半导体材料。试推断它们各是什么元素并回答下列问题:
(1)写出下列元素符号:A________ ,C________ ,E________ 。
(2)B、C、D的气态氢化物的稳定性由大到小的顺序为_____________ (用化学式表示)
(3)画出D的离子结构示意图______________ 。
(4)用一个化学方程式证明B、E的非金属性的强弱________________ 。
(5)写出E的最高价氧化物的一种用途:_______________ 。
(1)写出下列元素符号:A
(2)B、C、D的气态氢化物的稳定性由大到小的顺序为
(3)画出D的离子结构示意图
(4)用一个化学方程式证明B、E的非金属性的强弱
(5)写出E的最高价氧化物的一种用途:
您最近一年使用:0次
解题方法
3 . 下表是元素周期表的一部分,针对编号①~⑫元素,回答下列有关问题:
(1)在这些元素中,非金属性最强的元素是_______ (填元素符号,下同),最不活泼的元素是_______ 。
(2)写出元素①对应气态氢化物的化学式和电子式:_______ 、_______ 。
(3)在元素③和④中,单质与水反应较剧烈的是_______ (填元素符号),它与水反应的化学方程式是_______ 。
(4)在元素③、④与⑤的最高价氧化物对应的水化物中,碱性最弱是_______ (填化学式)。
(5)能证明⑧和⑫单质氧化性强弱的实验事实 用离子方程式表示)是
用离子方程式表示)是_______ 。
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |  |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ | ⑪ | ⑫ |
(2)写出元素①对应气态氢化物的化学式和电子式:
(3)在元素③和④中,单质与水反应较剧烈的是
(4)在元素③、④与⑤的最高价氧化物对应的水化物中,碱性最弱是
(5)能证明⑧和⑫单质氧化性强弱的实验事实
 用离子方程式表示)是
用离子方程式表示)是
您最近一年使用:0次
4 . 下列说法正确的是
A. 和 和 互为同系物 互为同系物 |
B.甲烷的结构式: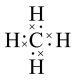 |
| C.三氯甲烷只有一种结构可证明甲烷是四面体立体结构 |
D.比例模型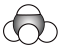 可以同时表示甲烷分子和四氯化碳分子 可以同时表示甲烷分子和四氯化碳分子 |
您最近一年使用:0次
2024-04-05更新
|
661次组卷
|
2卷引用:福建省晋江市养正中学2023-2024学年高一下学期3月第一次月考化学试题
5 . 元素周期表的一部分如图所示,其中每一个序号分别代表一种元素。回答下列问题。

(1)地壳中含量最多的金属元素为___________ (填化学式),该元素在元素周期表中的位置为___________ 。
(2)①和②形成的一种常温下极易溶于水且有刺激性气味的气体的电子式为___________ ,该物质___________ (填“属于”或“不属于”)电解质。
(3)③和④相比较,最简单氢化物的稳定性较强的是___________ (填化学式),简单离子半径:⑤___________ (填“>”、“<”或“=”)⑦。
(4)⑤和⑧相比较,金属性较强的是___________ (填元素符号),下列表述中,能证明这一事实的是___________ (填标号)。
A.⑤单质密度比⑧单质的大
B.⑧单质与水反应比⑤单质与水反应剧烈
C.⑤单质的熔点比⑧单质的高

(1)地壳中含量最多的金属元素为
(2)①和②形成的一种常温下极易溶于水且有刺激性气味的气体的电子式为
(3)③和④相比较,最简单氢化物的稳定性较强的是
(4)⑤和⑧相比较,金属性较强的是
A.⑤单质密度比⑧单质的大
B.⑧单质与水反应比⑤单质与水反应剧烈
C.⑤单质的熔点比⑧单质的高
您最近一年使用:0次
2023-05-15更新
|
186次组卷
|
2卷引用:福建省龙岩市连城二中等校2022-2023学年高一下学期期中联考化学试题
名校
6 . A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,A的原子核内无中子,B、G在元素周期表中的相对位置如图,B与D元素能形成两种常见无色无味气体,D是地壳中含量最多的元素,F是地壳中含量最多的金属元素,E的焰色反应呈黄色。
(1)G在元素周期表中的位置是___________ B2A4的电子式为___________
(2)比较C、D、F离子半径大小___________ (用化学式表示),
(3)E与F相比,金属性较强的是___________ (填元素符号),下列能证明这一事实的是___________ (填字母)。
A.E单质的熔点比F单质低
B.E单质与水反应比F单质与水反应剧烈
C.E的化合价比F低
D.E最高价氧化物对应的水化物的碱性比F的强
(4)B6A6是煤干馏的主要产物之一,写出与液溴和铁粉混合时的化学方程式___________
| B | ||
| G |
(2)比较C、D、F离子半径大小
(3)E与F相比,金属性较强的是
A.E单质的熔点比F单质低
B.E单质与水反应比F单质与水反应剧烈
C.E的化合价比F低
D.E最高价氧化物对应的水化物的碱性比F的强
(4)B6A6是煤干馏的主要产物之一,写出与液溴和铁粉混合时的化学方程式
您最近一年使用:0次
解题方法
7 . 几种主族元素在周期表中的位置如表:
根据表回答下列问题:
(1)⑦元素的简单氢化物的电子式是_______________ 、⑧的最高正价是_______________ ,⑤的最高价氧化物结构式__________ 。
(2)①②③三种元素原子半径由大到小的顺序是_________ (用元素符号表示)。
(3)表中8种元素中,最高价氧化物有两性的元素的原子结构示意图为__________ ,该元素在周期表中的位置是_________ 。
(4)③⑦⑧三种元素最高价氧化物对应水化物酸性最强的是__________ (填化学式),②与⑦最高价氧化物对应水化物反应的化学方程式为____________________ 。
(5)非金属性强弱比较⑦__________ ⑧填写“大于”或“小于”)下列表述中能证明这一事实的是__________ (填字母)。
a.⑦的氢化物比⑧的氢化物水溶液酸性弱
b.⑦氧化物对应的水化物的酸性强于⑧氧化物对应的水化物的酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
(6)①与④形成的化合物是__________ (填“离子”或“共价”)化合物。
族 周期 | IA | 0 | ||||||
1 | ④ | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ⑤ | ⑥ | ||||||
3 | ① | ③ | ⑦ | |||||
4 | ② | ⑧ | ||||||
(1)⑦元素的简单氢化物的电子式是
(2)①②③三种元素原子半径由大到小的顺序是
(3)表中8种元素中,最高价氧化物有两性的元素的原子结构示意图为
(4)③⑦⑧三种元素最高价氧化物对应水化物酸性最强的是
(5)非金属性强弱比较⑦
a.⑦的氢化物比⑧的氢化物水溶液酸性弱
b.⑦氧化物对应的水化物的酸性强于⑧氧化物对应的水化物的酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
(6)①与④形成的化合物是
您最近一年使用:0次
名校
8 . C、O、Na、Al、Si、S、Cl是生活中常见的几种元素。请回答下列问题:
(1)铝在元素周期表中的位置为______ 。
(2)在C、O、Si、S、Cl元素形成的简单氢化物中,稳定性最差的氢化物的电子式为______ 。
(3)利用图装置可验证同主族元素非金属性的变化规律:

①仪器A的名称为______ ,仪器D的作用为_______ 。
②若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成Cl2),C中加淀粉KI溶液,观察到C中溶液______ 的现象,即可证明,反应的离子方程式为______ 。
(1)铝在元素周期表中的位置为
(2)在C、O、Si、S、Cl元素形成的简单氢化物中,稳定性最差的氢化物的电子式为
(3)利用图装置可验证同主族元素非金属性的变化规律:

①仪器A的名称为
②若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成Cl2),C中加淀粉KI溶液,观察到C中溶液
您最近一年使用:0次
9 . 下图是短式元素周期表的一部分。
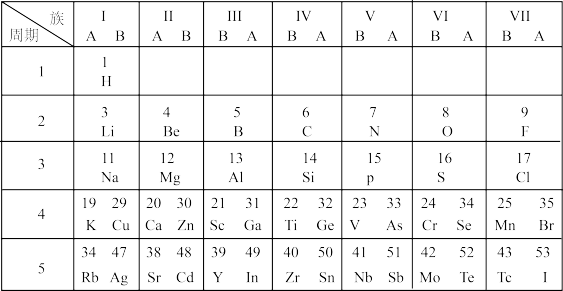
(1)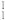 H和
H和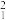 H互为
H互为___________ 。
(2)H2O的电子式为___________ ,GeH4分子的空间结构为___________ 。
(3)向NaBr溶液中滴加___________ (填试剂名称),若发生反应___________ (用离子方程式表示),则证明Cl原子得电子能力比Br原子强。
(4)在实验室用无水乙醇和冰醋酸制备乙酸乙酯的化学方程式为___________ 。
(5)前三周期元素X、Y原子序数依次增大,原子X、Y的最外层电子数均为K层的2倍。工业上利用单质X制备单质Y的化学方程式为___________ 。
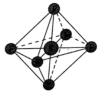
(6)SF6分子的空间结构为正八面体形,如图所示。1 mol SF6中含有___________ mol S—F键,它的二氯代物SF4Cl2有___________ 种。

(1)
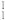 H和
H和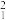 H互为
H互为(2)H2O的电子式为
(3)向NaBr溶液中滴加
(4)在实验室用无水乙醇和冰醋酸制备乙酸乙酯的化学方程式为
(5)前三周期元素X、Y原子序数依次增大,原子X、Y的最外层电子数均为K层的2倍。工业上利用单质X制备单质Y的化学方程式为
(6)SF6分子的空间结构为正八面体形,如图所示。1 mol SF6中含有

您最近一年使用:0次
名校
10 . 下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。
请完成下列空白。
(1)写出 52 号元素在元素周期表中的位置___________ ;写出③和⑨两元素原子序数的差值___________
(2)写出③与⑦形成的化合物的电子式___________
(3)写出一个能够证明④的最高价氧化物的水化物的碱性弱于③的最高价氧化物的水化物的碱性的离子反应方程式___________
(4)写出由②、⑤、⑥三种元素构成的物质的水溶液与 CO2 反应的化学方程式___________
(5)写出一个能够证明⑦的非金属性强于⑧的离子反应方程式___________
| IA | IIA | IIIA | VA | 0 | ||||
| 1 | ① | |||||||
| 2 | ⑥ | |||||||
| 3 | ② | ③ | ④ | ⑤ | ⑦ | |||
| 4 | ⑨ | ⑧ | ⑩ |
请完成下列空白。
(1)写出 52 号元素在元素周期表中的位置
(2)写出③与⑦形成的化合物的电子式
(3)写出一个能够证明④的最高价氧化物的水化物的碱性弱于③的最高价氧化物的水化物的碱性的离子反应方程式
(4)写出由②、⑤、⑥三种元素构成的物质的水溶液与 CO2 反应的化学方程式
(5)写出一个能够证明⑦的非金属性强于⑧的离子反应方程式
您最近一年使用:0次



