名校
1 . 氯化氰 ,又名氯甲氰,熔点为
,又名氯甲氰,熔点为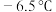 ,沸点为
,沸点为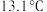 ,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知:
,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知: 具有较强的还原性。
具有较强的还原性。
(1)D装置中盛放 的仪器名称为
的仪器名称为_______ ,检验A装置气密性的方法是_______ 。
(2)A装置中发生反应生成 的离子方程式为
的离子方程式为_______ , 的作用是
的作用是_______ 。
(3)B、C装置中盛放的试剂相同,其作用是_______ 。F装置的作用是降低温度,其中干冰起作用的原因是_______ 。
(4)在 条件下,由
条件下,由 和
和 制备氯化氰的化学方程式为
制备氯化氰的化学方程式为_______ ,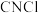 的电子式为
的电子式为_______ 。
(5)上述实验中, 完全反应时收集到
完全反应时收集到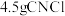 ,则产率为
,则产率为_______ %(保留2位小数)。
 ,又名氯甲氰,熔点为
,又名氯甲氰,熔点为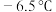 ,沸点为
,沸点为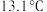 ,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知:
,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知: 具有较强的还原性。
具有较强的还原性。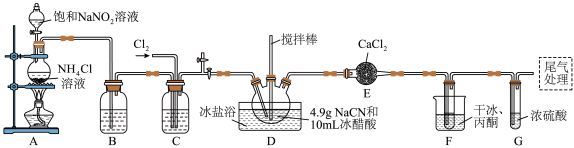
(1)D装置中盛放
 的仪器名称为
的仪器名称为(2)A装置中发生反应生成
 的离子方程式为
的离子方程式为 的作用是
的作用是(3)B、C装置中盛放的试剂相同,其作用是
(4)在
 条件下,由
条件下,由 和
和 制备氯化氰的化学方程式为
制备氯化氰的化学方程式为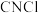 的电子式为
的电子式为(5)上述实验中,
 完全反应时收集到
完全反应时收集到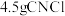 ,则产率为
,则产率为
您最近一年使用:0次
2 . 化学实验是研究物质及其变化的基本方法。
(1)过氧化氢和稀盐酸的混合溶液可以刻蚀含铜的电路板。请写出用过氧化氢和稀盐酸刻蚀电路板时发生反应的离子方程式:___________ 。当反应一段时间后,随着溶液变蓝,气泡产生的速率加快,其可能的原因是___________ 。
(2)含铜电路板也可以用 进行刻蚀,对刻蚀后的液体(
进行刻蚀,对刻蚀后的液体(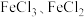 和
和 )进行处理后制备
)进行处理后制备 ,简易流程如图所示:
,简易流程如图所示:

①试剂a是___________ 。
②滤渣1的主要成分是___________ (填化学式)。
③往溶液A中逐滴加入氨水至过量时,可观察到的实验现象为___________ 。
(3) 和
和 是氮元素的两种重要的氢化物。
是氮元素的两种重要的氢化物。
① 常用作制冷剂的原因为
常用作制冷剂的原因为___________ 。
② 能使锅炉内壁的铁锈
能使锅炉内壁的铁锈 变成磁性氧化层,减缓锅炉锈蚀,且不产生污染物。
变成磁性氧化层,减缓锅炉锈蚀,且不产生污染物。 的结构式为
的结构式为___________ ;写出 与铁锈反应的化学方程式:
与铁锈反应的化学方程式:___________ 。
(1)过氧化氢和稀盐酸的混合溶液可以刻蚀含铜的电路板。请写出用过氧化氢和稀盐酸刻蚀电路板时发生反应的离子方程式:
(2)含铜电路板也可以用
 进行刻蚀,对刻蚀后的液体(
进行刻蚀,对刻蚀后的液体(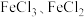 和
和 )进行处理后制备
)进行处理后制备 ,简易流程如图所示:
,简易流程如图所示:
①试剂a是
②滤渣1的主要成分是
③往溶液A中逐滴加入氨水至过量时,可观察到的实验现象为
(3)
 和
和 是氮元素的两种重要的氢化物。
是氮元素的两种重要的氢化物。①
 常用作制冷剂的原因为
常用作制冷剂的原因为②
 能使锅炉内壁的铁锈
能使锅炉内壁的铁锈 变成磁性氧化层,减缓锅炉锈蚀,且不产生污染物。
变成磁性氧化层,减缓锅炉锈蚀,且不产生污染物。 的结构式为
的结构式为 与铁锈反应的化学方程式:
与铁锈反应的化学方程式:
您最近一年使用:0次
解题方法
3 . 有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题:
(1)D基态原子中能量最高的电子其原子轨道呈______ 形。
(2)G位于元素周期表的位置为:____________ ,位于______ 区,价电子排布式为______ 。
(3)写出由A、B、E三种元素形成的离子化合物的电子式____________ 。
(4)检验F元素的方法是____________ ,请用原子结构的知识解释产生此现象的原因是________________________ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1个 |
C元素原子的第一至第四电离能分别是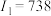 kJ·mol kJ·mol ; ;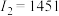 kJ·mol kJ·mol ; ;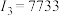 kJ·mol kJ·mol ; ;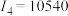 kJ·mol kJ·mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)G位于元素周期表的位置为:
(3)写出由A、B、E三种元素形成的离子化合物的电子式
(4)检验F元素的方法是
您最近一年使用:0次
4 .  、
、 都是重要的有机反应中间体,下列说法正确的是
都是重要的有机反应中间体,下列说法正确的是
 、
、 都是重要的有机反应中间体,下列说法正确的是
都是重要的有机反应中间体,下列说法正确的是A. 的球棍模型为 的球棍模型为 | B. 中C-H为 中C-H为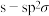 |
C. 中键角为109°28′ 中键角为109°28′ | D. 与 与 形成的化合物中含有离子键 形成的化合物中含有离子键 |
您最近一年使用:0次
解题方法
5 . 自门捷列夫发现元素周期律以来,人类对自然的认识程度逐步加深,元素周期表中的成员数目不断增加。回答下列问题:
(l)2016年IUPAC确认了四种新元素,其中一种为Mc,中文为“镆”。元素Mc可由反应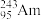 +
+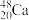 →288Mc+3
→288Mc+3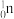 得到。该元素的质子数为
得到。该元素的质子数为_______ ,287Mc与288Mc互为________ 。
(2)Mc位于元素周期表中第VA族,同族元素N的一种氢化物为NH2NH2,写出该化合物分子的电子式__________ ,该分子内存在的共价键类型有_________ 。
(3)该族中的另一元素P能呈现多种化合价,其中+3价氧化物的分子式为_________ ,该氧化物对应的水化物为H3PO3,已知该酸与足量NaOH溶液反应所得产物化学式为Na2HPO3,则Na2HPO3是________ (填“正盐”或“酸式盐”)。
(l)2016年IUPAC确认了四种新元素,其中一种为Mc,中文为“镆”。元素Mc可由反应
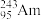 +
+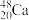 →288Mc+3
→288Mc+3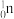 得到。该元素的质子数为
得到。该元素的质子数为(2)Mc位于元素周期表中第VA族,同族元素N的一种氢化物为NH2NH2,写出该化合物分子的电子式
(3)该族中的另一元素P能呈现多种化合价,其中+3价氧化物的分子式为
您最近一年使用:0次
名校
解题方法
6 . 金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO。
(1)Ca元素在周期表中位置是_________ ,其原子结构示意图_________ 。
(2)Ca与最活跃的非金属元素A形成化合物D,D的电子式为_________ 。
(3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则金属M为______ ;检测Mn+的方法是_______________________________________ (用离子方程式表达)。
(4)取1.6g钙线试样,与水充分反映,生成224ml.H2(标准状况),在想溶液中通入适量的CO2,最多能得到CaCO3_____________ g。
(1)Ca元素在周期表中位置是
(2)Ca与最活跃的非金属元素A形成化合物D,D的电子式为
(3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则金属M为
(4)取1.6g钙线试样,与水充分反映,生成224ml.H2(标准状况),在想溶液中通入适量的CO2,最多能得到CaCO3
您最近一年使用:0次
名校
7 . 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构与双氧水分子相似。常温下,S2Cl2是一种橙黄色液体,遇水可发生反应,并产生能使品红褪色的气体。下列说法中不正确的是
| A.S2Br2与S2Cl2结构相似,沸点S2Br2 > S2Cl2 |
| B.S2Cl2的结构式为Cl—S—S—Cl |
| C.S2Cl2中S显—1价 |
| D.2S2Cl2+2H2O=SO2↑+3S↓+4HCl |
您最近一年使用:0次
2017-05-25更新
|
1172次组卷
|
4卷引用:山西省太原市第五中学2016-2017学年高一5月月考化学试题2
解题方法
8 . A.B.C.D.E.F六种短周期元素的原子序数依次增大。已知A.C.F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
(1)写出下列元素的符号A___________ ,D___________ ,E___________ ;
(2)用电子式表示B、F形成的化合物___________ ;
(3)A、C两种元素最高价氧化物的水化物之间反应的离子方程式_____________ ;
(4)D的固态氧化物是________ 晶体。含n mol D的氧化物的晶体中含D-O共价键为_______ mol
(1)写出下列元素的符号A
(2)用电子式表示B、F形成的化合物
(3)A、C两种元素最高价氧化物的水化物之间反应的离子方程式
(4)D的固态氧化物是
您最近一年使用:0次



