名校
1 . 黄铁矿的主要成分是 ,其晶胞为立方体,结构如图,
,其晶胞为立方体,结构如图, 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是
 ,其晶胞为立方体,结构如图,
,其晶胞为立方体,结构如图, 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是
A.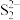 的电子式为 的电子式为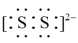 |
B.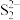 位于由距离最近的 位于由距离最近的 形成的正八面体空隙中 形成的正八面体空隙中 |
| C.该物质中存在的化学键只有离子键 |
D.晶体的密度为 |
您最近半年使用:0次
名校
2 . 氯化氰 ,又名氯甲氰,熔点为
,又名氯甲氰,熔点为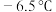 ,沸点为
,沸点为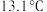 ,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知:
,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知: 具有较强的还原性。
具有较强的还原性。
(1)D装置中盛放 的仪器名称为
的仪器名称为_______ ,检验A装置气密性的方法是_______ 。
(2)A装置中发生反应生成 的离子方程式为
的离子方程式为_______ , 的作用是
的作用是_______ 。
(3)B、C装置中盛放的试剂相同,其作用是_______ 。F装置的作用是降低温度,其中干冰起作用的原因是_______ 。
(4)在 条件下,由
条件下,由 和
和 制备氯化氰的化学方程式为
制备氯化氰的化学方程式为_______ ,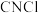 的电子式为
的电子式为_______ 。
(5)上述实验中, 完全反应时收集到
完全反应时收集到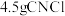 ,则产率为
,则产率为_______ %(保留2位小数)。
 ,又名氯甲氰,熔点为
,又名氯甲氰,熔点为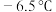 ,沸点为
,沸点为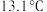 ,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知:
,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知: 具有较强的还原性。
具有较强的还原性。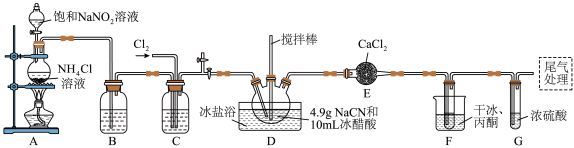
(1)D装置中盛放
 的仪器名称为
的仪器名称为(2)A装置中发生反应生成
 的离子方程式为
的离子方程式为 的作用是
的作用是(3)B、C装置中盛放的试剂相同,其作用是
(4)在
 条件下,由
条件下,由 和
和 制备氯化氰的化学方程式为
制备氯化氰的化学方程式为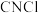 的电子式为
的电子式为(5)上述实验中,
 完全反应时收集到
完全反应时收集到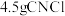 ,则产率为
,则产率为
您最近半年使用:0次
名校
3 . 回答下列问题:
(1)①写出NH3的电子式_______ ;
②甘氨酸的结构简式为_______ 。
(2)写出碳和浓硫酸加热时发生反应的化学方程式_______ ;
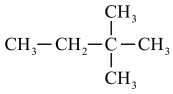
(3)图的系统命名法的名称_______ ,其二氯代物有_______ 种。
(1)①写出NH3的电子式
②甘氨酸的结构简式为
(2)写出碳和浓硫酸加热时发生反应的化学方程式
(3)图的系统命名法的名称
您最近半年使用:0次
4 . 下列化学用语表示正确的是
A.中子数为32的铁原子: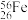 |
B. 中的 中的 夹角为109°28′ 夹角为109°28′ |
C. 的电子式为 的电子式为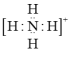 ,离子呈平面正方形结构 ,离子呈平面正方形结构 |
D.金刚石与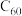 互为同素异形体 互为同素异形体 |
您最近半年使用:0次
5 . 工业上利用反应 合成二甲醚。下列说法正确的是
合成二甲醚。下列说法正确的是
 合成二甲醚。下列说法正确的是
合成二甲醚。下列说法正确的是A.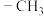 的电子式: 的电子式: | B.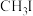 是极性分子 是极性分子 |
C.二甲醚的键线式: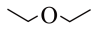 | D.该反应可以在水溶液中进行 |
您最近半年使用:0次
名校
6 . 下列有关化学用语表述正确的是
A.过氧化氢的电子式: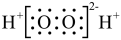 |
| B.HClO的结构式: H-Cl-O |
C.用电子式表示CO2的形成过程为 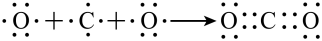 |
D.用电子式表示 的形成过程为 的形成过程为 |
您最近半年使用:0次
2024·上海·模拟预测
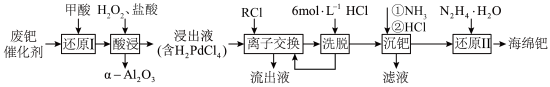
7 . 钯催化剂(主要成分为Pd、α-Al2O3,还含少量铁、铜等)是石油化工中催化加氢和催化氧化等反应的重要催化剂。一种从废钯催化剂中回收海绵钯的工艺流程如下:
②常温下,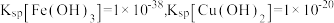 。
。
回答下列问题:
(1)“还原Ⅰ”过程中加入甲酸的主要目的是还原___________ (填化学式)。
(2)“酸浸”过程中Pd转化的离子方程式为___________ 。
(3)“酸浸”过程中温度、固液比对浸取率的影响如图,则“酸浸”最佳条件为___________ 。 ,流出液通入NH3调节pH后过滤,滤液经一系列操作可以得到CuCl2·2H2O。若假设流出液中各金属离子的浓度均为0.01 mol/L,常温下,需要调节pH的范围是
,流出液通入NH3调节pH后过滤,滤液经一系列操作可以得到CuCl2·2H2O。若假设流出液中各金属离子的浓度均为0.01 mol/L,常温下,需要调节pH的范围是___________ 。
(5)“沉钯”过程钯元素主要发生如下转化:H2PdCl4 (稀溶液) [Pd(NH3)4]Cl2 (稀溶液)
[Pd(NH3)4]Cl2 (稀溶液) [Pd(NH3)2]Cl2(沉淀)。则滤液中溶质的主要成分为
[Pd(NH3)2]Cl2(沉淀)。则滤液中溶质的主要成分为___________ (填化学式)。
(6)N2H4的电子式为___________ 。
(7)“还原Ⅱ”过程中产生无毒无害气体。由[Pd(NH3)2]Cl2生成海绵钯的化学方程式为___________ 。
(8)H2和O2在钯的配合物离子[PdCl4]2-的作用下合成H2O2,反应历程如图。下列说法不正确的是 。
②常温下,
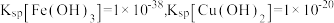 。
。回答下列问题:
(1)“还原Ⅰ”过程中加入甲酸的主要目的是还原
(2)“酸浸”过程中Pd转化的离子方程式为
(3)“酸浸”过程中温度、固液比对浸取率的影响如图,则“酸浸”最佳条件为

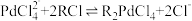 ,流出液通入NH3调节pH后过滤,滤液经一系列操作可以得到CuCl2·2H2O。若假设流出液中各金属离子的浓度均为0.01 mol/L,常温下,需要调节pH的范围是
,流出液通入NH3调节pH后过滤,滤液经一系列操作可以得到CuCl2·2H2O。若假设流出液中各金属离子的浓度均为0.01 mol/L,常温下,需要调节pH的范围是(5)“沉钯”过程钯元素主要发生如下转化:H2PdCl4 (稀溶液)
 [Pd(NH3)4]Cl2 (稀溶液)
[Pd(NH3)4]Cl2 (稀溶液) [Pd(NH3)2]Cl2(沉淀)。则滤液中溶质的主要成分为
[Pd(NH3)2]Cl2(沉淀)。则滤液中溶质的主要成分为(6)N2H4的电子式为
(7)“还原Ⅱ”过程中产生无毒无害气体。由[Pd(NH3)2]Cl2生成海绵钯的化学方程式为
(8)H2和O2在钯的配合物离子[PdCl4]2-的作用下合成H2O2,反应历程如图。下列说法不正确的是 。

| A.H2O2中存在极性键和非极性键 |
| B.[PdCl4]2-中Pd2+提供空轨道形成配位键 |
| C.反应①、②、③均属于氧化还原反应 |
| D.等物质的量的H2和O2发生反应时,反应①和反应②转移的电子数之比为1:1 |
您最近半年使用:0次
2024高三·全国·专题练习
解题方法
8 . 化学需氧量(COD)是指用强氧化剂将1 L废水中的还原性物质氧化为二氧化碳和水所消耗的氧化剂的量,并换算成以O2为氧化剂时所消耗O2的质量。水体COD值常作为水体中有机污染物相对含量的综合指标之一,Fenton(Fe2+/H2O2)法能产生Fe3+和具有强氧化性的羟基自由基(·OH)引发一系列链式反应,被广泛应用于有机废水的治理。
(1)羟基自由基(·OH)的电子式为___________ 。
(2)分别取初始pH=4、COD=80的废水200 mL,加入200 mL H2O2,改变起始投加FeSO4·7H2O的量,反应相同时间。测得反应后水样COD随Fe2+投加量的关系如图所示。当Fe2+投加量超过1 g·L-1时,反应后水样COD不降反升的原因可能是___________ 。 )的氧化技术引起关注。研究发现,一种Mn3O4石墨烯纳米复合材料对催化活化S2O
)的氧化技术引起关注。研究发现,一种Mn3O4石墨烯纳米复合材料对催化活化S2O 产生SO
产生SO 具有很好的效果。S2O
具有很好的效果。S2O 结构如图所示。
结构如图所示。 的使用范围更广。SO
的使用范围更广。SO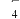 在强碱性条件下反应生成·OH,写出该反应的离子方程式:
在强碱性条件下反应生成·OH,写出该反应的离子方程式:___________ 。
② 一种制取Mn3O4—石墨烯纳米复合材料的物种转化关系可表示如下(GO表示石墨烯):___________ mol。
③利用该复合材料催化活化S2O 并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为
并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为___________ 。
(1)羟基自由基(·OH)的电子式为
(2)分别取初始pH=4、COD=80的废水200 mL,加入200 mL H2O2,改变起始投加FeSO4·7H2O的量,反应相同时间。测得反应后水样COD随Fe2+投加量的关系如图所示。当Fe2+投加量超过1 g·L-1时,反应后水样COD不降反升的原因可能是
 )的氧化技术引起关注。研究发现,一种Mn3O4石墨烯纳米复合材料对催化活化S2O
)的氧化技术引起关注。研究发现,一种Mn3O4石墨烯纳米复合材料对催化活化S2O 产生SO
产生SO 具有很好的效果。S2O
具有很好的效果。S2O 结构如图所示。
结构如图所示。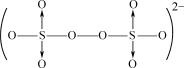
 的使用范围更广。SO
的使用范围更广。SO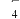 在强碱性条件下反应生成·OH,写出该反应的离子方程式:
在强碱性条件下反应生成·OH,写出该反应的离子方程式:② 一种制取Mn3O4—石墨烯纳米复合材料的物种转化关系可表示如下(GO表示石墨烯):
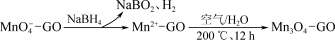
③利用该复合材料催化活化S2O
 并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为
并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为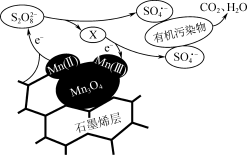
您最近半年使用:0次
名校
解题方法
9 . 硫氰化钾(KSCN)是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图实验装置模拟工业制备 KSCN 并进行相关探究实验。___________ 。
(2)装置A用于实验室制备氨气,反应的化学方程式为___________ 。
(3)装置B中,三颈烧瓶内盛放有 CS₂、水和固体催化剂,通入氨气的导管口需要浸没在 CS₂液体中,其目的是___________ (写两点)。
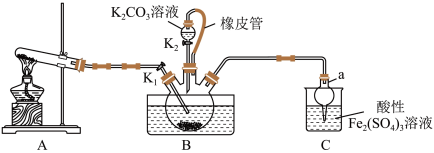
(4)KSCN 溶液的制备:实验开始时打开K₁,加热装置A、D,待三颈烧瓶内液体不分层后,熄灭装置A处的酒精灯,关闭K₁,移开水浴。将装置B继续加热至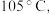 待 NH₄HS 完全分解后(
待 NH₄HS 完全分解后(  打开 K₂,缓缓滴入适量的)
打开 K₂,缓缓滴入适量的)  溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是
溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是___________ 。
(5)尾气处理:装置C 中仪器a的名称是___________ ,酸性Fe₂(SO₄)₃溶液用于除去尾气中两种污染性气体,其中一种气体M能使酚酞溶液变红,另一种气体N能使溶液产生淡黄色沉淀,写出除去气体N的离子方程式___________ 。
(6)过滤装置C中吸收尾气后的悬浊液,得到滤液x。取少量滤液x进行如图实验[已知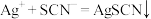 (白色)]:
(白色)]:___________ [可供选择的试剂: 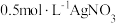 溶液、
溶液、 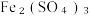 溶液、
溶液、 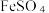 溶液、
溶液、  溶液]。
溶液]。

(2)装置A用于实验室制备氨气,反应的化学方程式为
(3)装置B中,三颈烧瓶内盛放有 CS₂、水和固体催化剂,通入氨气的导管口需要浸没在 CS₂液体中,其目的是
(4)KSCN 溶液的制备:实验开始时打开K₁,加热装置A、D,待三颈烧瓶内液体不分层后,熄灭装置A处的酒精灯,关闭K₁,移开水浴。将装置B继续加热至
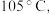 待 NH₄HS 完全分解后(
待 NH₄HS 完全分解后(  打开 K₂,缓缓滴入适量的)
打开 K₂,缓缓滴入适量的)  溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是
溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是(5)尾气处理:装置C 中仪器a的名称是
(6)过滤装置C中吸收尾气后的悬浊液,得到滤液x。取少量滤液x进行如图实验[已知
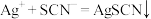 (白色)]:
(白色)]: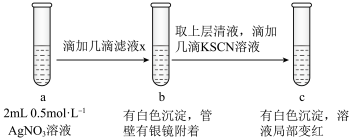
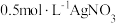 溶液、
溶液、 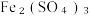 溶液、
溶液、 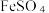 溶液、
溶液、  溶液]。
溶液]。
您最近半年使用:0次
解题方法
10 . 利用零价铁(Fe)耦合过硫酸盐( )和过氧化氢产生自由基去除污水中的有机化合物是目前研究的热点。其中自由基
)和过氧化氢产生自由基去除污水中的有机化合物是目前研究的热点。其中自由基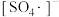 和HO·产生的机理如图所示。
和HO·产生的机理如图所示。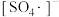 的结构式是
的结构式是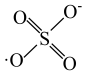 ,则
,则 的结构式是
的结构式是___________ 。
(2)过程ⅰ中反应的离子方程式是___________ 。
(3)过程ⅱ会导致溶液酸性增强,其中硫元素在反应前后均为+6价。该过程参与反应的物质还有(填化学式)___________ 。
(4)探究零价铁和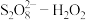 混合氧化剂体系降解水样中有机化合物M的能力。
混合氧化剂体系降解水样中有机化合物M的能力。
Ⅰ.通过加入甲醇或叔丁醇探究不同自由基降解M的能力。测得M的残留百分含量随时间变化如图所示。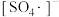 ,叔丁醇只消耗HO·
,叔丁醇只消耗HO·
a.X中加入的是___________ (填“甲醇”或“叔丁醇")。
b.0~20min,Z中降解M的自由基主要是HO·,判断依据是___________ 。
Ⅱ.探究混合氧化剂中 的物质的量分数对水样中总有机碳(TOC)去除率的影响。实验开始时,水样的pH=7且加入的
的物质的量分数对水样中总有机碳(TOC)去除率的影响。实验开始时,水样的pH=7且加入的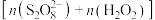 相同,其他条件不变。在相同时间内测得的实验数据如图所示。
相同,其他条件不变。在相同时间内测得的实验数据如图所示。
a.从①到④,TOC去除率升高的原因是___________ 。
b.从④到⑦,TOC去除率下降的原因是___________ 。
 )和过氧化氢产生自由基去除污水中的有机化合物是目前研究的热点。其中自由基
)和过氧化氢产生自由基去除污水中的有机化合物是目前研究的热点。其中自由基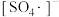 和HO·产生的机理如图所示。
和HO·产生的机理如图所示。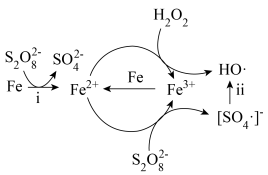
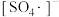 的结构式是
的结构式是 ,则
,则 的结构式是
的结构式是(2)过程ⅰ中反应的离子方程式是
(3)过程ⅱ会导致溶液酸性增强,其中硫元素在反应前后均为+6价。该过程参与反应的物质还有(填化学式)
(4)探究零价铁和
 混合氧化剂体系降解水样中有机化合物M的能力。
混合氧化剂体系降解水样中有机化合物M的能力。Ⅰ.通过加入甲醇或叔丁醇探究不同自由基降解M的能力。测得M的残留百分含量随时间变化如图所示。
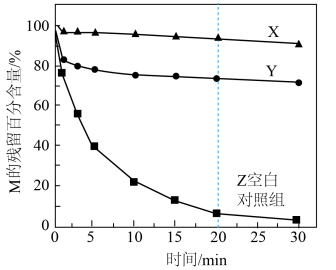
 ,叔丁醇只消耗HO·
,叔丁醇只消耗HO·a.X中加入的是
b.0~20min,Z中降解M的自由基主要是HO·,判断依据是
Ⅱ.探究混合氧化剂中
 的物质的量分数对水样中总有机碳(TOC)去除率的影响。实验开始时,水样的pH=7且加入的
的物质的量分数对水样中总有机碳(TOC)去除率的影响。实验开始时,水样的pH=7且加入的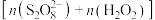 相同,其他条件不变。在相同时间内测得的实验数据如图所示。
相同,其他条件不变。在相同时间内测得的实验数据如图所示。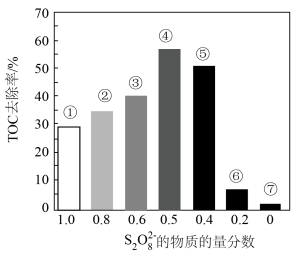
a.从①到④,TOC去除率升高的原因是
b.从④到⑦,TOC去除率下降的原因是
您最近半年使用:0次



