1 . 下列化学用语表示正确的是
A.中子数为32的铁原子: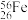 |
B. 中的 中的 夹角为109°28′ 夹角为109°28′ |
C. 的电子式为 的电子式为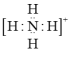 ,离子呈平面正方形结构 ,离子呈平面正方形结构 |
D.金刚石与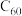 互为同素异形体 互为同素异形体 |
您最近一年使用:0次
名校
2 . 完成下列小题
(1)现有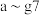 种短周期元素,它们在周期表中的位置如图,请据此回答下列问题:
种短周期元素,它们在周期表中的位置如图,请据此回答下列问题:
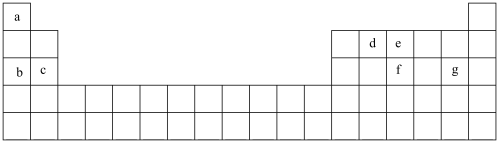
①元素 和f在周期表中的位置
和f在周期表中的位置_____ ,_____ 。
②用电子式表示由 与
与 元素组成化合物的形成过程:
元素组成化合物的形成过程:_____ 。
③元素的原子间反应最容易形成离子键的是_____ 。
A.c和f B.b和g C.d和g D.b和
④ 与
与 元素形成的分子中所有原子
元素形成的分子中所有原子_____ (填“是”或“不是”)都满足最外层为8电子结构
(2) 和
和 代表原子序数依次增大的四种短周期元素,它们满足以下条件:
代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中, 与
与 相邻,
相邻, 与
与 也相邻;②
也相邻;② 、
、 和
和 三种元素的原子最外层电子数之和为17.请填空:
三种元素的原子最外层电子数之和为17.请填空:
①下列元素的符号:
_____ 、
_____ 、
_____ 。
② 和
和 可组成一化合物,其原子个数之比为
可组成一化合物,其原子个数之比为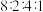 。写出该化合物的化学式
。写出该化合物的化学式_____ 。
(1)现有
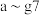 种短周期元素,它们在周期表中的位置如图,请据此回答下列问题:
种短周期元素,它们在周期表中的位置如图,请据此回答下列问题:
①元素
 和f在周期表中的位置
和f在周期表中的位置②用电子式表示由
 与
与 元素组成化合物的形成过程:
元素组成化合物的形成过程:③元素的原子间反应最容易形成离子键的是
A.c和f B.b和g C.d和g D.b和

④
 与
与 元素形成的分子中所有原子
元素形成的分子中所有原子(2)
 和
和 代表原子序数依次增大的四种短周期元素,它们满足以下条件:
代表原子序数依次增大的四种短周期元素,它们满足以下条件:①元素周期表中,
 与
与 相邻,
相邻, 与
与 也相邻;②
也相邻;② 、
、 和
和 三种元素的原子最外层电子数之和为17.请填空:
三种元素的原子最外层电子数之和为17.请填空:①下列元素的符号:



②
 和
和 可组成一化合物,其原子个数之比为
可组成一化合物,其原子个数之比为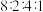 。写出该化合物的化学式
。写出该化合物的化学式
您最近一年使用:0次
解题方法
3 . 钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态K原子中,核外电子占据最高能层的符号是___________ 。占据该能层电子的电子云轮廓图形状为___________ 。
(2)元素K的焰色为___________ 色。单质K的密度比Na___________ (填“大”或“小”)。
(3)I的原子结构示意图为___________ 。
(4)X射线衍射测定发现,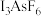 中存在
中存在 离子。
离子。 离子的空间结构为
离子的空间结构为___________ 。
(5) 晶体是一种性能良好的非线性光学材料,其晶胞结构如图所示,晶胞中K、I、O分别处于顶角、体心、面心位置,棱长为anm。K与O间的最短距离为
晶体是一种性能良好的非线性光学材料,其晶胞结构如图所示,晶胞中K、I、O分别处于顶角、体心、面心位置,棱长为anm。K与O间的最短距离为___________ nm,与K紧邻的O个数为___________ 。
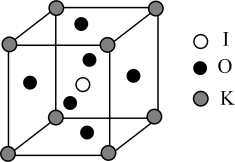
(6)在 晶胞结构的另一种表示中,I处于各顶角位置,则K处于
晶胞结构的另一种表示中,I处于各顶角位置,则K处于___________ 位置,O处于___________ 位置。
(1)基态K原子中,核外电子占据最高能层的符号是
(2)元素K的焰色为
(3)I的原子结构示意图为
(4)X射线衍射测定发现,
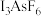 中存在
中存在 离子。
离子。 离子的空间结构为
离子的空间结构为(5)
 晶体是一种性能良好的非线性光学材料,其晶胞结构如图所示,晶胞中K、I、O分别处于顶角、体心、面心位置,棱长为anm。K与O间的最短距离为
晶体是一种性能良好的非线性光学材料,其晶胞结构如图所示,晶胞中K、I、O分别处于顶角、体心、面心位置,棱长为anm。K与O间的最短距离为
(6)在
 晶胞结构的另一种表示中,I处于各顶角位置,则K处于
晶胞结构的另一种表示中,I处于各顶角位置,则K处于
您最近一年使用:0次
解题方法
4 . Na、Mg、Fe、Cu是四种重要的金属元素。回答下列问题:
(1)基态Mg原子的价层电子轨道表示式为__________________ 。
(2) 的电子式为
的电子式为____________ 。
(3)在钢铁厂的生产中,炽热的铁水注入模具之前,模具必须进行充分的干燥处理,不得留有水,请用化学方程式解释原因:__________________ 。
(4)检验 溶液中是否残留
溶液中是否残留 的试剂是
的试剂是__________________ 。
(5)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式为 ,加入
,加入 的目的是
的目的是____________ 。
(6)采用空气和Na为原料可直接制备 。空气与熔融金属Na反应前,需依次通过
。空气与熔融金属Na反应前,需依次通过____________ 、____________ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d. 溶液
溶液
(7)天然碱的主要成分为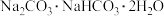 ,2 mol
,2 mol 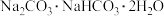 经充分加热得到
经充分加热得到 的质量为
的质量为______ g。
(8)一个 晶胞(如图)中,Cu原子的数目为
晶胞(如图)中,Cu原子的数目为______ 。
(1)基态Mg原子的价层电子轨道表示式为
(2)
 的电子式为
的电子式为(3)在钢铁厂的生产中,炽热的铁水注入模具之前,模具必须进行充分的干燥处理,不得留有水,请用化学方程式解释原因:
(4)检验
 溶液中是否残留
溶液中是否残留 的试剂是
的试剂是(5)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式为
 ,加入
,加入 的目的是
的目的是(6)采用空气和Na为原料可直接制备
 。空气与熔融金属Na反应前,需依次通过
。空气与熔融金属Na反应前,需依次通过a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.
 溶液
溶液(7)天然碱的主要成分为
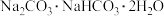 ,2 mol
,2 mol 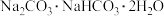 经充分加热得到
经充分加热得到 的质量为
的质量为(8)一个
 晶胞(如图)中,Cu原子的数目为
晶胞(如图)中,Cu原子的数目为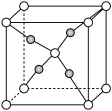
您最近一年使用:0次
2023-02-20更新
|
541次组卷
|
4卷引用:天津市南开区2022~2023 学年高三上学期阶段性质量监测 (二) 化学试题
天津市南开区2022~2023 学年高三上学期阶段性质量监测 (二) 化学试题(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(结构与性质)天津市八校2024届高三下学期联合模拟考试化学试题(二)(已下线)结构与性质
名校
解题方法
5 . 普瑞巴林(Pregabalin),化学名称(S)-3-氨甲基-5-甲基己酸,分子式为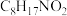 ,是一种抗癫痫药,临床上主要治疗带状疱疹后神经痛。其结构简式为
,是一种抗癫痫药,临床上主要治疗带状疱疹后神经痛。其结构简式为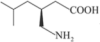 。其合成路线如图:
。其合成路线如图:
已知:
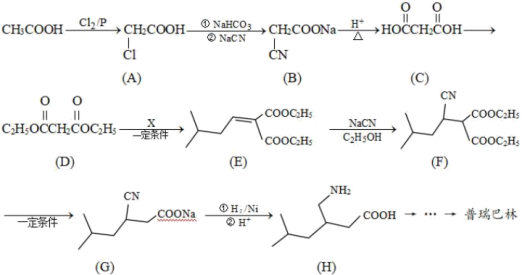
(1)普瑞巴林分子含氧官能团的名称为_______ , 的电子式为
的电子式为_______ 。
(2)A→B的有机反应类型为_______ ;写出C→D的化学反应方程式_______ 。
(3)上述转化关系中的有机物X的结构简式:_______ 。
(4)写出分子式为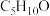 ,且能发生银镜反应的同分异构体共
,且能发生银镜反应的同分异构体共_______ 种,其中有两种化学环境不同的氢原子的物质的结构简式为:_______ 。
(5)参考以上合成路线及反应条件,以苯乙酸(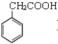 )和必要的无机试剂为原料,合成
)和必要的无机试剂为原料,合成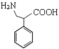 ,写出合成路线流程图
,写出合成路线流程图_____ (无机试剂任选)。
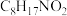 ,是一种抗癫痫药,临床上主要治疗带状疱疹后神经痛。其结构简式为
,是一种抗癫痫药,临床上主要治疗带状疱疹后神经痛。其结构简式为 。其合成路线如图:
。其合成路线如图:已知:


(1)普瑞巴林分子含氧官能团的名称为
 的电子式为
的电子式为(2)A→B的有机反应类型为
(3)上述转化关系中的有机物X的结构简式:
(4)写出分子式为
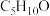 ,且能发生银镜反应的同分异构体共
,且能发生银镜反应的同分异构体共(5)参考以上合成路线及反应条件,以苯乙酸(
 )和必要的无机试剂为原料,合成
)和必要的无机试剂为原料,合成 ,写出合成路线流程图
,写出合成路线流程图
您最近一年使用:0次
2022-05-21更新
|
494次组卷
|
3卷引用:天津市红桥区2022届高三下学期质量调查(二)化学试题
解题方法
6 . 三氯氧磷(POCl3)广泛用于制药等行业。某兴趣小组用过量O2直接氧化PCl3,制备POCl3,反应放出大量热,实验装置设计如图(加持装置已略)
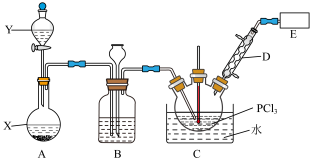
有关物质的部分性质如表:
请按要求回答下列问题:
(1)POCl3的沸点比PCl3的高,推测其可能原因:___ 。
(2)若X为黑色固体,则Y的电子式为___ 。
(3)装置B的作用是___ 。其中盛有的试剂为___ 。
(4)装置C三颈烧瓶中反应的化学方程式为___ 。装置D的作用:___ 。控制温度范围:__ ℃<T<___ ℃。
(5)请在E处画出需补充的装置,并标注盛装药品名称___ 。
(6)反应一段时间后,测定装置C中产品的Cl元素的含量的实验步骤如下:
Ⅰ.取m克产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加入足量试剂M;
Ⅱ.向锥形瓶中加入0.1000mol·L-1的AgNO3溶液50.00mL,使Cl-完全沉淀;
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖:
Ⅳ.加入指示剂,用cmol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①试剂M为___ 。
②Cl元素的质量分数=___ (列出算式)。
③若取消步骤Ⅱ,会使步骤Ⅳ中将出现两种沉淀共存,此时c(Cl-):c(SCN-)=___ 。这样操作会造成结果___ (填“偏大”或“偏小”或“无影响”)。

有关物质的部分性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
(1)POCl3的沸点比PCl3的高,推测其可能原因:
(2)若X为黑色固体,则Y的电子式为
(3)装置B的作用是
(4)装置C三颈烧瓶中反应的化学方程式为
(5)请在E处画出需补充的装置,并标注盛装药品名称
(6)反应一段时间后,测定装置C中产品的Cl元素的含量的实验步骤如下:
Ⅰ.取m克产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加入足量试剂M;
Ⅱ.向锥形瓶中加入0.1000mol·L-1的AgNO3溶液50.00mL,使Cl-完全沉淀;
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖:
Ⅳ.加入指示剂,用cmol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①试剂M为
②Cl元素的质量分数=
③若取消步骤Ⅱ,会使步骤Ⅳ中将出现两种沉淀共存,此时c(Cl-):c(SCN-)=
您最近一年使用:0次
7 . 氯及其化合物在工农业生产和生命活动中起着重要的作用,但同时又是环境污染的主要物质,研究其转化规律一直是科学家们的热点问题,回答下列问题:
Ⅰ.(1)将氨氮( )废水中的氮元素转变为N2脱除,其机理如下;
)废水中的氮元素转变为N2脱除,其机理如下;

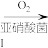 NO
NO
 N2
N2
已知:氧气浓度过高时, 会被氧化成
会被氧化成 。
。
(1)参与I中反应的n( ):n(O2)=
):n(O2)=___________
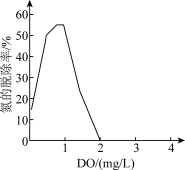
(2)废水溶解氧浓度(DO)对氮的脱除率的影响如图,当DO>2mg/L时,氮的脱际率为0,其原因可能是厌氧氨氧化菌被抑制,Ⅱ中反应无法发生:还有可能是___________
(3)经上述工艺处理后,排出的水中含有一定量 ,可以通过改进工艺提高氮的脱除率。
,可以通过改进工艺提高氮的脱除率。
①加入还原铁粉能有效除去 。该过程涉及三个反应(a、b和c)如图,在整个反应过程中几乎监测不到NH
。该过程涉及三个反应(a、b和c)如图,在整个反应过程中几乎监测不到NH 浓度的增加。请从化学反应速率的角度解释其原因:
浓度的增加。请从化学反应速率的角度解释其原因:___________ 。

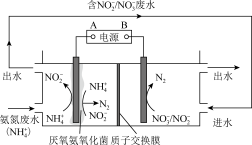
②采用微生物电解工艺也可有效除去 ,其原理如图,A是电源
,其原理如图,A是电源___________ 极。B电极反应式:___________
Ⅱ.(4)二氯氨(NHCl2)是由氢气遇氯气生成的化合物,常用作饮用水二级消毒剂,该物质的电子式为___________ 。
(5)在恒温条件下,将2molCl2和1 mol NH3充入压强可变的密闭容器中反应:
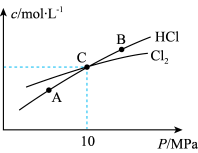
2Cl2(g)+NH3(g) NHCl2(l)+2HCl(g),测得不同压强下平衡时Cl2和HCl的物质的量浓度与压强的关系如图则A、B、C三点中Cl2转化率最高的是
NHCl2(l)+2HCl(g),测得不同压强下平衡时Cl2和HCl的物质的量浓度与压强的关系如图则A、B、C三点中Cl2转化率最高的是___________ 点(填“A”“B”或“C”);计算C点时该反应的压强平衡常数Kp(C)=___________ (Kp是平衡分压代替平衡浓度计算,分压一总压×物质的量分数,)
Ⅰ.(1)将氨氮(
 )废水中的氮元素转变为N2脱除,其机理如下;
)废水中的氮元素转变为N2脱除,其机理如下;
 NO
NO
 N2
N2已知:氧气浓度过高时,
 会被氧化成
会被氧化成 。
。(1)参与I中反应的n(
 ):n(O2)=
):n(O2)=(2)废水溶解氧浓度(DO)对氮的脱除率的影响如图,当DO>2mg/L时,氮的脱际率为0,其原因可能是厌氧氨氧化菌被抑制,Ⅱ中反应无法发生:还有可能是

(3)经上述工艺处理后,排出的水中含有一定量
 ,可以通过改进工艺提高氮的脱除率。
,可以通过改进工艺提高氮的脱除率。①加入还原铁粉能有效除去
 。该过程涉及三个反应(a、b和c)如图,在整个反应过程中几乎监测不到NH
。该过程涉及三个反应(a、b和c)如图,在整个反应过程中几乎监测不到NH 浓度的增加。请从化学反应速率的角度解释其原因:
浓度的增加。请从化学反应速率的角度解释其原因:
②采用微生物电解工艺也可有效除去
 ,其原理如图,A是电源
,其原理如图,A是电源
Ⅱ.(4)二氯氨(NHCl2)是由氢气遇氯气生成的化合物,常用作饮用水二级消毒剂,该物质的电子式为
(5)在恒温条件下,将2molCl2和1 mol NH3充入压强可变的密闭容器中反应:
2Cl2(g)+NH3(g)
 NHCl2(l)+2HCl(g),测得不同压强下平衡时Cl2和HCl的物质的量浓度与压强的关系如图则A、B、C三点中Cl2转化率最高的是
NHCl2(l)+2HCl(g),测得不同压强下平衡时Cl2和HCl的物质的量浓度与压强的关系如图则A、B、C三点中Cl2转化率最高的是
您最近一年使用:0次
名校
解题方法
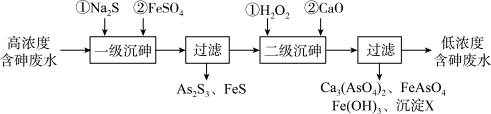
8 . 饮用水中含有砷会导致砷中毒,金属冶炼过程产生的含砷有毒废弃物需处理与检测。冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2-存在反应:As2S3(s)+3S2-(aq)⇌2 (aq);
(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷在元素周期表中的位置为_______ ;AsH3的电子式为______ ;
(2)下列说法正确的是_________ ;
a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.第一电离能:S<P<As
(3)沉淀X为__________ (填化学式);
(4)“一级沉砷”中FeSO4的作用是________ 。
(5)“二级沉砷”中H2O2与含砷物质反应的化学方程式为__________ ;
(6)关于地下水中砷的来源有多种假设,其中一种认为富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成 ,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________ 。

已知:①As2S3与过量的S2-存在反应:As2S3(s)+3S2-(aq)⇌2
 (aq);
(aq);②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷在元素周期表中的位置为
(2)下列说法正确的是
a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.第一电离能:S<P<As
(3)沉淀X为
(4)“一级沉砷”中FeSO4的作用是
(5)“二级沉砷”中H2O2与含砷物质反应的化学方程式为
(6)关于地下水中砷的来源有多种假设,其中一种认为富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成
 ,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
您最近一年使用:0次
解题方法
9 . 我国科学家研制出以石墨烯为载体的催化剂,能在 25℃下,将 CH4与 H2O2反应直接转化为含氧有机物,其主要原理如下图所示:

下列说法正确的是

下列说法正确的是
| A.步骤 i 中有π键断开 |
B.上图中 代表甲醇 代表甲醇 |
| C.步骤 ii 中产生的 H2O 分子中的 H 原子都源于 H2O2分子 |
D.步骤 i 至 vi 总反应为 CH4+3H2O2 CO+5H2O CO+5H2O |
您最近一年使用:0次
名校
10 . 砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为____ ;砷酸的第一步电离方程式为______ 。
(2)“一级沉砷”中FeSO4的作用是_____ ;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_______ 。
(3)沉淀X为____ (填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
(4)AsH3的电子式为______ 。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)
 2AsS33-(aq);
2AsS33-(aq);②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为
(2)“一级沉砷”中FeSO4的作用是
(3)沉淀X为
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
(4)AsH3的电子式为
您最近一年使用:0次
2019-09-27更新
|
339次组卷
|
2卷引用:天津市六校(天津中学、南开中学、实验中学等)2020届高三上学期期初检测化学试题



