名校
解题方法
1 . 下列有关化学用语的使用正确的是
A. 的电子式: 的电子式: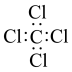 |
B.钠离子结构示意图 |
C.M²⁻核外有a个电子,b个中子,M的原子符号为 |
D.高氯酸的电离方程式 |
您最近一年使用:0次
解题方法
2 .  广泛用于冶金、化工行业,可制取多种含钒化合物。
广泛用于冶金、化工行业,可制取多种含钒化合物。
(1)实验室制备氧钒(Ⅳ)碱式碳酸铵晶体,过程如下: ,反应的化学方程式为
,反应的化学方程式为___________ ;若不加 ,HCl也能还原
,HCl也能还原 生成
生成 和
和 ,分析反应中不生成
,分析反应中不生成 的原因
的原因___________ 。
(2)对制得的晶体进行含钒量的测定:称取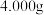 样品,经过系列处理后将钒(Ⅳ)完全氧化,定容为
样品,经过系列处理后将钒(Ⅳ)完全氧化,定容为 溶液;量取
溶液;量取 溶液,加入指示剂,用
溶液,加入指示剂,用 的
的 标准溶液滴定至终点,滴定过程中反应为
标准溶液滴定至终点,滴定过程中反应为 ;平行滴定4次,消耗标准溶液的体积分别为
;平行滴定4次,消耗标准溶液的体积分别为 ,则样品中钒元素的质量分数为
,则样品中钒元素的质量分数为___________ (写出计算过程,结果保留两位小数)。
(3) 时,将氧钒碱式碳酸铵晶体与
时,将氧钒碱式碳酸铵晶体与 反应制备共价晶体
反应制备共价晶体 ,一段时间后,固体质量不再变化,经检测仍有氧钒碱式碳酸铵剩余,可能的原因是
,一段时间后,固体质量不再变化,经检测仍有氧钒碱式碳酸铵剩余,可能的原因是___________ 。
(4) 可溶于强酸强碱,不同
可溶于强酸强碱,不同 、不同钒元素浓度时,
、不同钒元素浓度时, 价
价 存在形态如题图所示:
存在形态如题图所示: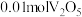 溶解在
溶解在 烧碱溶液中,剩余溶液的
烧碱溶液中,剩余溶液的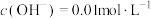 ,反应的离子方程式为
,反应的离子方程式为___________ 。
② 具有对称结构,其结构式可表示为
具有对称结构,其结构式可表示为___________ 。
 广泛用于冶金、化工行业,可制取多种含钒化合物。
广泛用于冶金、化工行业,可制取多种含钒化合物。(1)实验室制备氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:
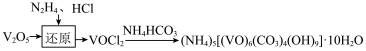
 ,反应的化学方程式为
,反应的化学方程式为 ,HCl也能还原
,HCl也能还原 生成
生成 和
和 ,分析反应中不生成
,分析反应中不生成 的原因
的原因(2)对制得的晶体进行含钒量的测定:称取
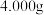 样品,经过系列处理后将钒(Ⅳ)完全氧化,定容为
样品,经过系列处理后将钒(Ⅳ)完全氧化,定容为 溶液;量取
溶液;量取 溶液,加入指示剂,用
溶液,加入指示剂,用 的
的 标准溶液滴定至终点,滴定过程中反应为
标准溶液滴定至终点,滴定过程中反应为 ;平行滴定4次,消耗标准溶液的体积分别为
;平行滴定4次,消耗标准溶液的体积分别为 ,则样品中钒元素的质量分数为
,则样品中钒元素的质量分数为(3)
 时,将氧钒碱式碳酸铵晶体与
时,将氧钒碱式碳酸铵晶体与 反应制备共价晶体
反应制备共价晶体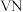 ,一段时间后,固体质量不再变化,经检测仍有氧钒碱式碳酸铵剩余,可能的原因是
,一段时间后,固体质量不再变化,经检测仍有氧钒碱式碳酸铵剩余,可能的原因是(4)
 可溶于强酸强碱,不同
可溶于强酸强碱,不同 、不同钒元素浓度时,
、不同钒元素浓度时, 价
价 存在形态如题图所示:
存在形态如题图所示:
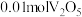 溶解在
溶解在 烧碱溶液中,剩余溶液的
烧碱溶液中,剩余溶液的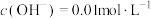 ,反应的离子方程式为
,反应的离子方程式为②
 具有对称结构,其结构式可表示为
具有对称结构,其结构式可表示为
您最近一年使用:0次
名校
解题方法
3 . 学习化学一定要领悟好问题情景。
(1)①书写以下各微粒的电子式。
—OH___________ ,HBrO___________ ,CS2___________ ,NH4H___________ ;
②用电子式表示Na和S形成Na2S的过程___________ 。
(2)氮元素的化合物种类繁多,性质也各不相同。请回答下列问题:
已知:①N2(g)+O2(g)=2NO(g)ΔH=+180.5kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1
③N2(g)+3H2(g)=2NH3(g)ΔH=-92.4kJ·mol-1
则反应:④4NH3(g)+5O2(g)=4NO(g)+6H2O(g)的ΔH=___________ kJ·mol-1。
(3)电负性与原子所处的具体的化学环境紧密相关。有机化合物CH3I和CF3I发生水解时的主要反应分别是:CH3I+H2O→CH3OH+HI和CF₃I+H₂O→CF3H+HIO。从电负性的角度分析,为什么CF3I水解的产物不是HI的原因___________ 。
(4)工业上用Na2SO3吸收尾气中SO2使之转化为NaHSO3,再以SO2为原料设计原电池,然后电解(惰性电极)NaHSO3制取H2SO4,装置如下:
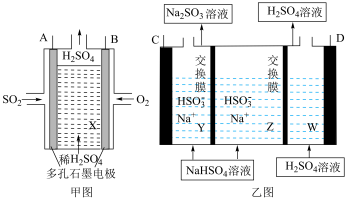
①甲图中A电极上的反应式为___________ 。
②甲图中B与乙图___________ (填“C”或“D”)极相连,进行电解时乙图Z中Na+向___________ (填“Y”或“W”)中移动。
③该电解池阴极的电极反应式为___________ ;
(5)Ni可活化C2H6放出CH4,其反应历程如下图所示:

下列关于活化历程的说法错误的是
(1)①书写以下各微粒的电子式。
—OH
②用电子式表示Na和S形成Na2S的过程
(2)氮元素的化合物种类繁多,性质也各不相同。请回答下列问题:
已知:①N2(g)+O2(g)=2NO(g)ΔH=+180.5kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1
③N2(g)+3H2(g)=2NH3(g)ΔH=-92.4kJ·mol-1
则反应:④4NH3(g)+5O2(g)=4NO(g)+6H2O(g)的ΔH=
(3)电负性与原子所处的具体的化学环境紧密相关。有机化合物CH3I和CF3I发生水解时的主要反应分别是:CH3I+H2O→CH3OH+HI和CF₃I+H₂O→CF3H+HIO。从电负性的角度分析,为什么CF3I水解的产物不是HI的原因
(4)工业上用Na2SO3吸收尾气中SO2使之转化为NaHSO3,再以SO2为原料设计原电池,然后电解(惰性电极)NaHSO3制取H2SO4,装置如下:

①甲图中A电极上的反应式为
②甲图中B与乙图
③该电解池阴极的电极反应式为
(5)Ni可活化C2H6放出CH4,其反应历程如下图所示:

下列关于活化历程的说法错误的是
| A.活化能最大的步骤:中间体2→中间体3 |
| B.只涉及极性键的断裂和生成 |
| C.在此反应过程中Ni的成键数目发生变化 |
D.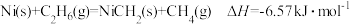 |
您最近一年使用:0次
名校
4 . 纳米银粒是一种杀菌剂,对沙眼衣原体等数十种致病微生物都有强烈的抑制和杀灭作用,而且不会产生耐药性。可通过肼(N2H4)还原银氨溶液制备纳米颗粒。具体步骤如下:
Ⅰ.在洁净的试管中加入2%AgNO3溶液10mL,逐滴加入2%稀氨水,边滴边振荡至沉淀恰好完全溶解。
Ⅱ.取10mLN2H4溶液于大烧杯中并加入5g分散剂混合均匀,加热至55~60℃。
Ⅲ.将Ⅰ中所得溶液滴加到Ⅱ中所得的分散系中,反应15min。
Ⅳ.冷却、分离、洗涤、干燥得纳米银粉。
已知:AgOH是白色难溶于水的物质,常温下极不稳定,分解生成棕色微溶于水的Ag2O。
回答下列问题:
(1)N2H4是一种常用还原剂,写出N2H4的电子式:___________ 。
(2)步骤Ⅲ发生反应的离子方程式为___________ ;验证纳米银颗粒生成的方法是___________ 。
(3)下列有关说法错误的是___________(填字母)。
(4)步骤I使用的AgNO3溶液需用HNO3酸化,其主要目的是___________ 。
(5)若用AgNO3溶液与维生素C以及明胶在一定条件下也可制得纳米银颗粒。
①该体系中维生素C的作用为___________ 。
②已知明胶可与溶液中Ag+形成如下配合物,[Ag(明胶)]+得电子后,明胶继续吸附在银核表面。
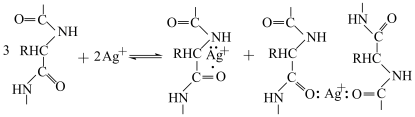
明胶在该体系中充当___________ 。
Ⅰ.在洁净的试管中加入2%AgNO3溶液10mL,逐滴加入2%稀氨水,边滴边振荡至沉淀恰好完全溶解。
Ⅱ.取10mLN2H4溶液于大烧杯中并加入5g分散剂混合均匀,加热至55~60℃。
Ⅲ.将Ⅰ中所得溶液滴加到Ⅱ中所得的分散系中,反应15min。
Ⅳ.冷却、分离、洗涤、干燥得纳米银粉。
已知:AgOH是白色难溶于水的物质,常温下极不稳定,分解生成棕色微溶于水的Ag2O。
回答下列问题:
(1)N2H4是一种常用还原剂,写出N2H4的电子式:
(2)步骤Ⅲ发生反应的离子方程式为
(3)下列有关说法错误的是___________(填字母)。
| A.步骤Ⅰ,银氨溶液也可用AgCl与氨水反应制得 |
| B.步骤Ⅱ,可采用水浴加热 |
| C.步骤Ⅲ,为了加快反应速度,可以一次性加入银氨溶液 |
| D.步骤Ⅳ,洗涤时可先水洗,再用乙醇洗涤 |
(4)步骤I使用的AgNO3溶液需用HNO3酸化,其主要目的是
(5)若用AgNO3溶液与维生素C以及明胶在一定条件下也可制得纳米银颗粒。
①该体系中维生素C的作用为
②已知明胶可与溶液中Ag+形成如下配合物,[Ag(明胶)]+得电子后,明胶继续吸附在银核表面。

明胶在该体系中充当
您最近一年使用:0次
名校
5 . 含氮化合物的处理对环境保护意义重大。研究氮及其化合物的性质,可以有效改善人类的生存环境。
(1)N原子的电子式为___________ 。
(2)用 或CO催化还原NO均能消除污染,反应的氧化产物为
或CO催化还原NO均能消除污染,反应的氧化产物为______ 。
(3)实验室常用NaOH溶液吸收 (NO和
(NO和 的混合气体),反应的化学方程式如下:
的混合气体),反应的化学方程式如下:
 ;
; (已知NO不能与NaOH溶液反应,不考虑
(已知NO不能与NaOH溶液反应,不考虑 与
与 的转化)。
的转化)。
①若 能被NaOH溶液完全吸收,则x的取值范围为
能被NaOH溶液完全吸收,则x的取值范围为______ 。
②若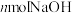 恰好完全反应,则被吸收的
恰好完全反应,则被吸收的 的体积为
的体积为______ L(标准状况)。
③将这两个反应中的产物进行分类,分类方法错误的是______ 。
A.强电解质和弱电解质 B.盐和氧化物
C.离子化合物和共价化合物 D.氧化产物和还原产物
(4)将32.64g铜与200mL一定浓度的硝酸反应,铜完全溶解,产生的NO和 混合气体在标准状况下的体积为11.2L。请回答:
混合气体在标准状况下的体积为11.2L。请回答:
①NO的物质的量为___________ mol, 的体积为
的体积为___________ L(标准状况)。
②待产生的气体全部释放后,向溶液中加入 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为___________  。
。
(1)N原子的电子式为
(2)用
 或CO催化还原NO均能消除污染,反应的氧化产物为
或CO催化还原NO均能消除污染,反应的氧化产物为(3)实验室常用NaOH溶液吸收
 (NO和
(NO和 的混合气体),反应的化学方程式如下:
的混合气体),反应的化学方程式如下: ;
; (已知NO不能与NaOH溶液反应,不考虑
(已知NO不能与NaOH溶液反应,不考虑 与
与 的转化)。
的转化)。①若
 能被NaOH溶液完全吸收,则x的取值范围为
能被NaOH溶液完全吸收,则x的取值范围为②若
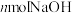 恰好完全反应,则被吸收的
恰好完全反应,则被吸收的 的体积为
的体积为③将这两个反应中的产物进行分类,分类方法错误的是
A.强电解质和弱电解质 B.盐和氧化物
C.离子化合物和共价化合物 D.氧化产物和还原产物
(4)将32.64g铜与200mL一定浓度的硝酸反应,铜完全溶解,产生的NO和
 混合气体在标准状况下的体积为11.2L。请回答:
混合气体在标准状况下的体积为11.2L。请回答:①NO的物质的量为
 的体积为
的体积为②待产生的气体全部释放后,向溶液中加入
 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为 。
。
您最近一年使用:0次
解题方法
6 . 锑( )冶炼过程中产生的副产物主要成分为
)冶炼过程中产生的副产物主要成分为 、
、 、
、 和
和 等,因含银量很高,是重要的银提取原料。从该副产物中提取银的工艺流程如下:
等,因含银量很高,是重要的银提取原料。从该副产物中提取银的工艺流程如下:

已知:①水合肼为 ,有很强的还原性;
,有很强的还原性;
② 在碱性条件下易转化为
在碱性条件下易转化为 ;
;
③常温下, 的溶解度为
的溶解度为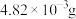 ,
, 的溶解度为0.79g。
的溶解度为0.79g。
回答下列问题:
(1) 的电子式为
的电子式为_______ 。
(2)脱氯渣的主要成分有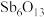 、
、 、
、 和
和_______ 。
(3)“还原脱氯”过程中会产生无色无味无毒气体,则 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(4)“氧化分银”中,不直接用硝酸的原因是_______ 。
(5)“氧化分银”中,银被氧化的离子方程式为_______ 。
(6)“沉铅过滤”中主要析出 的原因是
的原因是_______ 。
(7)“沉铅过滤”中硫酸的用量系数对铅和银的沉淀率影响如图所示。
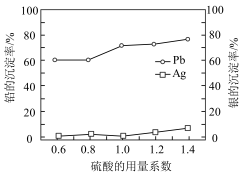
硫酸的用量系数最佳选择是_______ ,理由是_______ 。
 )冶炼过程中产生的副产物主要成分为
)冶炼过程中产生的副产物主要成分为 、
、 、
、 和
和 等,因含银量很高,是重要的银提取原料。从该副产物中提取银的工艺流程如下:
等,因含银量很高,是重要的银提取原料。从该副产物中提取银的工艺流程如下:
已知:①水合肼为
 ,有很强的还原性;
,有很强的还原性;②
 在碱性条件下易转化为
在碱性条件下易转化为 ;
;③常温下,
 的溶解度为
的溶解度为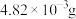 ,
, 的溶解度为0.79g。
的溶解度为0.79g。回答下列问题:
(1)
 的电子式为
的电子式为(2)脱氯渣的主要成分有
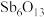 、
、 、
、 和
和(3)“还原脱氯”过程中会产生无色无味无毒气体,则
 发生反应的化学方程式为
发生反应的化学方程式为(4)“氧化分银”中,不直接用硝酸的原因是
(5)“氧化分银”中,银被氧化的离子方程式为
(6)“沉铅过滤”中主要析出
 的原因是
的原因是(7)“沉铅过滤”中硫酸的用量系数对铅和银的沉淀率影响如图所示。

硫酸的用量系数最佳选择是
您最近一年使用:0次
解题方法
7 . 二氧化氯消毒剂是国际上公认的高效消毒灭菌剂,回答下列问题:
I.制备ClO2
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
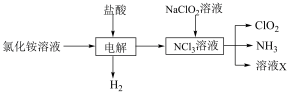
(1)NH4Cl的电子式为___________ 。
(2)若NaClO2与NCl3完全反应,则“溶液X”中的溶质为________ (填化学式)。
Ⅱ.NaClO2的应用
(3)NaClO2具有强氧化性,可将烟气中的NO氧化为NO ,在该反应过程中无有毒气体生成。其他条件相同时,以NaClO2溶液为吸收剂,测得相同时间内NO的氧化率随NaClO2的起始浓度的变化情况如图所示。
,在该反应过程中无有毒气体生成。其他条件相同时,以NaClO2溶液为吸收剂,测得相同时间内NO的氧化率随NaClO2的起始浓度的变化情况如图所示。
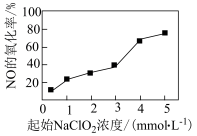
①NaClO2溶液在酸性条件下除去NO的离子方程式为___________ 。
②NO的氧化率随起始NaClO2浓度的增大而增大,原因是___________ 。
(4)ClO2具有较好的杀菌消毒作用。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克氯气的氧化能力。若ClO2的还原产物为Cl-,则ClO2的有效氯含量为___________ (保留2位小数)。
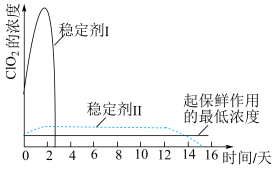
(5)ClO2能被多种稳定剂吸收,若将其用于果蔬保鲜,你认为下图中效果较好的稳定剂是___________ (填“稳定剂I”或“稳定剂Ⅱ”),原因是___________ 。
I.制备ClO2
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:

(1)NH4Cl的电子式为
(2)若NaClO2与NCl3完全反应,则“溶液X”中的溶质为
Ⅱ.NaClO2的应用
(3)NaClO2具有强氧化性,可将烟气中的NO氧化为NO
 ,在该反应过程中无有毒气体生成。其他条件相同时,以NaClO2溶液为吸收剂,测得相同时间内NO的氧化率随NaClO2的起始浓度的变化情况如图所示。
,在该反应过程中无有毒气体生成。其他条件相同时,以NaClO2溶液为吸收剂,测得相同时间内NO的氧化率随NaClO2的起始浓度的变化情况如图所示。
①NaClO2溶液在酸性条件下除去NO的离子方程式为
②NO的氧化率随起始NaClO2浓度的增大而增大,原因是
(4)ClO2具有较好的杀菌消毒作用。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克氯气的氧化能力。若ClO2的还原产物为Cl-,则ClO2的有效氯含量为
(5)ClO2能被多种稳定剂吸收,若将其用于果蔬保鲜,你认为下图中效果较好的稳定剂是

您最近一年使用:0次
解题方法
8 . 钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态K原子中,核外电子占据最高能层的符号是___________ 。占据该能层电子的电子云轮廓图形状为___________ 。
(2)元素K的焰色为___________ 色。单质K的密度比Na___________ (填“大”或“小”)。
(3)I的原子结构示意图为___________ 。
(4)X射线衍射测定发现,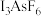 中存在
中存在 离子。
离子。 离子的空间结构为
离子的空间结构为___________ 。
(5) 晶体是一种性能良好的非线性光学材料,其晶胞结构如图所示,晶胞中K、I、O分别处于顶角、体心、面心位置,棱长为anm。K与O间的最短距离为
晶体是一种性能良好的非线性光学材料,其晶胞结构如图所示,晶胞中K、I、O分别处于顶角、体心、面心位置,棱长为anm。K与O间的最短距离为___________ nm,与K紧邻的O个数为___________ 。
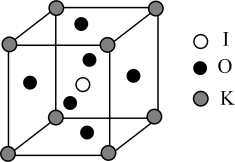
(6)在 晶胞结构的另一种表示中,I处于各顶角位置,则K处于
晶胞结构的另一种表示中,I处于各顶角位置,则K处于___________ 位置,O处于___________ 位置。
(1)基态K原子中,核外电子占据最高能层的符号是
(2)元素K的焰色为
(3)I的原子结构示意图为
(4)X射线衍射测定发现,
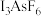 中存在
中存在 离子。
离子。 离子的空间结构为
离子的空间结构为(5)
 晶体是一种性能良好的非线性光学材料,其晶胞结构如图所示,晶胞中K、I、O分别处于顶角、体心、面心位置,棱长为anm。K与O间的最短距离为
晶体是一种性能良好的非线性光学材料,其晶胞结构如图所示,晶胞中K、I、O分别处于顶角、体心、面心位置,棱长为anm。K与O间的最短距离为
(6)在
 晶胞结构的另一种表示中,I处于各顶角位置,则K处于
晶胞结构的另一种表示中,I处于各顶角位置,则K处于
您最近一年使用:0次
解题方法
9 . 化学需氧量(COD)是指用强氧化剂将1L废水中的还原性物质氧化为二氧化碳和水所消耗的氧化剂的量,并换算成以 为氧化剂时所消耗
为氧化剂时所消耗 的质量。水体COD值常作为水体中有机污染物相对含量的综合指标之一、Fenton(
的质量。水体COD值常作为水体中有机污染物相对含量的综合指标之一、Fenton( )法能产生
)法能产生 和具有强氧化性的羟基自由基(·OH)引发一系列链式反应,被广泛应用于有机废水的治理。
和具有强氧化性的羟基自由基(·OH)引发一系列链式反应,被广泛应用于有机废水的治理。
(1)羟基自由基(·OH)的电子式为_______ 。
(2)分别取初始pH=4、COD=80的废水200mL,加入200mL ,改变起始投加
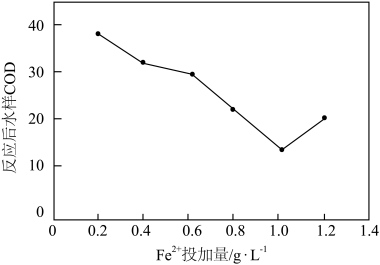
,改变起始投加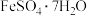 的量,反应相同时间。测得反应后水样COD随
的量,反应相同时间。测得反应后水样COD随 投加量的关系如图所示。当
投加量的关系如图所示。当 投加量超过1
投加量超过1 时,反应后水样COD不降反升的原因可能是
时,反应后水样COD不降反升的原因可能是_______ 。
(3)已知·OH更容易进攻有机物分子中电子云密度较大的基团。1-丁醇比正戊烷更容易受到·OH进攻的原因是_______ 。
(4)在Fenton法的基础上改进的基于硫酸根自由基(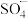 )的氧化技术引起关注。研究发现,一种
)的氧化技术引起关注。研究发现,一种 石墨烯纳米复合材料对催化活化
石墨烯纳米复合材料对催化活化 产生
产生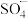 具有很好的效果。
具有很好的效果。 结构为
结构为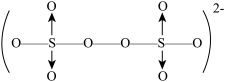 。
。
①与 试剂相比,
试剂相比, 一石墨烯/
一石墨烯/ 的使用范围更广。
的使用范围更广。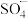 在强碱性条件下反应生成·OH,写出该反应的离子方程式:
在强碱性条件下反应生成·OH,写出该反应的离子方程式:_______ 。
②一种制取 一石墨烯纳米复合材料的物种转化关系可表示为(GO表示石墨烯)
一石墨烯纳米复合材料的物种转化关系可表示为(GO表示石墨烯)
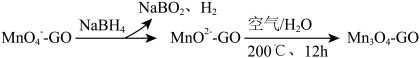
在石墨烯表面制得1mol ,理论上需要消耗
,理论上需要消耗 的物质的量为
的物质的量为_______ mol。
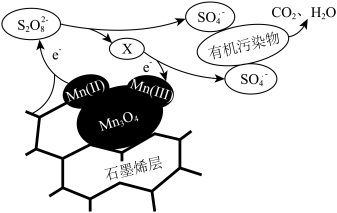
③利用该复合材料催化活化 并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为
并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为_______ 。
 为氧化剂时所消耗
为氧化剂时所消耗 的质量。水体COD值常作为水体中有机污染物相对含量的综合指标之一、Fenton(
的质量。水体COD值常作为水体中有机污染物相对含量的综合指标之一、Fenton( )法能产生
)法能产生 和具有强氧化性的羟基自由基(·OH)引发一系列链式反应,被广泛应用于有机废水的治理。
和具有强氧化性的羟基自由基(·OH)引发一系列链式反应,被广泛应用于有机废水的治理。(1)羟基自由基(·OH)的电子式为
(2)分别取初始pH=4、COD=80的废水200mL,加入200mL
 ,改变起始投加
,改变起始投加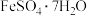 的量,反应相同时间。测得反应后水样COD随
的量,反应相同时间。测得反应后水样COD随 投加量的关系如图所示。当
投加量的关系如图所示。当 投加量超过1
投加量超过1 时,反应后水样COD不降反升的原因可能是
时,反应后水样COD不降反升的原因可能是
(3)已知·OH更容易进攻有机物分子中电子云密度较大的基团。1-丁醇比正戊烷更容易受到·OH进攻的原因是
(4)在Fenton法的基础上改进的基于硫酸根自由基(
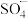 )的氧化技术引起关注。研究发现,一种
)的氧化技术引起关注。研究发现,一种 石墨烯纳米复合材料对催化活化
石墨烯纳米复合材料对催化活化 产生
产生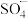 具有很好的效果。
具有很好的效果。 结构为
结构为 。
。①与
 试剂相比,
试剂相比, 一石墨烯/
一石墨烯/ 的使用范围更广。
的使用范围更广。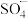 在强碱性条件下反应生成·OH,写出该反应的离子方程式:
在强碱性条件下反应生成·OH,写出该反应的离子方程式:②一种制取
 一石墨烯纳米复合材料的物种转化关系可表示为(GO表示石墨烯)
一石墨烯纳米复合材料的物种转化关系可表示为(GO表示石墨烯)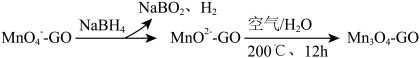
在石墨烯表面制得1mol
 ,理论上需要消耗
,理论上需要消耗 的物质的量为
的物质的量为③利用该复合材料催化活化
 并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为
并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为
您最近一年使用:0次
解题方法
10 . 化合物( )可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21,
)可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21, 分子的总电子数为奇数,常温下为酸雨成因的一种气体。该化合物的热重曲线如图所示,在
分子的总电子数为奇数,常温下为酸雨成因的一种气体。该化合物的热重曲线如图所示,在 以下热分解时无刺激性气体逸出。
以下热分解时无刺激性气体逸出。
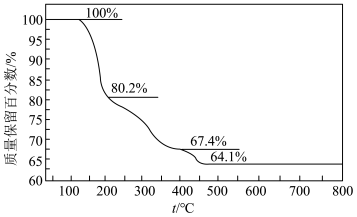
回答下列问题(使用相应的元素符号或化学式 ):
(1)元素Q比W元素核内质子数多18,基态Q原子中核外电子占据最高能层符号为_______ ,该能层最多能容纳_______ 个电子。
(2)W与Y形成的一种 分子,用电子式表示该物质的形成过程:
分子,用电子式表示该物质的形成过程:_______ ,该分子与 混合时能发生反应,生成两种环境友好的分子,因而成为火箭推进剂的原料,写出该反应化学方程式:
混合时能发生反应,生成两种环境友好的分子,因而成为火箭推进剂的原料,写出该反应化学方程式:_______ 。
(3)化合物 ( )中存在的主要化学键有
)中存在的主要化学键有_______ 。
a.氢键 b.极性共价键 c.范德华力 d.离子键
(4)X与Y的最高价氧化物的水化物酸性:_______>_______(填化学式)。______
(5)下列说法正确的是_______(填字母)。
(6)用化学方程式表示该化合物热分解的总反应_______ 。
 )可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21,
)可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21, 分子的总电子数为奇数,常温下为酸雨成因的一种气体。该化合物的热重曲线如图所示,在
分子的总电子数为奇数,常温下为酸雨成因的一种气体。该化合物的热重曲线如图所示,在 以下热分解时无刺激性气体逸出。
以下热分解时无刺激性气体逸出。
回答下列问题(使用相应的
(1)元素Q比W元素核内质子数多18,基态Q原子中核外电子占据最高能层符号为
(2)W与Y形成的一种
 分子,用电子式表示该物质的形成过程:
分子,用电子式表示该物质的形成过程: 混合时能发生反应,生成两种环境友好的分子,因而成为火箭推进剂的原料,写出该反应化学方程式:
混合时能发生反应,生成两种环境友好的分子,因而成为火箭推进剂的原料,写出该反应化学方程式:(3)化合物 (
 )中存在的主要化学键有
)中存在的主要化学键有a.氢键 b.极性共价键 c.范德华力 d.离子键
(4)X与Y的最高价氧化物的水化物酸性:_______>_______(填化学式)。
(5)下列说法正确的是_______(填字母)。
A.盛满 的试管倒扣在水槽中,水可充满试管且得到某一元强酸溶液 的试管倒扣在水槽中,水可充满试管且得到某一元强酸溶液 |
| B.YZ可用向上排空气法收集 |
| C.W、X、Y、Z的单质常温下均为固体 |
D. 阶段热分解只失去部分结晶水 阶段热分解只失去部分结晶水 |
您最近一年使用:0次



