名校
解题方法
1 . 土壤中的硝酸盐会被细菌分解。有一种脱氧硫杆菌能够利用土壤中的硫化物来分解硝酸盐,其主要化学原理如下:
 (条件略)
(条件略)
1.写出 的电子式
的电子式___________ 。
2.能证明 是离子化合物的事实是___________。
是离子化合物的事实是___________。
3.下列说法正确的是___________。
4.下列说法中正确的是___________。
 (条件略)
(条件略)1.写出
 的电子式
的电子式2.能证明
 是离子化合物的事实是___________。
是离子化合物的事实是___________。| A.常温下是固体 | B.易溶于水 | C.水溶液能导电 | D.熔融态能导电 |
A. 和 和 溶于水时都会破坏离子键 溶于水时都会破坏离子键 |
B. 能电离出 能电离出 和 和 ,所以 ,所以 是离子化合物 是离子化合物 |
C. 中每个原子的最外层都具有8电子的稳定结构 中每个原子的最外层都具有8电子的稳定结构 |
D. 是共价分子,液氮汽化时破坏共价键和分子间作用力 是共价分子,液氮汽化时破坏共价键和分子间作用力 |
| A.离子化合物中一定只有离子键 | B.共价化合物中一定只有共价键 |
| C.氯化氢溶于水时会破坏离子键 | D.蔗糖溶于水时破坏分子间作用力 |
您最近半年使用:0次
解题方法
2 . 乙炔是最简单的炔烃,常用氧炔焰来焊接或切割金属。下列有关其化学用语表达错误的是
A.电子式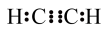 |
B.球棍模型 |
C.C原子杂化轨道电子云轮廓图 |
D.基态C原子价层电子排布图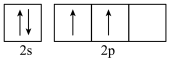 |
您最近半年使用:0次
名校
解题方法
3 . 下列有关化学用语的使用正确的是
A. 的电子式: 的电子式: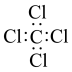 |
B.钠离子结构示意图 |
C.M²⁻核外有a个电子,b个中子,M的原子符号为 |
D.高氯酸的电离方程式 |
您最近半年使用:0次
解题方法
4 . 氯化钠是日常生活必需品和重要的化工原料。
(1)NaCl固体是否属于电解质?______ ,是否能导电?______ (填写“是”或“否”)。
(2)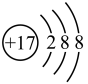 表示
表示______ 。
A.氯原子的结构示意图
B.氯离子的结构示意图
(3)实验室提纯粗盐时,将粗盐溶于水后,先除去泥沙等难溶性杂质,再除去Ca2+、Mg2+、SO 等可溶性杂质。
等可溶性杂质。
①写出NaCl溶于水时的电离方程式______ 。
②为了除去可溶性杂质,依次加入稍过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,加热至70℃左右约2min,冷却后过滤,得到的沉淀有BaSO4、Mg(OH)2、CaCO3和______ 。
(4)“84消毒液”是常见的消毒剂,其有效成分是NaClO。
①Cl2和NaOH制备NaClO的离子方程式为_______ 。
如图是某品牌“84消毒液”的使用注意事项。
②注意事项4“易使有色衣物脱色”,是因为“84消毒液”具有______ 。
A.碱性 B.强氧化性
③注意事项6“不可与酸性物质同时使用”,例如,若将“84消毒液”与“洁厕灵”(含盐酸)同时使用会生成黄绿色有毒气体。写出反应的离子方程式_______ 。
(1)NaCl固体是否属于电解质?
(2)
 表示
表示A.氯原子的结构示意图
B.氯离子的结构示意图
(3)实验室提纯粗盐时,将粗盐溶于水后,先除去泥沙等难溶性杂质,再除去Ca2+、Mg2+、SO
 等可溶性杂质。
等可溶性杂质。①写出NaCl溶于水时的电离方程式
②为了除去可溶性杂质,依次加入稍过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,加热至70℃左右约2min,冷却后过滤,得到的沉淀有BaSO4、Mg(OH)2、CaCO3和
(4)“84消毒液”是常见的消毒剂,其有效成分是NaClO。
①Cl2和NaOH制备NaClO的离子方程式为
如图是某品牌“84消毒液”的使用注意事项。
| 注意事项 1、外用消毒液,勿口服; 2、现用现配,使用时注意戴手套防护; 3、不适用于钢和铝制品的消毒; 4、易使有色衣物脱色; 5、避光、阴凉处保存; 6、不可与酸性物质同时使用. |
A.碱性 B.强氧化性
③注意事项6“不可与酸性物质同时使用”,例如,若将“84消毒液”与“洁厕灵”(含盐酸)同时使用会生成黄绿色有毒气体。写出反应的离子方程式
您最近半年使用:0次
解题方法
5 .  广泛用于冶金、化工行业,可制取多种含钒化合物。
广泛用于冶金、化工行业,可制取多种含钒化合物。
(1)实验室制备氧钒(Ⅳ)碱式碳酸铵晶体,过程如下: ,反应的化学方程式为
,反应的化学方程式为___________ ;若不加 ,HCl也能还原
,HCl也能还原 生成
生成 和
和 ,分析反应中不生成
,分析反应中不生成 的原因
的原因___________ 。
(2)对制得的晶体进行含钒量的测定:称取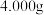 样品,经过系列处理后将钒(Ⅳ)完全氧化,定容为
样品,经过系列处理后将钒(Ⅳ)完全氧化,定容为 溶液;量取
溶液;量取 溶液,加入指示剂,用
溶液,加入指示剂,用 的
的 标准溶液滴定至终点,滴定过程中反应为
标准溶液滴定至终点,滴定过程中反应为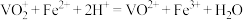 ;平行滴定4次,消耗标准溶液的体积分别为
;平行滴定4次,消耗标准溶液的体积分别为 ,则样品中钒元素的质量分数为
,则样品中钒元素的质量分数为___________ (写出计算过程,结果保留两位小数)。
(3) 时,将氧钒碱式碳酸铵晶体与
时,将氧钒碱式碳酸铵晶体与 反应制备共价晶体
反应制备共价晶体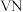 ,一段时间后,固体质量不再变化,经检测仍有氧钒碱式碳酸铵剩余,可能的原因是
,一段时间后,固体质量不再变化,经检测仍有氧钒碱式碳酸铵剩余,可能的原因是___________ 。
(4) 可溶于强酸强碱,不同
可溶于强酸强碱,不同 、不同钒元素浓度时,
、不同钒元素浓度时,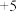 价
价 存在形态如题图所示:
存在形态如题图所示: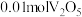 溶解在
溶解在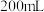 烧碱溶液中,剩余溶液的
烧碱溶液中,剩余溶液的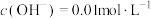 ,反应的离子方程式为
,反应的离子方程式为___________ 。
②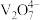 具有对称结构,其结构式可表示为
具有对称结构,其结构式可表示为___________ 。
 广泛用于冶金、化工行业,可制取多种含钒化合物。
广泛用于冶金、化工行业,可制取多种含钒化合物。(1)实验室制备氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:
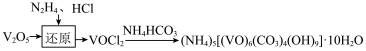
 ,反应的化学方程式为
,反应的化学方程式为 ,HCl也能还原
,HCl也能还原 生成
生成 和
和 ,分析反应中不生成
,分析反应中不生成 的原因
的原因(2)对制得的晶体进行含钒量的测定:称取
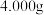 样品,经过系列处理后将钒(Ⅳ)完全氧化,定容为
样品,经过系列处理后将钒(Ⅳ)完全氧化,定容为 溶液;量取
溶液;量取 溶液,加入指示剂,用
溶液,加入指示剂,用 的
的 标准溶液滴定至终点,滴定过程中反应为
标准溶液滴定至终点,滴定过程中反应为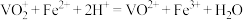 ;平行滴定4次,消耗标准溶液的体积分别为
;平行滴定4次,消耗标准溶液的体积分别为 ,则样品中钒元素的质量分数为
,则样品中钒元素的质量分数为(3)
 时,将氧钒碱式碳酸铵晶体与
时,将氧钒碱式碳酸铵晶体与 反应制备共价晶体
反应制备共价晶体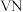 ,一段时间后,固体质量不再变化,经检测仍有氧钒碱式碳酸铵剩余,可能的原因是
,一段时间后,固体质量不再变化,经检测仍有氧钒碱式碳酸铵剩余,可能的原因是(4)
 可溶于强酸强碱,不同
可溶于强酸强碱,不同 、不同钒元素浓度时,
、不同钒元素浓度时,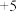 价
价 存在形态如题图所示:
存在形态如题图所示:
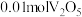 溶解在
溶解在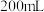 烧碱溶液中,剩余溶液的
烧碱溶液中,剩余溶液的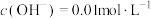 ,反应的离子方程式为
,反应的离子方程式为②
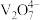 具有对称结构,其结构式可表示为
具有对称结构,其结构式可表示为
您最近半年使用:0次
名校
解题方法
6 . 以焙烧黄铁矿FeS2(杂质为石英等)产生的红渣为原料生产制备铵铁蓝Fe(NH4)[Fe(CN)6]颜料的工艺流程如图:_______ (填化学式),滤渣①的主要成分是_______ (填化学式)。
(2)黄铁矿研细的目的是_______ 。
(3)工序①经过_______ 、过滤、洗涤得到一种含7个结晶水的晶体,该晶体为_______ (填化学式)。
(4)沉铁工序中生成一种白色沉淀为Fe(NH4)2[Fe(CN)6]。
①该物质的阴离子是由Fe2+和CN-结合形成的,CN-的电子式与氮气的电子式相似,请写出CN-的电子式:_______ 。
②该物质在酸性条件下加入NaClO3溶液,充分反应得到铵铁蓝,试补全下列离子方程式:_______ 。6Fe(NH4)2[Fe(CN)6]+ClO +_______=6FeNH4[Fe(CN)6]+ _______+_______NH
+_______=6FeNH4[Fe(CN)6]+ _______+_______NH +3H2O。
+3H2O。
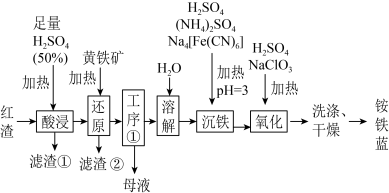
(2)黄铁矿研细的目的是
(3)工序①经过
(4)沉铁工序中生成一种白色沉淀为Fe(NH4)2[Fe(CN)6]。
①该物质的阴离子是由Fe2+和CN-结合形成的,CN-的电子式与氮气的电子式相似,请写出CN-的电子式:
②该物质在酸性条件下加入NaClO3溶液,充分反应得到铵铁蓝,试补全下列离子方程式:
 +_______=6FeNH4[Fe(CN)6]+ _______+_______NH
+_______=6FeNH4[Fe(CN)6]+ _______+_______NH +3H2O。
+3H2O。
您最近半年使用:0次
2024-03-01更新
|
84次组卷
|
2卷引用:山西省运城市康杰中学2023-2024学年高一下学期化学试题
名校
解题方法
7 . 学习化学一定要领悟好问题情景。
(1)①书写以下各微粒的电子式。
—OH___________ ,HBrO___________ ,CS2___________ ,NH4H___________ ;
②用电子式表示Na和S形成Na2S的过程___________ 。
(2)氮元素的化合物种类繁多,性质也各不相同。请回答下列问题:
已知:①N2(g)+O2(g)=2NO(g)ΔH=+180.5kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1
③N2(g)+3H2(g)=2NH3(g)ΔH=-92.4kJ·mol-1
则反应:④4NH3(g)+5O2(g)=4NO(g)+6H2O(g)的ΔH=___________ kJ·mol-1。
(3)电负性与原子所处的具体的化学环境紧密相关。有机化合物CH3I和CF3I发生水解时的主要反应分别是:CH3I+H2O→CH3OH+HI和CF₃I+H₂O→CF3H+HIO。从电负性的角度分析,为什么CF3I水解的产物不是HI的原因___________ 。
(4)工业上用Na2SO3吸收尾气中SO2使之转化为NaHSO3,再以SO2为原料设计原电池,然后电解(惰性电极)NaHSO3制取H2SO4,装置如下:
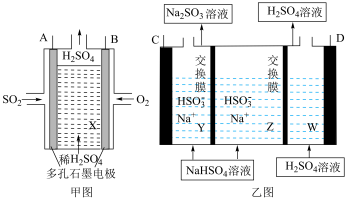
①甲图中A电极上的反应式为___________ 。
②甲图中B与乙图___________ (填“C”或“D”)极相连,进行电解时乙图Z中Na+向___________ (填“Y”或“W”)中移动。
③该电解池阴极的电极反应式为___________ ;
(5)Ni可活化C2H6放出CH4,其反应历程如下图所示:

下列关于活化历程的说法错误的是
(1)①书写以下各微粒的电子式。
—OH
②用电子式表示Na和S形成Na2S的过程
(2)氮元素的化合物种类繁多,性质也各不相同。请回答下列问题:
已知:①N2(g)+O2(g)=2NO(g)ΔH=+180.5kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1
③N2(g)+3H2(g)=2NH3(g)ΔH=-92.4kJ·mol-1
则反应:④4NH3(g)+5O2(g)=4NO(g)+6H2O(g)的ΔH=
(3)电负性与原子所处的具体的化学环境紧密相关。有机化合物CH3I和CF3I发生水解时的主要反应分别是:CH3I+H2O→CH3OH+HI和CF₃I+H₂O→CF3H+HIO。从电负性的角度分析,为什么CF3I水解的产物不是HI的原因
(4)工业上用Na2SO3吸收尾气中SO2使之转化为NaHSO3,再以SO2为原料设计原电池,然后电解(惰性电极)NaHSO3制取H2SO4,装置如下:

①甲图中A电极上的反应式为
②甲图中B与乙图
③该电解池阴极的电极反应式为
(5)Ni可活化C2H6放出CH4,其反应历程如下图所示:

下列关于活化历程的说法错误的是
| A.活化能最大的步骤:中间体2→中间体3 |
| B.只涉及极性键的断裂和生成 |
| C.在此反应过程中Ni的成键数目发生变化 |
D.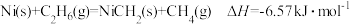 |
您最近半年使用:0次
名校
8 . 纳米银粒是一种杀菌剂,对沙眼衣原体等数十种致病微生物都有强烈的抑制和杀灭作用,而且不会产生耐药性。可通过肼(N2H4)还原银氨溶液制备纳米颗粒。具体步骤如下:
Ⅰ.在洁净的试管中加入2%AgNO3溶液10mL,逐滴加入2%稀氨水,边滴边振荡至沉淀恰好完全溶解。
Ⅱ.取10mLN2H4溶液于大烧杯中并加入5g分散剂混合均匀,加热至55~60℃。
Ⅲ.将Ⅰ中所得溶液滴加到Ⅱ中所得的分散系中,反应15min。
Ⅳ.冷却、分离、洗涤、干燥得纳米银粉。
已知:AgOH是白色难溶于水的物质,常温下极不稳定,分解生成棕色微溶于水的Ag2O。
回答下列问题:
(1)N2H4是一种常用还原剂,写出N2H4的电子式:___________ 。
(2)步骤Ⅲ发生反应的离子方程式为___________ ;验证纳米银颗粒生成的方法是___________ 。
(3)下列有关说法错误的是___________(填字母)。
(4)步骤I使用的AgNO3溶液需用HNO3酸化,其主要目的是___________ 。
(5)若用AgNO3溶液与维生素C以及明胶在一定条件下也可制得纳米银颗粒。
①该体系中维生素C的作用为___________ 。
②已知明胶可与溶液中Ag+形成如下配合物,[Ag(明胶)]+得电子后,明胶继续吸附在银核表面。
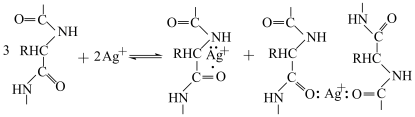
明胶在该体系中充当___________ 。
Ⅰ.在洁净的试管中加入2%AgNO3溶液10mL,逐滴加入2%稀氨水,边滴边振荡至沉淀恰好完全溶解。
Ⅱ.取10mLN2H4溶液于大烧杯中并加入5g分散剂混合均匀,加热至55~60℃。
Ⅲ.将Ⅰ中所得溶液滴加到Ⅱ中所得的分散系中,反应15min。
Ⅳ.冷却、分离、洗涤、干燥得纳米银粉。
已知:AgOH是白色难溶于水的物质,常温下极不稳定,分解生成棕色微溶于水的Ag2O。
回答下列问题:
(1)N2H4是一种常用还原剂,写出N2H4的电子式:
(2)步骤Ⅲ发生反应的离子方程式为
(3)下列有关说法错误的是___________(填字母)。
| A.步骤Ⅰ,银氨溶液也可用AgCl与氨水反应制得 |
| B.步骤Ⅱ,可采用水浴加热 |
| C.步骤Ⅲ,为了加快反应速度,可以一次性加入银氨溶液 |
| D.步骤Ⅳ,洗涤时可先水洗,再用乙醇洗涤 |
(4)步骤I使用的AgNO3溶液需用HNO3酸化,其主要目的是
(5)若用AgNO3溶液与维生素C以及明胶在一定条件下也可制得纳米银颗粒。
①该体系中维生素C的作用为
②已知明胶可与溶液中Ag+形成如下配合物,[Ag(明胶)]+得电子后,明胶继续吸附在银核表面。

明胶在该体系中充当
您最近半年使用:0次
名校
9 . 含氮化合物的处理对环境保护意义重大。研究氮及其化合物的性质,可以有效改善人类的生存环境。
(1)N原子的电子式为___________ 。
(2)用 或CO催化还原NO均能消除污染,反应的氧化产物为
或CO催化还原NO均能消除污染,反应的氧化产物为______ 。
(3)实验室常用NaOH溶液吸收 (NO和
(NO和 的混合气体),反应的化学方程式如下:
的混合气体),反应的化学方程式如下:
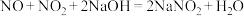 ;
;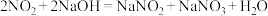 (已知NO不能与NaOH溶液反应,不考虑
(已知NO不能与NaOH溶液反应,不考虑 与
与 的转化)。
的转化)。
①若 能被NaOH溶液完全吸收,则x的取值范围为
能被NaOH溶液完全吸收,则x的取值范围为______ 。
②若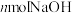 恰好完全反应,则被吸收的
恰好完全反应,则被吸收的 的体积为
的体积为______ L(标准状况)。
③将这两个反应中的产物进行分类,分类方法错误的是______ 。
A.强电解质和弱电解质 B.盐和氧化物
C.离子化合物和共价化合物 D.氧化产物和还原产物
(4)将32.64g铜与200mL一定浓度的硝酸反应,铜完全溶解,产生的NO和 混合气体在标准状况下的体积为11.2L。请回答:
混合气体在标准状况下的体积为11.2L。请回答:
①NO的物质的量为___________ mol, 的体积为
的体积为___________ L(标准状况)。
②待产生的气体全部释放后,向溶液中加入 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为___________  。
。
(1)N原子的电子式为
(2)用
 或CO催化还原NO均能消除污染,反应的氧化产物为
或CO催化还原NO均能消除污染,反应的氧化产物为(3)实验室常用NaOH溶液吸收
 (NO和
(NO和 的混合气体),反应的化学方程式如下:
的混合气体),反应的化学方程式如下: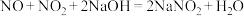 ;
;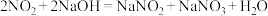 (已知NO不能与NaOH溶液反应,不考虑
(已知NO不能与NaOH溶液反应,不考虑 与
与 的转化)。
的转化)。①若
 能被NaOH溶液完全吸收,则x的取值范围为
能被NaOH溶液完全吸收,则x的取值范围为②若
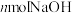 恰好完全反应,则被吸收的
恰好完全反应,则被吸收的 的体积为
的体积为③将这两个反应中的产物进行分类,分类方法错误的是
A.强电解质和弱电解质 B.盐和氧化物
C.离子化合物和共价化合物 D.氧化产物和还原产物
(4)将32.64g铜与200mL一定浓度的硝酸反应,铜完全溶解,产生的NO和
 混合气体在标准状况下的体积为11.2L。请回答:
混合气体在标准状况下的体积为11.2L。请回答:①NO的物质的量为
 的体积为
的体积为②待产生的气体全部释放后,向溶液中加入
 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为 。
。
您最近半年使用:0次
名校
解题方法
10 . 原子是化学反应中不可再分的基本微粒,自古以来人们对于原子的研究从未停止过。了解了原子的结构,能够帮助人们更好地从微观角度认识物质并推断它们的性质。
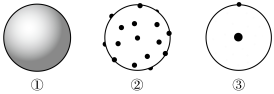
(1)下列图①②③原子结构模型中依次符合卢瑟福、道尔顿、汤姆孙的观点的是___________。
(2)一种元素有质量数分别为35,37的两种核素,该元素的近似相对原子质量为35.5,则两种核素的丰度之比为___________ 。
(3)下列微粒中,具有相同的电子层数与最外层电子数的是___________。
(1)下列图①②③原子结构模型中依次符合卢瑟福、道尔顿、汤姆孙的观点的是___________。

| A.①②③ | B.③①② | C.③②① | D.②①③ |
(2)一种元素有质量数分别为35,37的两种核素,该元素的近似相对原子质量为35.5,则两种核素的丰度之比为
(3)下列微粒中,具有相同的电子层数与最外层电子数的是___________。
| A.He与Li | B. 与 与 | C. 与 与 | D. 与Ar 与Ar |
您最近半年使用:0次



