解题方法
1 . 氯化钠是日常生活必需品和重要的化工原料。
(1)NaCl固体是否属于电解质?______ ,是否能导电?______ (填写“是”或“否”)。
(2)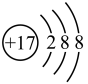 表示
表示______ 。
A.氯原子的结构示意图
B.氯离子的结构示意图
(3)实验室提纯粗盐时,将粗盐溶于水后,先除去泥沙等难溶性杂质,再除去Ca2+、Mg2+、SO 等可溶性杂质。
等可溶性杂质。
①写出NaCl溶于水时的电离方程式______ 。
②为了除去可溶性杂质,依次加入稍过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,加热至70℃左右约2min,冷却后过滤,得到的沉淀有BaSO4、Mg(OH)2、CaCO3和______ 。
(4)“84消毒液”是常见的消毒剂,其有效成分是NaClO。
①Cl2和NaOH制备NaClO的离子方程式为_______ 。
如图是某品牌“84消毒液”的使用注意事项。
②注意事项4“易使有色衣物脱色”,是因为“84消毒液”具有______ 。
A.碱性 B.强氧化性
③注意事项6“不可与酸性物质同时使用”,例如,若将“84消毒液”与“洁厕灵”(含盐酸)同时使用会生成黄绿色有毒气体。写出反应的离子方程式_______ 。
(1)NaCl固体是否属于电解质?
(2)
 表示
表示A.氯原子的结构示意图
B.氯离子的结构示意图
(3)实验室提纯粗盐时,将粗盐溶于水后,先除去泥沙等难溶性杂质,再除去Ca2+、Mg2+、SO
 等可溶性杂质。
等可溶性杂质。①写出NaCl溶于水时的电离方程式
②为了除去可溶性杂质,依次加入稍过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,加热至70℃左右约2min,冷却后过滤,得到的沉淀有BaSO4、Mg(OH)2、CaCO3和
(4)“84消毒液”是常见的消毒剂,其有效成分是NaClO。
①Cl2和NaOH制备NaClO的离子方程式为
如图是某品牌“84消毒液”的使用注意事项。
| 注意事项 1、外用消毒液,勿口服; 2、现用现配,使用时注意戴手套防护; 3、不适用于钢和铝制品的消毒; 4、易使有色衣物脱色; 5、避光、阴凉处保存; 6、不可与酸性物质同时使用. |
A.碱性 B.强氧化性
③注意事项6“不可与酸性物质同时使用”,例如,若将“84消毒液”与“洁厕灵”(含盐酸)同时使用会生成黄绿色有毒气体。写出反应的离子方程式
您最近一年使用:0次
名校
解题方法
2 . 学习化学一定要领悟好问题情景。
(1)①书写以下各微粒的电子式。
—OH___________ ,HBrO___________ ,CS2___________ ,NH4H___________ ;
②用电子式表示Na和S形成Na2S的过程___________ 。
(2)氮元素的化合物种类繁多,性质也各不相同。请回答下列问题:
已知:①N2(g)+O2(g)=2NO(g)ΔH=+180.5kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1
③N2(g)+3H2(g)=2NH3(g)ΔH=-92.4kJ·mol-1
则反应:④4NH3(g)+5O2(g)=4NO(g)+6H2O(g)的ΔH=___________ kJ·mol-1。
(3)电负性与原子所处的具体的化学环境紧密相关。有机化合物CH3I和CF3I发生水解时的主要反应分别是:CH3I+H2O→CH3OH+HI和CF₃I+H₂O→CF3H+HIO。从电负性的角度分析,为什么CF3I水解的产物不是HI的原因___________ 。
(4)工业上用Na2SO3吸收尾气中SO2使之转化为NaHSO3,再以SO2为原料设计原电池,然后电解(惰性电极)NaHSO3制取H2SO4,装置如下:
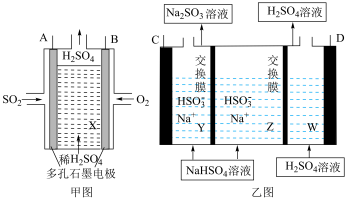
①甲图中A电极上的反应式为___________ 。
②甲图中B与乙图___________ (填“C”或“D”)极相连,进行电解时乙图Z中Na+向___________ (填“Y”或“W”)中移动。
③该电解池阴极的电极反应式为___________ ;
(5)Ni可活化C2H6放出CH4,其反应历程如下图所示:

下列关于活化历程的说法错误的是
(1)①书写以下各微粒的电子式。
—OH
②用电子式表示Na和S形成Na2S的过程
(2)氮元素的化合物种类繁多,性质也各不相同。请回答下列问题:
已知:①N2(g)+O2(g)=2NO(g)ΔH=+180.5kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1
③N2(g)+3H2(g)=2NH3(g)ΔH=-92.4kJ·mol-1
则反应:④4NH3(g)+5O2(g)=4NO(g)+6H2O(g)的ΔH=
(3)电负性与原子所处的具体的化学环境紧密相关。有机化合物CH3I和CF3I发生水解时的主要反应分别是:CH3I+H2O→CH3OH+HI和CF₃I+H₂O→CF3H+HIO。从电负性的角度分析,为什么CF3I水解的产物不是HI的原因
(4)工业上用Na2SO3吸收尾气中SO2使之转化为NaHSO3,再以SO2为原料设计原电池,然后电解(惰性电极)NaHSO3制取H2SO4,装置如下:

①甲图中A电极上的反应式为
②甲图中B与乙图
③该电解池阴极的电极反应式为
(5)Ni可活化C2H6放出CH4,其反应历程如下图所示:

下列关于活化历程的说法错误的是
| A.活化能最大的步骤:中间体2→中间体3 |
| B.只涉及极性键的断裂和生成 |
| C.在此反应过程中Ni的成键数目发生变化 |
D.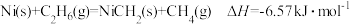 |
您最近一年使用:0次
名校
3 . 纳米银粒是一种杀菌剂,对沙眼衣原体等数十种致病微生物都有强烈的抑制和杀灭作用,而且不会产生耐药性。可通过肼(N2H4)还原银氨溶液制备纳米颗粒。具体步骤如下:
Ⅰ.在洁净的试管中加入2%AgNO3溶液10mL,逐滴加入2%稀氨水,边滴边振荡至沉淀恰好完全溶解。
Ⅱ.取10mLN2H4溶液于大烧杯中并加入5g分散剂混合均匀,加热至55~60℃。
Ⅲ.将Ⅰ中所得溶液滴加到Ⅱ中所得的分散系中,反应15min。
Ⅳ.冷却、分离、洗涤、干燥得纳米银粉。
已知:AgOH是白色难溶于水的物质,常温下极不稳定,分解生成棕色微溶于水的Ag2O。
回答下列问题:
(1)N2H4是一种常用还原剂,写出N2H4的电子式:___________ 。
(2)步骤Ⅲ发生反应的离子方程式为___________ ;验证纳米银颗粒生成的方法是___________ 。
(3)下列有关说法错误的是___________(填字母)。
(4)步骤I使用的AgNO3溶液需用HNO3酸化,其主要目的是___________ 。
(5)若用AgNO3溶液与维生素C以及明胶在一定条件下也可制得纳米银颗粒。
①该体系中维生素C的作用为___________ 。
②已知明胶可与溶液中Ag+形成如下配合物,[Ag(明胶)]+得电子后,明胶继续吸附在银核表面。
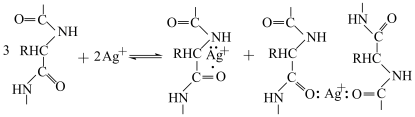
明胶在该体系中充当___________ 。
Ⅰ.在洁净的试管中加入2%AgNO3溶液10mL,逐滴加入2%稀氨水,边滴边振荡至沉淀恰好完全溶解。
Ⅱ.取10mLN2H4溶液于大烧杯中并加入5g分散剂混合均匀,加热至55~60℃。
Ⅲ.将Ⅰ中所得溶液滴加到Ⅱ中所得的分散系中,反应15min。
Ⅳ.冷却、分离、洗涤、干燥得纳米银粉。
已知:AgOH是白色难溶于水的物质,常温下极不稳定,分解生成棕色微溶于水的Ag2O。
回答下列问题:
(1)N2H4是一种常用还原剂,写出N2H4的电子式:
(2)步骤Ⅲ发生反应的离子方程式为
(3)下列有关说法错误的是___________(填字母)。
| A.步骤Ⅰ,银氨溶液也可用AgCl与氨水反应制得 |
| B.步骤Ⅱ,可采用水浴加热 |
| C.步骤Ⅲ,为了加快反应速度,可以一次性加入银氨溶液 |
| D.步骤Ⅳ,洗涤时可先水洗,再用乙醇洗涤 |
(4)步骤I使用的AgNO3溶液需用HNO3酸化,其主要目的是
(5)若用AgNO3溶液与维生素C以及明胶在一定条件下也可制得纳米银颗粒。
①该体系中维生素C的作用为
②已知明胶可与溶液中Ag+形成如下配合物,[Ag(明胶)]+得电子后,明胶继续吸附在银核表面。

明胶在该体系中充当
您最近一年使用:0次
名校
4 . 含氮化合物的处理对环境保护意义重大。研究氮及其化合物的性质,可以有效改善人类的生存环境。
(1)N原子的电子式为___________ 。
(2)用 或CO催化还原NO均能消除污染,反应的氧化产物为
或CO催化还原NO均能消除污染,反应的氧化产物为______ 。
(3)实验室常用NaOH溶液吸收 (NO和
(NO和 的混合气体),反应的化学方程式如下:
的混合气体),反应的化学方程式如下:
 ;
; (已知NO不能与NaOH溶液反应,不考虑
(已知NO不能与NaOH溶液反应,不考虑 与
与 的转化)。
的转化)。
①若 能被NaOH溶液完全吸收,则x的取值范围为
能被NaOH溶液完全吸收,则x的取值范围为______ 。
②若 恰好完全反应,则被吸收的
恰好完全反应,则被吸收的 的体积为
的体积为______ L(标准状况)。
③将这两个反应中的产物进行分类,分类方法错误的是______ 。
A.强电解质和弱电解质 B.盐和氧化物
C.离子化合物和共价化合物 D.氧化产物和还原产物
(4)将32.64g铜与200mL一定浓度的硝酸反应,铜完全溶解,产生的NO和 混合气体在标准状况下的体积为11.2L。请回答:
混合气体在标准状况下的体积为11.2L。请回答:
①NO的物质的量为___________ mol, 的体积为
的体积为___________ L(标准状况)。
②待产生的气体全部释放后,向溶液中加入 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为___________  。
。
(1)N原子的电子式为
(2)用
 或CO催化还原NO均能消除污染,反应的氧化产物为
或CO催化还原NO均能消除污染,反应的氧化产物为(3)实验室常用NaOH溶液吸收
 (NO和
(NO和 的混合气体),反应的化学方程式如下:
的混合气体),反应的化学方程式如下: ;
; (已知NO不能与NaOH溶液反应,不考虑
(已知NO不能与NaOH溶液反应,不考虑 与
与 的转化)。
的转化)。①若
 能被NaOH溶液完全吸收,则x的取值范围为
能被NaOH溶液完全吸收,则x的取值范围为②若
 恰好完全反应,则被吸收的
恰好完全反应,则被吸收的 的体积为
的体积为③将这两个反应中的产物进行分类,分类方法错误的是
A.强电解质和弱电解质 B.盐和氧化物
C.离子化合物和共价化合物 D.氧化产物和还原产物
(4)将32.64g铜与200mL一定浓度的硝酸反应,铜完全溶解,产生的NO和
 混合气体在标准状况下的体积为11.2L。请回答:
混合气体在标准状况下的体积为11.2L。请回答:①NO的物质的量为
 的体积为
的体积为②待产生的气体全部释放后,向溶液中加入
 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为 。
。
您最近一年使用:0次
名校
解题方法
5 . 原子是化学反应中不可再分的基本微粒,自古以来人们对于原子的研究从未停止过。了解了原子的结构,能够帮助人们更好地从微观角度认识物质并推断它们的性质。
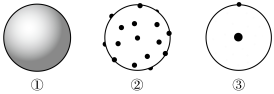
(1)下列图①②③原子结构模型中依次符合卢瑟福、道尔顿、汤姆孙的观点的是___________。
(2)一种元素有质量数分别为35,37的两种核素,该元素的近似相对原子质量为35.5,则两种核素的丰度之比为___________ 。
(3)下列微粒中,具有相同的电子层数与最外层电子数的是___________。
(1)下列图①②③原子结构模型中依次符合卢瑟福、道尔顿、汤姆孙的观点的是___________。

| A.①②③ | B.③①② | C.③②① | D.②①③ |
(2)一种元素有质量数分别为35,37的两种核素,该元素的近似相对原子质量为35.5,则两种核素的丰度之比为
(3)下列微粒中,具有相同的电子层数与最外层电子数的是___________。
| A.He与Li | B. 与 与 | C. 与 与 | D. 与Ar 与Ar |
您最近一年使用:0次
名校
解题方法
6 . 研究物质的微观结构和元素组成,并用恰当的化学用语进行表达,能帮助我们揭示物质变化的本质,发现物质变化的规律。
(1)下图是部分元素原子或离子的结构示意图.请你仔细观察、分析,用序号填空:
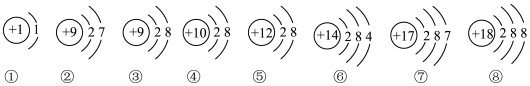
①上述粒子中,属于稀有气体元素的原子是_____________ ;
②在化学反应中容易得到电子的是_____________ ;
③属于正离子的是_____________ ;
④表示 的是
的是_____________ ;
⑤属于同一种元素的是_____________ ;
⑥属于非金属元素的是_____________ ;
⑦电子层数相同、最外层电子数也相同的粒子有_____________ .
(2)卤族元素F和 具有相似的化学性质,其原因是它们的原子具有相同的
具有相似的化学性质,其原因是它们的原子具有相同的
(3)写出铝离子的结构示意图①_____________ ,其核外能量最高的电子层符号为②___________ 。
(4)两种微粒的电子数相同,质子数不同,则它们可能是
①两种不同的原子;②两种不同的离子;③同一种元素的原子和离子;④不同元素的原子和离子
(5)在第n电子层中,当它作为原子的最外电子层时,最多容纳的电子数与 层相同,当它作为原子的次外层时,其电子数比
层相同,当它作为原子的次外层时,其电子数比 层最少能多10个,则此电子层是
层最少能多10个,则此电子层是
(6)一瓶气体经分析只含一种元素,则该气体
(7)下列物质变化过程不会破坏化学键的是
(8)下列关于化学键的说法正确的是
(9) 的电子式是
的电子式是_____________ 。
(10)请用电子式表示 的形成过程
的形成过程_____________ 。
(1)下图是部分元素原子或离子的结构示意图.请你仔细观察、分析,用序号填空:

①上述粒子中,属于稀有气体元素的原子是
②在化学反应中容易得到电子的是
③属于正离子的是
④表示
 的是
的是⑤属于同一种元素的是
⑥属于非金属元素的是
⑦电子层数相同、最外层电子数也相同的粒子有
(2)卤族元素F和
 具有相似的化学性质,其原因是它们的原子具有相同的
具有相似的化学性质,其原因是它们的原子具有相同的 | A.电子层数 | B.核外电子数 | C.最外层电子数 | D.原子半径 |
(3)写出铝离子的结构示意图①
(4)两种微粒的电子数相同,质子数不同,则它们可能是
①两种不同的原子;②两种不同的离子;③同一种元素的原子和离子;④不同元素的原子和离子
| A.①和④ | B.②和③ | C.①和③ | D.②和④ |
(5)在第n电子层中,当它作为原子的最外电子层时,最多容纳的电子数与
 层相同,当它作为原子的次外层时,其电子数比
层相同,当它作为原子的次外层时,其电子数比 层最少能多10个,则此电子层是
层最少能多10个,则此电子层是 | A.K层 | B.M层 | C.L层 | D.N层 |
(6)一瓶气体经分析只含一种元素,则该气体
| A.一定是单质 | B.可能是化合物 |
| C.可能是几种单质的混合物 | D.可能是化合物与单质的混合物 |
(7)下列物质变化过程不会破坏化学键的是
| A.水气化为水蒸气 | B.水蒸气在高温下分解为氢气和氧气 |
| C.氯化钠溶于水 | D.氯化钠熔化 |
(8)下列关于化学键的说法正确的是
| A.破坏化学键会放出能量 | B.所有物质中都存在化学键 |
| C.金属元素和非金属元素间一定形成离子键 | D.离子化合物中不一定含有金属元素 |
(9)
 的电子式是
的电子式是(10)请用电子式表示
 的形成过程
的形成过程
您最近一年使用:0次
解题方法
7 . 锑( )冶炼过程中产生的副产物主要成分为
)冶炼过程中产生的副产物主要成分为 、
、 、
、 和
和 等,因含银量很高,是重要的银提取原料。从该副产物中提取银的工艺流程如下:
等,因含银量很高,是重要的银提取原料。从该副产物中提取银的工艺流程如下:

已知:①水合肼为 ,有很强的还原性;
,有很强的还原性;
② 在碱性条件下易转化为
在碱性条件下易转化为 ;
;
③常温下, 的溶解度为
的溶解度为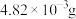 ,
, 的溶解度为0.79g。
的溶解度为0.79g。
回答下列问题:
(1) 的电子式为
的电子式为_______ 。
(2)脱氯渣的主要成分有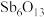 、
、 、
、 和
和_______ 。
(3)“还原脱氯”过程中会产生无色无味无毒气体,则 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(4)“氧化分银”中,不直接用硝酸的原因是_______ 。
(5)“氧化分银”中,银被氧化的离子方程式为_______ 。
(6)“沉铅过滤”中主要析出 的原因是
的原因是_______ 。
(7)“沉铅过滤”中硫酸的用量系数对铅和银的沉淀率影响如图所示。
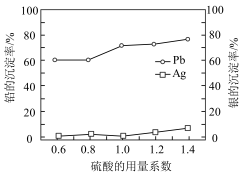
硫酸的用量系数最佳选择是_______ ,理由是_______ 。
 )冶炼过程中产生的副产物主要成分为
)冶炼过程中产生的副产物主要成分为 、
、 、
、 和
和 等,因含银量很高,是重要的银提取原料。从该副产物中提取银的工艺流程如下:
等,因含银量很高,是重要的银提取原料。从该副产物中提取银的工艺流程如下:
已知:①水合肼为
 ,有很强的还原性;
,有很强的还原性;②
 在碱性条件下易转化为
在碱性条件下易转化为 ;
;③常温下,
 的溶解度为
的溶解度为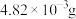 ,
, 的溶解度为0.79g。
的溶解度为0.79g。回答下列问题:
(1)
 的电子式为
的电子式为(2)脱氯渣的主要成分有
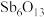 、
、 、
、 和
和(3)“还原脱氯”过程中会产生无色无味无毒气体,则
 发生反应的化学方程式为
发生反应的化学方程式为(4)“氧化分银”中,不直接用硝酸的原因是
(5)“氧化分银”中,银被氧化的离子方程式为
(6)“沉铅过滤”中主要析出
 的原因是
的原因是(7)“沉铅过滤”中硫酸的用量系数对铅和银的沉淀率影响如图所示。

硫酸的用量系数最佳选择是
您最近一年使用:0次
解题方法
8 . 二氧化氯消毒剂是国际上公认的高效消毒灭菌剂,回答下列问题:
I.制备ClO2
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
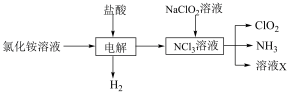
(1)NH4Cl的电子式为___________ 。
(2)若NaClO2与NCl3完全反应,则“溶液X”中的溶质为________ (填化学式)。
Ⅱ.NaClO2的应用
(3)NaClO2具有强氧化性,可将烟气中的NO氧化为NO ,在该反应过程中无有毒气体生成。其他条件相同时,以NaClO2溶液为吸收剂,测得相同时间内NO的氧化率随NaClO2的起始浓度的变化情况如图所示。
,在该反应过程中无有毒气体生成。其他条件相同时,以NaClO2溶液为吸收剂,测得相同时间内NO的氧化率随NaClO2的起始浓度的变化情况如图所示。
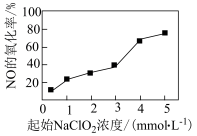
①NaClO2溶液在酸性条件下除去NO的离子方程式为___________ 。
②NO的氧化率随起始NaClO2浓度的增大而增大,原因是___________ 。
(4)ClO2具有较好的杀菌消毒作用。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克氯气的氧化能力。若ClO2的还原产物为Cl-,则ClO2的有效氯含量为___________ (保留2位小数)。
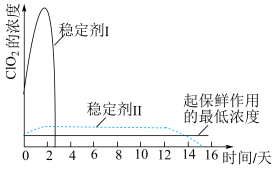
(5)ClO2能被多种稳定剂吸收,若将其用于果蔬保鲜,你认为下图中效果较好的稳定剂是___________ (填“稳定剂I”或“稳定剂Ⅱ”),原因是___________ 。
I.制备ClO2
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:

(1)NH4Cl的电子式为
(2)若NaClO2与NCl3完全反应,则“溶液X”中的溶质为
Ⅱ.NaClO2的应用
(3)NaClO2具有强氧化性,可将烟气中的NO氧化为NO
 ,在该反应过程中无有毒气体生成。其他条件相同时,以NaClO2溶液为吸收剂,测得相同时间内NO的氧化率随NaClO2的起始浓度的变化情况如图所示。
,在该反应过程中无有毒气体生成。其他条件相同时,以NaClO2溶液为吸收剂,测得相同时间内NO的氧化率随NaClO2的起始浓度的变化情况如图所示。
①NaClO2溶液在酸性条件下除去NO的离子方程式为
②NO的氧化率随起始NaClO2浓度的增大而增大,原因是
(4)ClO2具有较好的杀菌消毒作用。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克氯气的氧化能力。若ClO2的还原产物为Cl-,则ClO2的有效氯含量为
(5)ClO2能被多种稳定剂吸收,若将其用于果蔬保鲜,你认为下图中效果较好的稳定剂是

您最近一年使用:0次
名校
9 . 元素周期表的一部分如下,表中所列序号分别代表元素周期表中的一种元素。
(1)元素⑪在元素周期表中的位置是___________ ;元素②的原子结构示意图为___________ 。
(2)元素④的最简单氢化物与元素⑩的最简单氢化物可发生化学反应,请写出该反应的化学方程式:___________ ,其中生成物的电子式为。___________ 。
(3)⑥⑦⑨的最高价氧化物对应的水化物两两间均能发生反应,请写出⑥⑦的最高价氧化物对应的水化物之间反应的离子方程式:___________ 。
(4)⑤⑧⑨的最简单氢化物中热稳定性由强到弱的顺序为___________ 。(填氢化物的化学式)
(5)将⑩的单质通入⑪的单质的水溶液中可生成两种酸,其中氧化剂与还原剂的物质的量之比为5∶1,请写出该反应的化学方程式:___________ 。
(6)化合物X由①⑤⑥三种元素组成,化合物Y是元素③的最高价氧化物,将标准状况下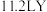 通入
通入 溶液中,Y完全被吸收。通过计算判断所得溶液中溶质的组成并计算其物质的量之比:
溶液中,Y完全被吸收。通过计算判断所得溶液中溶质的组成并计算其物质的量之比:___________ (不用写出计算过程)。
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ||||||||||||||
| ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||||||||||||
| ⑪ |
(2)元素④的最简单氢化物与元素⑩的最简单氢化物可发生化学反应,请写出该反应的化学方程式:
(3)⑥⑦⑨的最高价氧化物对应的水化物两两间均能发生反应,请写出⑥⑦的最高价氧化物对应的水化物之间反应的离子方程式:
(4)⑤⑧⑨的最简单氢化物中热稳定性由强到弱的顺序为
(5)将⑩的单质通入⑪的单质的水溶液中可生成两种酸,其中氧化剂与还原剂的物质的量之比为5∶1,请写出该反应的化学方程式:
(6)化合物X由①⑤⑥三种元素组成,化合物Y是元素③的最高价氧化物,将标准状况下
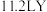 通入
通入 溶液中,Y完全被吸收。通过计算判断所得溶液中溶质的组成并计算其物质的量之比:
溶液中,Y完全被吸收。通过计算判断所得溶液中溶质的组成并计算其物质的量之比:
您最近一年使用:0次
名校
解题方法
10 . LiNiO2是一种应用广泛的电动汽车电极材料,以铁镍合金的废角料(含少量铜)为原料,生产电极材料LiNiO2的部分工艺流程如下:

已知:①表中列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
② ;
;
回答下列问题:
(1)“酸溶”时温度要控制在70~80℃,温度不宜过低和过高,其原因是___________ ;为提高“酸溶”的速率,可采取的措施___________ (写出一种)。
(2)H2O2的电子式为___________ ;“氧化”时加入H2O2的目的是(用离子方程式表示)___________ 。
(3)加入NaOH的目的是通过调pH使Fe3+沉淀,其pH的范围是___________ 。
(4)“除铜”时若选用NaOH,会导致部分Ni2+也产生沉淀,当溶液中Ni(OH)2、Cu(OH)2沉淀同时存在时,溶液中c(Ni2+):c(Cu2+)=___________ 。
(5)“沉镍”时可用碳酸氢钠代替碳酸钠得到碳酸镍(NiCO3)沉淀,写出该反应的离子方程式___________ 。

已知:①表中列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
| 开始沉淀的pH | 沉淀完全的pH | |
| Ni2+ | 6.7 | 9.5 |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
 ;
;
回答下列问题:
(1)“酸溶”时温度要控制在70~80℃,温度不宜过低和过高,其原因是
(2)H2O2的电子式为
(3)加入NaOH的目的是通过调pH使Fe3+沉淀,其pH的范围是
(4)“除铜”时若选用NaOH,会导致部分Ni2+也产生沉淀,当溶液中Ni(OH)2、Cu(OH)2沉淀同时存在时,溶液中c(Ni2+):c(Cu2+)=
(5)“沉镍”时可用碳酸氢钠代替碳酸钠得到碳酸镍(NiCO3)沉淀,写出该反应的离子方程式
您最近一年使用:0次



