解题方法
1 . 乙炔是最简单的炔烃,常用氧炔焰来焊接或切割金属。下列有关其化学用语表达错误的是
A.电子式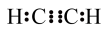 |
B.球棍模型 |
C.C原子杂化轨道电子云轮廓图 |
D.基态C原子价层电子排布图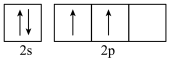 |
您最近一年使用:0次
解题方法
2 . 锑( )冶炼过程中产生的副产物主要成分为
)冶炼过程中产生的副产物主要成分为 、
、 、
、 和
和 等,因含银量很高,是重要的银提取原料。从该副产物中提取银的工艺流程如下:
等,因含银量很高,是重要的银提取原料。从该副产物中提取银的工艺流程如下:

已知:①水合肼为 ,有很强的还原性;
,有很强的还原性;
② 在碱性条件下易转化为
在碱性条件下易转化为 ;
;
③常温下, 的溶解度为
的溶解度为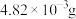 ,
, 的溶解度为0.79g。
的溶解度为0.79g。
回答下列问题:
(1) 的电子式为
的电子式为_______ 。
(2)脱氯渣的主要成分有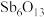 、
、 、
、 和
和_______ 。
(3)“还原脱氯”过程中会产生无色无味无毒气体,则 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(4)“氧化分银”中,不直接用硝酸的原因是_______ 。
(5)“氧化分银”中,银被氧化的离子方程式为_______ 。
(6)“沉铅过滤”中主要析出 的原因是
的原因是_______ 。
(7)“沉铅过滤”中硫酸的用量系数对铅和银的沉淀率影响如图所示。
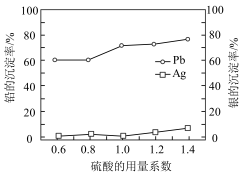
硫酸的用量系数最佳选择是_______ ,理由是_______ 。
 )冶炼过程中产生的副产物主要成分为
)冶炼过程中产生的副产物主要成分为 、
、 、
、 和
和 等,因含银量很高,是重要的银提取原料。从该副产物中提取银的工艺流程如下:
等,因含银量很高,是重要的银提取原料。从该副产物中提取银的工艺流程如下:
已知:①水合肼为
 ,有很强的还原性;
,有很强的还原性;②
 在碱性条件下易转化为
在碱性条件下易转化为 ;
;③常温下,
 的溶解度为
的溶解度为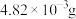 ,
, 的溶解度为0.79g。
的溶解度为0.79g。回答下列问题:
(1)
 的电子式为
的电子式为(2)脱氯渣的主要成分有
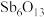 、
、 、
、 和
和(3)“还原脱氯”过程中会产生无色无味无毒气体,则
 发生反应的化学方程式为
发生反应的化学方程式为(4)“氧化分银”中,不直接用硝酸的原因是
(5)“氧化分银”中,银被氧化的离子方程式为
(6)“沉铅过滤”中主要析出
 的原因是
的原因是(7)“沉铅过滤”中硫酸的用量系数对铅和银的沉淀率影响如图所示。

硫酸的用量系数最佳选择是
您最近一年使用:0次
解题方法
3 . 化合物( )可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21,
)可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21, 分子的总电子数为奇数,常温下为酸雨成因的一种气体。该化合物的热重曲线如图所示,在
分子的总电子数为奇数,常温下为酸雨成因的一种气体。该化合物的热重曲线如图所示,在 以下热分解时无刺激性气体逸出。
以下热分解时无刺激性气体逸出。
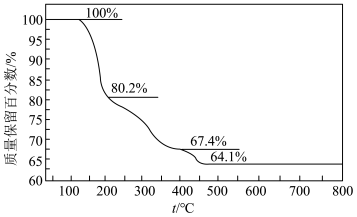
回答下列问题(使用相应的元素符号或化学式 ):
(1)元素Q比W元素核内质子数多18,基态Q原子中核外电子占据最高能层符号为_______ ,该能层最多能容纳_______ 个电子。
(2)W与Y形成的一种 分子,用电子式表示该物质的形成过程:
分子,用电子式表示该物质的形成过程:_______ ,该分子与 混合时能发生反应,生成两种环境友好的分子,因而成为火箭推进剂的原料,写出该反应化学方程式:
混合时能发生反应,生成两种环境友好的分子,因而成为火箭推进剂的原料,写出该反应化学方程式:_______ 。
(3)化合物 ( )中存在的主要化学键有
)中存在的主要化学键有_______ 。
a.氢键 b.极性共价键 c.范德华力 d.离子键
(4)X与Y的最高价氧化物的水化物酸性:_______>_______(填化学式)。______
(5)下列说法正确的是_______(填字母)。
(6)用化学方程式表示该化合物热分解的总反应_______ 。
 )可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21,
)可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21, 分子的总电子数为奇数,常温下为酸雨成因的一种气体。该化合物的热重曲线如图所示,在
分子的总电子数为奇数,常温下为酸雨成因的一种气体。该化合物的热重曲线如图所示,在 以下热分解时无刺激性气体逸出。
以下热分解时无刺激性气体逸出。
回答下列问题(使用相应的
(1)元素Q比W元素核内质子数多18,基态Q原子中核外电子占据最高能层符号为
(2)W与Y形成的一种
 分子,用电子式表示该物质的形成过程:
分子,用电子式表示该物质的形成过程: 混合时能发生反应,生成两种环境友好的分子,因而成为火箭推进剂的原料,写出该反应化学方程式:
混合时能发生反应,生成两种环境友好的分子,因而成为火箭推进剂的原料,写出该反应化学方程式:(3)化合物 (
 )中存在的主要化学键有
)中存在的主要化学键有a.氢键 b.极性共价键 c.范德华力 d.离子键
(4)X与Y的最高价氧化物的水化物酸性:_______>_______(填化学式)。
(5)下列说法正确的是_______(填字母)。
A.盛满 的试管倒扣在水槽中,水可充满试管且得到某一元强酸溶液 的试管倒扣在水槽中,水可充满试管且得到某一元强酸溶液 |
| B.YZ可用向上排空气法收集 |
| C.W、X、Y、Z的单质常温下均为固体 |
D. 阶段热分解只失去部分结晶水 阶段热分解只失去部分结晶水 |
您最近一年使用:0次
名校
解题方法
4 . 硫脲[ ]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(
]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙( )与
)与 溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
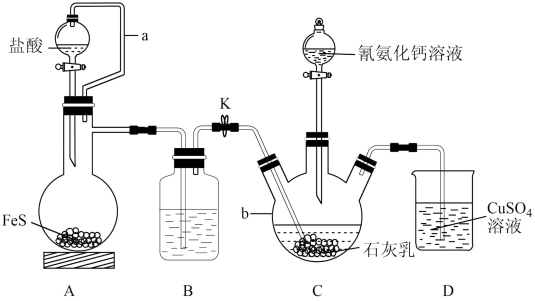
回答下列问题:
(1) 的电子式为
的电子式为_______ 。仪器b的名称是_______ 。
(2)装置A中a的作用是_______ ,A中发生反应的化学方程式为_______ 。
(3)装置B中盛放的试剂是_______ ,其作用是_______ 。
(4)装置C中生成硫脲的总反应为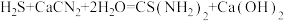 ,若反应分两步进行,写出第二步生成硫脲的化学方程式:
,若反应分两步进行,写出第二步生成硫脲的化学方程式:_______ 。
(5)装置D中可能出现的现象是_______ 。
(6)硫氰化铵( )熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
)熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是_______ (写出操作步骤和实验现象)。
 ]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(
]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙( )与
)与 溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
回答下列问题:
(1)
 的电子式为
的电子式为(2)装置A中a的作用是
(3)装置B中盛放的试剂是
(4)装置C中生成硫脲的总反应为
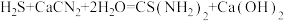 ,若反应分两步进行,写出第二步生成硫脲的化学方程式:
,若反应分两步进行,写出第二步生成硫脲的化学方程式:(5)装置D中可能出现的现象是
(6)硫氰化铵(
 )熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
)熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
您最近一年使用:0次
2022-04-16更新
|
440次组卷
|
3卷引用:湖北省九师联盟2022届高三 三模考试化学试题
5 . 153年前门捷列夫制得世界上第一张元素周期表,它反映了元素之间的内在联系,是对元素的一种很好的自然分类。下图为现代元素周期表的一部分,请回答下列问题:(以下问题均用相应的化学符号表达)
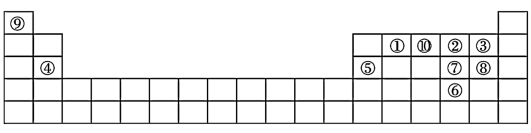
(1)在这10种元素中,非金属性最强的元素对应的单质与水反应的化学方程式:_______ ;③④⑦⑧的简单离子半径由大到小依次为_______ 。
(2)元素①的简单气态氢化物的电子式为_______ ;用电子式表示②与⑨形成 化合物的过程
化合物的过程_______ 。
(3)HSCN是弱酸,它的浓溶液与软锰矿的反应和⑧的氢化物与软锰矿的反应类似,请写出浓HSCN溶液和软锰矿在加热条件下的离子方程式:_______ ;反应中断裂的化学键类型有:_______ 、_______ 。
(4)比较元素⑦⑧形成的气态氢化物的稳定性:_______ >_______ (用化学式表示)。
(5)在含有⑨、④、⑤简单阳离子的100 mL溶液中,逐滴滴加 的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。由图中数据分析计算:
的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。由图中数据分析计算:

①沉淀减少时发生的离子方程式:_______ 。
②a点的数值为:_______ mL。

(1)在这10种元素中,非金属性最强的元素对应的单质与水反应的化学方程式:
(2)元素①的简单气态氢化物的电子式为
 化合物的过程
化合物的过程(3)HSCN是弱酸,它的浓溶液与软锰矿的反应和⑧的氢化物与软锰矿的反应类似,请写出浓HSCN溶液和软锰矿在加热条件下的离子方程式:
(4)比较元素⑦⑧形成的气态氢化物的稳定性:
(5)在含有⑨、④、⑤简单阳离子的100 mL溶液中,逐滴滴加
 的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。由图中数据分析计算:
的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。由图中数据分析计算:
①沉淀减少时发生的离子方程式:
②a点的数值为:
您最近一年使用:0次
解题方法
6 . 有机化合物I是一种重要的有机反应中间体,可通过A经历如图所示的一系列反应合成得到。

请回答下列问题:
(1)A的名称是_______ ,化合物H中含有的官能团名称是_______ 。
(2)A→B,F→G的反应类型分别是_______ 、_______ 。
(3)写出反应①所需的无机试剂_______ 。
(4)合成路线中设计A→B的目的为_______ 。
(5)有机反应往往伴随着副反应,化合物E是甲基环氧乙烷,较易断开C-O键,D与E反应生成F的过程中生成了与F具有完全相同官能团的同分异构体,请写出其结构_______ 。
(6)写出反应②的化学方程式_______ 。
(7)E的同分异构体有_______ 种(不包含E本身),已知:羟基连接在碳碳双键上不稳定。

请回答下列问题:
(1)A的名称是
(2)A→B,F→G的反应类型分别是
(3)写出反应①所需的无机试剂
(4)合成路线中设计A→B的目的为
(5)有机反应往往伴随着副反应,化合物E是甲基环氧乙烷,较易断开C-O键,D与E反应生成F的过程中生成了与F具有完全相同官能团的同分异构体,请写出其结构
(6)写出反应②的化学方程式
(7)E的同分异构体有
您最近一年使用:0次
解题方法
7 . 有A、B、C、D、E、F六种短周期主族元素,原子序数由A到F逐渐增大。①A是短周期元素中原子半径最小的元素②B元素最外层电子数是次外层电子数的2倍。 ③C的阴离子和D的阳离子与氖原子的电子层结构相同。④在通常状况下,C的单质是气体,0.1molC的气体与足量的氢气完全反应共有0.4mol电子转移。⑤D的单质在点燃时与C的单质充分反应,生成淡黄色的固体,此淡黄色固体能与BC2反应可生成C的单质。⑥E的气态氢化物与其最高价含氧酸间能发生氧化还原反应。请写出:
(1)B元素的最高价氧化物的结构式_____________ 。
(2)符合分子式B4A10的所有同分异构结构简式______________________________ 。
(3)C、D、E、F简单离子半径由大到小的顺序______________ (用离子符号表示)。
(4)E元素的低价氧化物与F的单质的水溶液反应的离子方程式为______________ 。
(5)D与E能形成2:1的化合物,用电子式表示该化合物的形成过程______________ 。
(6)元素E与元素F相比,非金属性较强的是___________ (用元素符号表示),下列表述中能证 明这一事实的是_________________ (填选项序号)。
a.常温下E的单质和F的单质状态不同
b.F的氢化物比E的氢化物稳定
c.一定条件下E和F的单质都能与钠反应
d.E的最高价含氧酸酸性弱于F的最高价含氧酸
e.F的单质能与E氢化物反应生成E单质
(1)B元素的最高价氧化物的结构式
(2)符合分子式B4A10的所有同分异构结构简式
(3)C、D、E、F简单离子半径由大到小的顺序
(4)E元素的低价氧化物与F的单质的水溶液反应的离子方程式为
(5)D与E能形成2:1的化合物,用电子式表示该化合物的形成过程
(6)元素E与元素F相比,非金属性较强的是
a.常温下E的单质和F的单质状态不同
b.F的氢化物比E的氢化物稳定
c.一定条件下E和F的单质都能与钠反应
d.E的最高价含氧酸酸性弱于F的最高价含氧酸
e.F的单质能与E氢化物反应生成E单质
您最近一年使用:0次



