解题方法
1 . 下表显示了元素周期表中的一部分。
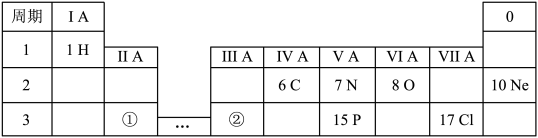
请回答下列问题:
(1)磷元素的原子序数是___________ 。
(2)属于稀有气体的是___________ (选填“ ”或“
”或“ ”)。
”)。
(3)碳元素在元素周期表的第___________ (选填“二”或“三”)周期第___________ (选填“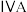 ”或“
”或“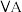 ”)族。
”)族。
(4)红棕色气体 中氮元素的化合价为
中氮元素的化合价为___________ (选填“ ”或“
”或“ ”)价。
”)价。
(5)含有共价键的单质是___________ (选填“ ”或“
”或“ ”)。
”)。
(6)已知同周期元素从左到右金属性逐渐减弱,则元素的金属性强弱:①___________ ②(选填“大于”或“小于”)。
(7)下列化学用语使用正确的是:___________ (填写字母)。
A.中子数为8的碳原子符号为 B.氯化氢的电子式为
B.氯化氢的电子式为

请回答下列问题:
(1)磷元素的原子序数是
(2)属于稀有气体的是
 ”或“
”或“ ”)。
”)。(3)碳元素在元素周期表的第
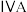 ”或“
”或“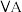 ”)族。
”)族。(4)红棕色气体
 中氮元素的化合价为
中氮元素的化合价为 ”或“
”或“ ”)价。
”)价。(5)含有共价键的单质是
 ”或“
”或“ ”)。
”)。(6)已知同周期元素从左到右金属性逐渐减弱,则元素的金属性强弱:①
(7)下列化学用语使用正确的是:
A.中子数为8的碳原子符号为
 B.氯化氢的电子式为
B.氯化氢的电子式为
您最近一年使用:0次
名校
2 . 短周期主族元素W、X、Y、Z的原子序数依次增大已知几种元素的性质或原子结构的相关叙述如表所示,回答下列问题。
(1)元素X的一种同位素可用来测定文物所属年代,这种同位素的原子符号是_______ 。
(2)Y形成的一种单质,主要存在于地球的平流层中,被称作地球生物的保护伞,该单质的化学式是_______ 。
(3)画出Z的原子结构示意图:_______ 。
(4)比较Y、Z简单离子的半径大小_______ 。
(5)由X元素组成的单质在Y元素组成的常见单质中完全燃烧,生成的产物用足量的氢氧化钠溶液吸收,反应的离子程式为_______ 。
(6)Z元素在元素周期表中的位置是:_______ ,其与Y组成的种二元化合物可以与水反应产生氧气,因此该化合物常用作供氧剂,该化合物与水反应的化学方程式为_______ ,常温常压反应产生气体32g时,转移电子数是_______ (阿伏伽德罗常数的值为NA)。
| 元素编号 | 元素性质或原子结构的相关叙述 |
| W | 单质是密度最小的气体 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 地球含量最高的元素 |
| Z | 单质与氯气化合的产物是厨房的调味剂 |
(2)Y形成的一种单质,主要存在于地球的平流层中,被称作地球生物的保护伞,该单质的化学式是
(3)画出Z的原子结构示意图:
(4)比较Y、Z简单离子的半径大小
(5)由X元素组成的单质在Y元素组成的常见单质中完全燃烧,生成的产物用足量的氢氧化钠溶液吸收,反应的离子程式为
(6)Z元素在元素周期表中的位置是:
您最近一年使用:0次
3 . 完成下列问题
(1)下列化学用语只能用来表示一种微粒的是______
(2)下列叙述中所描述的物质一定是金属元素的是______
(3)下列说法正确的是______
(4)X、Y、Z、W是原子序数依次增大的短周期元素。W与X位于同一主族;X、Y、Z三种元素形成的化合物具有强氧化性,其结构如下图所示;。
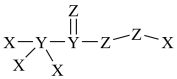
下列叙述错误的是______
(5)锶(Sr)位于元素周期表的第5周期ⅡA族。碳酸锶(SrCO3)是制取锶的原料,用天青石固体(主要成分SrSO4,难溶于水)和Na2CO3溶液混合浸泡可制取碳酸锶。完成下列填空:
①在上述反应体系中出现的几种短周期元素中,原子半径最大的是___________ (填元素符号,下同)。非金属性最强的是___________ 。写出与锶同族第3周期元素原子的结构示意图___________ 。
②反应体系中出现的非金属元素可形成二硫化碳(CS2),其分子构型是直线型分子,写出该分子的电子式___________ 。
③已知:锶的原子序数为38,某锶原子的质量数为88,写出能包含这些信息的一种化学符号___________ 。下列关于锶及其化合物的叙述中,错误的是___________ 。
a.锶的金属性比镁强 b.氢氢化锶呈两性
c.锶在化合物中呈+2价 d.锶在自然界中以游离态存在
(1)下列化学用语只能用来表示一种微粒的是______
| A.S | B.C2H6O | C.12C | D. |
(2)下列叙述中所描述的物质一定是金属元素的是______
| A.易失去电子的物质 | B.第三周期中,原子的最外电子层只有2个电子的元素 |
| C.单质具有金属光泽的元素 | D.原子的最外电子层只有1个电子的元素 |
(3)下列说法正确的是______
| A.H2O、H2S、H2Se的分子间作用力依次增大 |
| B.Na2O2、MgCl2、NaOH、NH4Cl均为含共价键的离子化合物 |
| C.化学键通常指的是相邻的原子或离子之间的强烈的相互作用 |
| D.NaHSO4加热熔化时破坏了该物质中的离子键和共价键 |
(4)X、Y、Z、W是原子序数依次增大的短周期元素。W与X位于同一主族;X、Y、Z三种元素形成的化合物具有强氧化性,其结构如下图所示;。
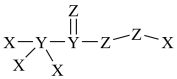
下列叙述错误的是______
| A.该化合物中各元素原子均达稳定结构 |
| B.Z的氢化物的沸点可能高于Y的氢化物 |
| C.Z、W形成的简单离子半径,Z大于W |
| D.由X、Y、Z、W四种元素形成的化合物一定能与X、Z、W形成的化合物反应 |
(5)锶(Sr)位于元素周期表的第5周期ⅡA族。碳酸锶(SrCO3)是制取锶的原料,用天青石固体(主要成分SrSO4,难溶于水)和Na2CO3溶液混合浸泡可制取碳酸锶。完成下列填空:
①在上述反应体系中出现的几种短周期元素中,原子半径最大的是
②反应体系中出现的非金属元素可形成二硫化碳(CS2),其分子构型是直线型分子,写出该分子的电子式
③已知:锶的原子序数为38,某锶原子的质量数为88,写出能包含这些信息的一种化学符号
a.锶的金属性比镁强 b.氢氢化锶呈两性
c.锶在化合物中呈+2价 d.锶在自然界中以游离态存在
您最近一年使用:0次
解题方法
4 . 如表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
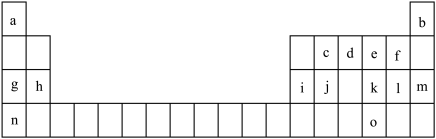
请根据要求用元素符号或化学式回答下列问题:
(1)表中所列元素中,原子最外层有2个电子的元素为______ 。(填元素符号)
(2)画出d元素原子的结构示意图_______ ,其气态氢化物能与其最高价氧化物对应水化物反应,反应生成的物质为_______ 。(填化学式)
(3)下列描述正确且能说明e元素的非金属性比o元素强的是_______ 。
(4)f,l,n的简单离子半径由大到小的顺序是_______ 。(用对应的离子符号表示)
(5)在盛有水的小烧杯中加入元素g的单质,待反应完成后,向上述反应后的溶液中再加入元素i的单质,则元素i发生反应的化学方程式为_______ 。
(6)用电子式表示g与l形成的化合物的过程______ 。

请根据要求用元素符号或化学式回答下列问题:
(1)表中所列元素中,原子最外层有2个电子的元素为
(2)画出d元素原子的结构示意图
(3)下列描述正确且能说明e元素的非金属性比o元素强的是
| A.e元素的单质熔点比o元素单质的低 |
| B.e元素的单质与氢气化合比o元素的单质更容易 |
| C.e元素最高价氧化物对应水化物的酸性比o的强 |
| D.e元素形成的氢化物比o元素形成的氢化物更稳定 |
(5)在盛有水的小烧杯中加入元素g的单质,待反应完成后,向上述反应后的溶液中再加入元素i的单质,则元素i发生反应的化学方程式为
(6)用电子式表示g与l形成的化合物的过程
您最近一年使用:0次
名校
解题方法
5 . Ⅰ、绿色发展是必由之路,我国宣布二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。以 制备甲醇是实现“双碳”目标的重要途径。在体积为2.5L的密闭容器中,充入
制备甲醇是实现“双碳”目标的重要途径。在体积为2.5L的密闭容器中,充入 和
和 ,180℃下反应仅得甲醇(沸点64.7℃)和物质X:
,180℃下反应仅得甲醇(沸点64.7℃)和物质X:
(1)CO2的电子式为_______ ;该反应的化学反应方程式为_______ 。
(2)为探究该反应原理,进行如下实验:某温度下,在容积为2L的恒容密闭容器中充入1molCO2和3.25molH2,在一定条件下发生上述反应,测得CO2(g)和CH3OH(g)的物质的量(n)随时间的变化关系如表所示。
①从反应开始到3min时,氢气的平均反应速率v(H2)=_______ mol·L-1·min-1。
②为了加快反应速率,可采取的措施有_______ (任写两点)。
(3)甲醇燃料电池具有启动快、效率高等优点。若以 溶液为电解液,其正极的电极反应式为
溶液为电解液,其正极的电极反应式为_______ 。
Ⅱ、将等物质的量的 、
、 混合于
混合于 的密闭容器中,发生如下反应:
的密闭容器中,发生如下反应: ,经
,经 后,测得
后,测得 的浓度为
的浓度为 的平均反应速率为0.1mol·L-1·min-1。求:
的平均反应速率为0.1mol·L-1·min-1。求:
(4)x的值为_______ 。
(5)此反应在四种不同情况下的反应速率如下,其反应速率由快到慢顺序为_______ 。
①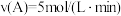 ②v(B)=3mol/(L·min) ③
②v(B)=3mol/(L·min) ③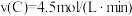 ④v(D)=8mol/(L·min)
④v(D)=8mol/(L·min)
 制备甲醇是实现“双碳”目标的重要途径。在体积为2.5L的密闭容器中,充入
制备甲醇是实现“双碳”目标的重要途径。在体积为2.5L的密闭容器中,充入 和
和 ,180℃下反应仅得甲醇(沸点64.7℃)和物质X:
,180℃下反应仅得甲醇(沸点64.7℃)和物质X:(1)CO2的电子式为
(2)为探究该反应原理,进行如下实验:某温度下,在容积为2L的恒容密闭容器中充入1molCO2和3.25molH2,在一定条件下发生上述反应,测得CO2(g)和CH3OH(g)的物质的量(n)随时间的变化关系如表所示。
| 时间 | 0min | 3min | 6min | 9min | 12min |
| n[CO2(g)]/mol | 1.00 | 0.50 | 0.35 | 0.25 | 0.25 |
| n[CH3OH(g)]/mol | 0 | 0.50 | 0.65 | 0.75 | 0.75 |
②为了加快反应速率,可采取的措施有
(3)甲醇燃料电池具有启动快、效率高等优点。若以
 溶液为电解液,其正极的电极反应式为
溶液为电解液,其正极的电极反应式为Ⅱ、将等物质的量的
 、
、 混合于
混合于 的密闭容器中,发生如下反应:
的密闭容器中,发生如下反应: ,经
,经 后,测得
后,测得 的浓度为
的浓度为 的平均反应速率为0.1mol·L-1·min-1。求:
的平均反应速率为0.1mol·L-1·min-1。求:(4)x的值为
(5)此反应在四种不同情况下的反应速率如下,其反应速率由快到慢顺序为
①
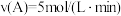 ②v(B)=3mol/(L·min) ③
②v(B)=3mol/(L·min) ③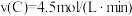 ④v(D)=8mol/(L·min)
④v(D)=8mol/(L·min)
您最近一年使用:0次
2023-04-24更新
|
126次组卷
|
2卷引用:湖北省襄阳市老河口市高级中学2022-2023学年高一下学期期中考试化学试题
解题方法
6 . 有A、B、C、D、E五种短周期主族元素,原子序数依次增大。①A元素最外层电子数是次外层电子数的2倍。②B的阴离子和C的阳离子与氖原子的电子层结构相同。③在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移。④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质。⑤D与B同主族且D的气态氢化物与其最高价含氧酸间能发生氧化还原反应。
(1)A元素的最高价氧化物的电子式_____ 。
(2)D元素在周期表的位置是_____ ,其简单阴离子的结构示意图为_____ 。B、C、D、E的简单离子半径由小到大的顺序为_____ (用化学式表示)。
(3)①下列表述能证明D非金属性比E弱这一事实的有_____ (填序号)。
A.常温下D的单质和E的单质状态不同
B.E的氢化物比D的氢化物稳定
C.一定条件下D和E的单质都能与钠反应
D.D的最高价含氧酸酸性弱于E的最高价含氧酸
E.D的单质能与E的氢化物反应生成E单质
②请从原子结构角度解释D非金属性比E弱的原因_____ 。
③请设计一个简单的实验证明D非金属性比E弱:_____ 。
(4)D元素的低价氧化物与E的单质的水溶液反应的离子方程式为_____ 。
(5)C与D能形成2:1的化合物,用电子式表示该化合物的形成过程:_____ 。
(1)A元素的最高价氧化物的电子式
(2)D元素在周期表的位置是
(3)①下列表述能证明D非金属性比E弱这一事实的有
A.常温下D的单质和E的单质状态不同
B.E的氢化物比D的氢化物稳定
C.一定条件下D和E的单质都能与钠反应
D.D的最高价含氧酸酸性弱于E的最高价含氧酸
E.D的单质能与E的氢化物反应生成E单质
②请从原子结构角度解释D非金属性比E弱的原因
③请设计一个简单的实验证明D非金属性比E弱:
(4)D元素的低价氧化物与E的单质的水溶液反应的离子方程式为
(5)C与D能形成2:1的化合物,用电子式表示该化合物的形成过程:
您最近一年使用:0次
名校
解题方法
7 . 表中列出了8种元素在周期表中的位置,用化学式或元素符号 回答下列问题:
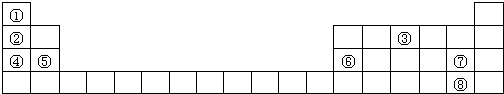
(1)上述元素最高价氧化物对应水化物中,酸性最强的是_______ (化学式)。
(2)①③两元素形成的化合物的电子式为_______ 。
(3)④的单质与水反应的离子方程式是_______ 。
(4)②④⑤原子半径由大到小的顺序是_______ 。
(5)写出⑥⑦两元素构成的化合物在水中发生电离的方程式_______ 。
(6)用电子式表示④与⑦形成化合物的过程_______ 。

(1)上述元素最高价氧化物对应水化物中,酸性最强的是
(2)①③两元素形成的化合物的电子式为
(3)④的单质与水反应的离子方程式是
(4)②④⑤原子半径由大到小的顺序是
(5)写出⑥⑦两元素构成的化合物在水中发生电离的方程式
(6)用电子式表示④与⑦形成化合物的过程
您最近一年使用:0次
解题方法
8 . 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知镍镉电池的电池总反应为: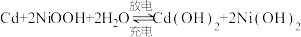 ,利用废旧镍镉电池回收铬的流程如下:
,利用废旧镍镉电池回收铬的流程如下:
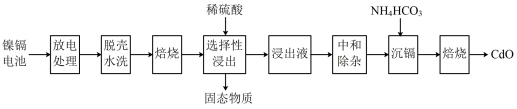
已知:中和除杂后的溶液中主要含有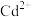 、
、 、
、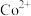 。
。
回答下列问题:
(1)NiOOH中,Ni的化合价为:______ 。
(2)写出“焙烧”过程中含镍物质变化的化学反应方程式:______ 。
(3)在“选择性浸出”一步中,40℃时,不同的金属氧化物在稀 中2小时后的浸出率随PH的变化如下图1所示,则:
中2小时后的浸出率随PH的变化如下图1所示,则:

①“选择性浸出”时,最适宜的pH为______ (填选项字母),写出在此pH下发生的主要离子方程式:______ 。
A.5 B.4 C.3 D.2
②浸出液中各元素含量如表1所示。Co的浓度比镍还小的原因可能是:______ 。
表1 浸出液组成
(4)沉铬时生成 的离子反应方程式:
的离子反应方程式:______ 。
(5)镍铬电池充电时, 移向
移向______ (填“明极”或“阳极”),写出阳极的电极反应式:______ 。
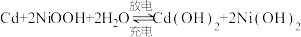 ,利用废旧镍镉电池回收铬的流程如下:
,利用废旧镍镉电池回收铬的流程如下:
已知:中和除杂后的溶液中主要含有
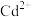 、
、 、
、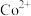 。
。回答下列问题:
(1)NiOOH中,Ni的化合价为:
(2)写出“焙烧”过程中含镍物质变化的化学反应方程式:
(3)在“选择性浸出”一步中,40℃时,不同的金属氧化物在稀
 中2小时后的浸出率随PH的变化如下图1所示,则:
中2小时后的浸出率随PH的变化如下图1所示,则:
①“选择性浸出”时,最适宜的pH为
A.5 B.4 C.3 D.2
②浸出液中各元素含量如表1所示。Co的浓度比镍还小的原因可能是:
| 元素Elements | Cd | Ni | Co | Fe |
浓度(Concentrations/( ) ) | 77.5 | 2.61 | 0.406 | 0.176 |
表1 浸出液组成
(4)沉铬时生成
 的离子反应方程式:
的离子反应方程式:(5)镍铬电池充电时,
 移向
移向
您最近一年使用:0次
2022-08-18更新
|
155次组卷
|
2卷引用:贵州省遵义市新高考协作体2022-2023学年高三上学期入学质量检测理综化学试题
9 . 废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为 。某探究小组回收处理流程如图:
。某探究小组回收处理流程如图:
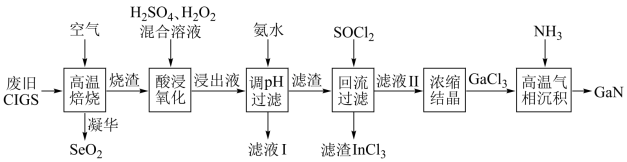
回答下列问题:
(1)硒(Se)与硫为同族元素,Se的最外层电子数为_______ ;在化合物 中镓(Ga)和铟(In)均为+3价,则Cu的化合价为
中镓(Ga)和铟(In)均为+3价,则Cu的化合价为_______ 。
(2)“酸浸氧化”得蓝色溶液,则该过程发生的主要氧化还原反应的化学方程式为_______ 。
(3)氢氧化铜沉淀可溶于氨水,则滤液I中的阴离子主要有_______ 和_______ 两种。
(4)滤渣加入 混合前需要洗涤、干燥,并用试剂
混合前需要洗涤、干燥,并用试剂_______ 和_______ 来检验滤渣中的 是否洗净。
是否洗净。
(5)滤渣加入 可反生反应:
可反生反应: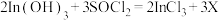 ;对物质X的性质有如下判断,你认为不正确的是 。
;对物质X的性质有如下判断,你认为不正确的是 。
(6)“高温气相沉积”过程中发生的化学反应方程式为_______ 。
 。某探究小组回收处理流程如图:
。某探究小组回收处理流程如图:
回答下列问题:
(1)硒(Se)与硫为同族元素,Se的最外层电子数为
 中镓(Ga)和铟(In)均为+3价,则Cu的化合价为
中镓(Ga)和铟(In)均为+3价,则Cu的化合价为(2)“酸浸氧化”得蓝色溶液,则该过程发生的主要氧化还原反应的化学方程式为
(3)氢氧化铜沉淀可溶于氨水,则滤液I中的阴离子主要有
(4)滤渣加入
 混合前需要洗涤、干燥,并用试剂
混合前需要洗涤、干燥,并用试剂 是否洗净。
是否洗净。(5)滤渣加入
 可反生反应:
可反生反应: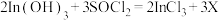 ;对物质X的性质有如下判断,你认为不正确的是 。
;对物质X的性质有如下判断,你认为不正确的是 。| A.有弱酸性 | B.可使溴水褪色 |
C.与 溶液反应得白色沉淀 溶液反应得白色沉淀 | D.与烧碱溶液反应可生成两种盐 |
您最近一年使用:0次
2022-05-13更新
|
240次组卷
|
3卷引用:湖北省鄂州市部分高中教科研协作体2021-2022学年高一下学期期中考试化学试题
湖北省鄂州市部分高中教科研协作体2021-2022学年高一下学期期中考试化学试题(已下线)第13练 自然资源的开发利用-2022年【暑假分层作业】高一化学(人教版2019必修第二册)广东省实验中学2023-2024学年高三上学期第一次阶段考试化学试题
2022高三·全国·专题练习
解题方法
10 . 从木姜子中提取的化合物K具有抗肿瘤活性,下列为K的人工合成路线。

已知:格氏反应:R1X+R2MgX→R1-R2+MgX2(X为卤素原子)
回答下列问题:
(1)A的分子式为_______ 。
(2)TBSCl在此合成中作用是_______ 。
(3)F的结构简式为_______ ,H中的R基团的化学式为_______ 。
(4)化合物K中有_______ 个手性碳原子。
(5)E的同系物分子式为C7H12O,其核磁共振氢谱峰面积比为4∶4∶2∶1∶1,写出该化合物的结构简式_______ 。
(6)反应⑧的反应类型为_______ 。
(7)设计由CH3CH2OH制备CH3(CH2)4CH3的合成路线_______ 。(无机试剂任选)

已知:格氏反应:R1X+R2MgX→R1-R2+MgX2(X为卤素原子)
回答下列问题:
(1)A的分子式为
(2)TBSCl在此合成中作用是
(3)F的结构简式为
(4)化合物K中有
(5)E的同系物分子式为C7H12O,其核磁共振氢谱峰面积比为4∶4∶2∶1∶1,写出该化合物的结构简式
(6)反应⑧的反应类型为
(7)设计由CH3CH2OH制备CH3(CH2)4CH3的合成路线
您最近一年使用:0次



