2023高三·全国·专题练习
1 . 煤中硫的存在形态分为有机硫和无机硫(CaSO4、硫化物及微量单质硫等)。库仑滴定法是常用的快捷检测煤中全硫含量的方法。其主要过程如下图所示。
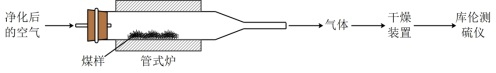
已知:在催化剂作用下,煤在管式炉中燃烧,出口气体主要含O2、CO2、H2O、N2、SO2。高温下,煤中CaSO4完全转化为SO2,该反应的化学方程式为___________ 。

已知:在催化剂作用下,煤在管式炉中燃烧,出口气体主要含O2、CO2、H2O、N2、SO2。高温下,煤中CaSO4完全转化为SO2,该反应的化学方程式为
您最近一年使用:0次
2023高三·全国·专题练习
2 . FeS2、FeS在空气中易被氧化,将FeS2在空气中氧化,测得氧化过程中剩余固体的质量与起始FeS2的质量的比值随温度变化的曲线如图所示。800℃时,FeS2氧化成含有两种元素的固体产物为_______ (填化学式)。


您最近一年使用:0次
2023高三·全国·专题练习
3 . 金属钠及其化合物在人类生产生活中起着重要作用。天然碱的主要成分为 ,1mol
,1mol  经充分加热得到
经充分加热得到 的质量为
的质量为_______ g。
 ,1mol
,1mol  经充分加热得到
经充分加热得到 的质量为
的质量为
您最近一年使用:0次
2023高三·全国·专题练习
4 . 将一颗质量为5.6g的铁钉,在潮湿的空气中放置一段时间后,向其中缓缓滴入2mol/L的稀盐酸,充分反应至恰好完全溶解,则盐酸的体积最少可以是
| A.67mL | B.100mL | C.150mL | D.200mL |
您最近一年使用:0次
2023高三·全国·专题练习
5 . 在标准状况下,有750mL含臭氧的氧气,其中臭氧完全分解后体积变为780mL,若将此含臭氧的氧气1L通入碘化钾溶液中,发生如下反应:2KI+O3+H2O=2KOH+I2↓+O2,则生成的碘的质量是
| A.0.91g | B.0.81g | C.0.71g | D.0.61g |
您最近一年使用:0次
解题方法
6 . 将12.0g铜粉缓慢加入到50.0mL某浓度的浓硝酸中,随反应的进行,产生的 和NO总体积(折算成标准状况)随铜粉加入量的变化如图。完成下列问题:
和NO总体积(折算成标准状况)随铜粉加入量的变化如图。完成下列问题:___________ mol。
(2)反应中生成的 和NO的体积之比为
和NO的体积之比为___________ 。
(3)原硝酸的物质的量浓度为___________  。
。
(4)若使铜粉继续溶解,可向反应后的溶液中加入___________。
 和NO总体积(折算成标准状况)随铜粉加入量的变化如图。完成下列问题:
和NO总体积(折算成标准状况)随铜粉加入量的变化如图。完成下列问题: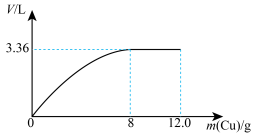
(2)反应中生成的
 和NO的体积之比为
和NO的体积之比为(3)原硝酸的物质的量浓度为
 。
。(4)若使铜粉继续溶解,可向反应后的溶液中加入___________。
| A.稀硫酸 | B. 固体 固体 |
C. 固体 固体 | D. 固体 固体 |
您最近一年使用:0次
名校
解题方法
7 . 工业上常采用 溶液吸收工业尾气中的
溶液吸收工业尾气中的 和
和 ,其原理如下:
,其原理如下:
反应Ⅰ:
反应Ⅱ:
 溶液浓度越大黏稠度越高。控制其他条件不变,将
溶液浓度越大黏稠度越高。控制其他条件不变,将 和
和 体积比为
体积比为 、
、 的混合气体分别通过体积相同、浓度不同的
的混合气体分别通过体积相同、浓度不同的 溶液后,氮氧化物吸收率变化如图所示。下列说法
溶液后,氮氧化物吸收率变化如图所示。下列说法不正确 的是
 溶液吸收工业尾气中的
溶液吸收工业尾气中的 和
和 ,其原理如下:
,其原理如下:反应Ⅰ:

反应Ⅱ:

 溶液浓度越大黏稠度越高。控制其他条件不变,将
溶液浓度越大黏稠度越高。控制其他条件不变,将 和
和 体积比为
体积比为 、
、 的混合气体分别通过体积相同、浓度不同的
的混合气体分别通过体积相同、浓度不同的 溶液后,氮氧化物吸收率变化如图所示。下列说法
溶液后,氮氧化物吸收率变化如图所示。下列说法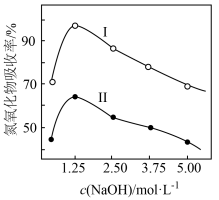
A.曲线Ⅰ表示体积比为 的混合气体吸收率的变化 的混合气体吸收率的变化 |
B.当 浓度高于 浓度高于 时,吸收率下降的原因可能是 时,吸收率下降的原因可能是 黏稠度过高,不利于氮氧化物气体的吸收 黏稠度过高,不利于氮氧化物气体的吸收 |
C.向体积比为 的 的 和 和 混合气体中通入少量 混合气体中通入少量 ,可提高氮氧化物的吸收率 ,可提高氮氧化物的吸收率 |
D.将 和 和 混合气体通入足量 混合气体通入足量 溶液中完全吸收,所得溶液中 溶液中完全吸收,所得溶液中 |
您最近一年使用:0次
2023-06-29更新
|
544次组卷
|
4卷引用:第四章单元测试卷
(已下线)第四章单元测试卷江苏省南通市2022-2023学年高一下学期期末质量监测化学试题湖南省长沙市雅礼中学2023-2024学年高二上学期入学考试化学试题(已下线)专题02 氮与社会可持续发展-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(江苏专用)
名校
8 . 氧化还原反应在生产、生活等领域有广泛的应用。
(1)铝热反应可用于焊接钢轨,其反应原理为: 。在该反应中
。在该反应中___________ 元素(填元素符号)的化合价升高,通过此反应的分析可知规律:氧化还原反应中元素化合价升高总数___________ (填“>”、“<”或“=”)元素化合价降低总数。
(2)汽车常装有安全气囊,当发生强烈碰撞时,瞬间引发以下反应: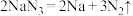 ,所产生的气体快速充满气囊,可以达到保护车内人员的目的。某安全气囊
,所产生的气体快速充满气囊,可以达到保护车内人员的目的。某安全气囊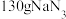 完全分解,反应中转移电子的物质的量为
完全分解,反应中转移电子的物质的量为___________  ,在标准状况下,气囊膨胀的体积约为
,在标准状况下,气囊膨胀的体积约为___________  。
。
(3)钠—钾合金(化学式为 )可在核反应堆中用作热交换液。合金与水反应原理为:
)可在核反应堆中用作热交换液。合金与水反应原理为: ,现将
,现将 加入
加入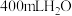 中充分反应,忽略溶液体积的变化。
中充分反应,忽略溶液体积的变化。
①反应生成 的质量为
的质量为___________ 。
②所得溶液中 的物质的量浓度为
的物质的量浓度为___________ 。
(1)铝热反应可用于焊接钢轨,其反应原理为:
 。在该反应中
。在该反应中(2)汽车常装有安全气囊,当发生强烈碰撞时,瞬间引发以下反应:
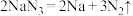 ,所产生的气体快速充满气囊,可以达到保护车内人员的目的。某安全气囊
,所产生的气体快速充满气囊,可以达到保护车内人员的目的。某安全气囊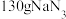 完全分解,反应中转移电子的物质的量为
完全分解,反应中转移电子的物质的量为 ,在标准状况下,气囊膨胀的体积约为
,在标准状况下,气囊膨胀的体积约为 。
。(3)钠—钾合金(化学式为
 )可在核反应堆中用作热交换液。合金与水反应原理为:
)可在核反应堆中用作热交换液。合金与水反应原理为: ,现将
,现将 加入
加入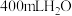 中充分反应,忽略溶液体积的变化。
中充分反应,忽略溶液体积的变化。①反应生成
 的质量为
的质量为②所得溶液中
 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
2023-06-16更新
|
204次组卷
|
3卷引用:合格考真题汇编5氧化还原反应
2023·上海·模拟预测
9 . 常温常压下,下列物质的物理量中前者是后者两倍的是
A.28 g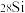 和28g 和28g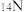 中所含的中子数 中所含的中子数 |
B.2.24 L 和2.24 L 和2.24 L 原子数 原子数 |
C.1mol 和2mol 和2mol 的密度 的密度 |
D.0.1mol·L  和0.1 mol·L 和0.1 mol·L  的 的 |
您最近一年使用:0次
解题方法
10 . 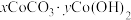 是制备高纯钴系列产品的中间物料,以高钴渣[主要成分为
是制备高纯钴系列产品的中间物料,以高钴渣[主要成分为 ,含
,含 以及
以及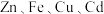 (镉)等的化合物]为原料回收
(镉)等的化合物]为原料回收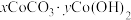 并利用副产物制备绿矾的工艺流程如下:
并利用副产物制备绿矾的工艺流程如下:

回答下列问题:
(1)“控电位浸出”时 与稀硫酸反应转化为
与稀硫酸反应转化为 ,同时有气体物质生成,写出该反应的化学方程式:
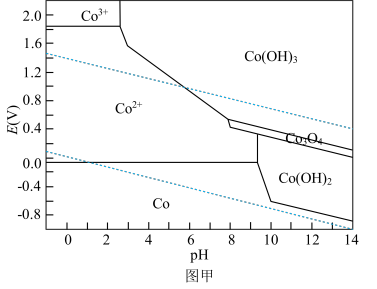
,同时有气体物质生成,写出该反应的化学方程式:__________ ;钴在溶液中的存在形式与电位E和 的关系如图甲所示,下列条件能实现“控电位浸出”时发生目标反应的是
的关系如图甲所示,下列条件能实现“控电位浸出”时发生目标反应的是__________ (填标号)。
A.
 B.
B.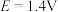

C.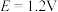
 D.
D.

(2)有关金属离子沉淀的相关 见下表:
见下表:
“中和除铁”时 的理论范围是
的理论范围是_________ ;试剂 为
为_________ (填化学式)。
(3)一定条件下,试剂B的用量对锌钴分离的影响如图乙所示。 的用量在
的用量在_________  时效果最好,理由是
时效果最好,理由是__________________ 。

(4)取所得产品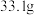 (忽略杂质的影响),在隔绝空气条件下高温充分煅烧,冷却后剩余固体的质量为
(忽略杂质的影响),在隔绝空气条件下高温充分煅烧,冷却后剩余固体的质量为 ,则产品
,则产品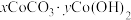 中
中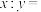
_________ 。据此计算结果写出“沉钴”的离子方程式:_________ 。
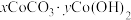 是制备高纯钴系列产品的中间物料,以高钴渣[主要成分为
是制备高纯钴系列产品的中间物料,以高钴渣[主要成分为 ,含
,含 以及
以及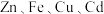 (镉)等的化合物]为原料回收
(镉)等的化合物]为原料回收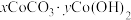 并利用副产物制备绿矾的工艺流程如下:
并利用副产物制备绿矾的工艺流程如下:
回答下列问题:
(1)“控电位浸出”时
 与稀硫酸反应转化为
与稀硫酸反应转化为 ,同时有气体物质生成,写出该反应的化学方程式:
,同时有气体物质生成,写出该反应的化学方程式: 的关系如图甲所示,下列条件能实现“控电位浸出”时发生目标反应的是
的关系如图甲所示,下列条件能实现“控电位浸出”时发生目标反应的是
A.
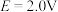
 B.
B.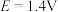

C.
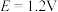
 D.
D.

(2)有关金属离子沉淀的相关
 见下表:
见下表:离子 |
|
|
|
|
|
开始沉淀时的 | 6.2 | 5.3 | 2.1 | 7.1 | 7.2 |
沉淀完全时的 | 8.2 | 6.7 | 3.2 | 9.3 | 9.4 |
 的理论范围是
的理论范围是 为
为(3)一定条件下,试剂B的用量对锌钴分离的影响如图乙所示。
 的用量在
的用量在 时效果最好,理由是
时效果最好,理由是
(4)取所得产品
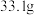 (忽略杂质的影响),在隔绝空气条件下高温充分煅烧,冷却后剩余固体的质量为
(忽略杂质的影响),在隔绝空气条件下高温充分煅烧,冷却后剩余固体的质量为 ,则产品
,则产品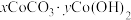 中
中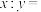
您最近一年使用:0次







