2024·吉林长春·三模
解题方法
1 . 丁香酚氧基乙酸不仅有抗病毒、抗菌性能,而且还有抑制脂质增加的功能。纯净的丁香酚氧基乙酸 为白色固体,可用丁香酚(
为白色固体,可用丁香酚( ,沸点:
,沸点: )为主要原料制得,其合成原理如下所示:
)为主要原料制得,其合成原理如下所示:
I.将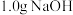 溶于
溶于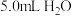 中,添加
中,添加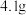 丁香酚,在
丁香酚,在 下搅拌,得到溶液甲。
下搅拌,得到溶液甲。
II.将 氯乙酸溶解在
氯乙酸溶解在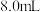 水中,缓慢添加
水中,缓慢添加 溶液使其呈碱性,得到溶液乙。
溶液使其呈碱性,得到溶液乙。
III.将溶液乙缓慢滴加到溶液甲中,在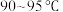 搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
IV.向溶液丙中加入碎冰,搅拌至黄色油状物变成淡黄色固体,过滤、洗涤。
V.向固体中加 ,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到
,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到 固体。
固体。
回答下列问题:___________ 。
(2)若步骤I中 加入过量,产生的后果是
加入过量,产生的后果是___________ (用化学方程式表示)。
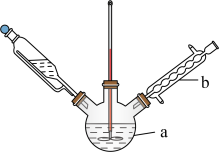
(3)某兴趣小组设计的反应装置如图所示(加热装置略去),仪器 的名称是
的名称是___________ ;某同学认为不需要仪器 ,他给出的理由是
,他给出的理由是___________ 。
(4)步骤IV中碎冰的作用为___________ 。
(5)步骤V分离提纯方法的名称是___________ 。
(6)本实验的产率为___________ (保留三位有效数字)。
 为白色固体,可用丁香酚(
为白色固体,可用丁香酚( ,沸点:
,沸点: )为主要原料制得,其合成原理如下所示:
)为主要原料制得,其合成原理如下所示:
I.将
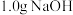 溶于
溶于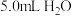 中,添加
中,添加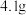 丁香酚,在
丁香酚,在 下搅拌,得到溶液甲。
下搅拌,得到溶液甲。II.将
 氯乙酸溶解在
氯乙酸溶解在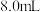 水中,缓慢添加
水中,缓慢添加 溶液使其呈碱性,得到溶液乙。
溶液使其呈碱性,得到溶液乙。III.将溶液乙缓慢滴加到溶液甲中,在
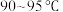 搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。IV.向溶液丙中加入碎冰,搅拌至黄色油状物变成淡黄色固体,过滤、洗涤。
V.向固体中加
 ,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到
,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到 固体。
固体。回答下列问题:
(2)若步骤I中
 加入过量,产生的后果是
加入过量,产生的后果是(3)某兴趣小组设计的反应装置如图所示(加热装置略去),仪器
 的名称是
的名称是 ,他给出的理由是
,他给出的理由是(4)步骤IV中碎冰的作用为
(5)步骤V分离提纯方法的名称是
(6)本实验的产率为
您最近一年使用:0次
23-24高三下·辽宁锦州·阶段练习
名校
2 . 已知:① ,②
,②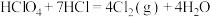 。
。 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是
 ,②
,②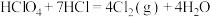 。
。 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是A.反应①中物质的氧化性: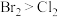 |
B.标准状况下,11.2L 参与反应时转移的电子数为5NA 参与反应时转移的电子数为5NA |
C.1L0.5  溶液含有的 溶液含有的 分子数为0.5 分子数为0.5 |
D.反应②生成28.4g 时,还原产物分子数为0.05 时,还原产物分子数为0.05 |
您最近一年使用:0次
2024-04-16更新
|
648次组卷
|
4卷引用:通关练01 化学基本概念再回归-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
(已下线)通关练01 化学基本概念再回归-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)辽宁省锦州市渤海大学附属高级中学2023-2024学年高三下学期3月摸底考试化学试题河北省邢台市五岳联盟2024届高三下学期模拟预测化学试题贵州省安顺市部分学校2024届高三下学期二模考试化学试题
2024·重庆·一模
3 . 已知反应: ,
, 为阿伏加德罗常数的值,若反应消耗了
为阿伏加德罗常数的值,若反应消耗了 粉(
粉( 足量)。下列说法正确的是
足量)。下列说法正确的是
 ,
, 为阿伏加德罗常数的值,若反应消耗了
为阿伏加德罗常数的值,若反应消耗了 粉(
粉( 足量)。下列说法正确的是
足量)。下列说法正确的是A.所得溶液中 数目为 数目为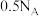 | B.收集到的 分子数为 分子数为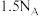 |
C.转移的电子数为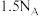 | D.生成的 含共价键数为 含共价键数为 |
您最近一年使用:0次
2024·山西太原·一模
名校
4 . 氯化亚铜化学式为CuCl,白色立方结晶或白色粉末,难溶于水,在潮湿的空气中易氧化,不溶于乙醇,常用作催化剂、杀菌剂、媒染剂、脱色剂等。
I.CuCl的制备
取25g CuSO4∙5H2O和6.43gNaCl并加少量水溶解,将溶液倒入如图所示的三颈烧瓶中,加热至50℃,向三颈烧瓶中缓慢滴加Na2SO3和Na2CO3的混合溶液,使其持续反应30min。待反应结束后将混合物静置一段时间,抽滤,沉淀依次用36%的乙酸、无水乙醇、无水乙醚洗涤多次,得白色固体,真空或者充氮气保存。___________ 。
(2)反应时使用NaCl浓溶液,主要目的是___________ 。
(3)三颈烧瓶中CuSO4、NaCl、Na2SO3反应生成CuCl的离子方程式为___________ ;缓慢滴加Na2SO3和Na2CO3的混合溶液的主要原因是___________ 。
(4)沉淀用无水乙醇洗涤的目的是___________ 。
II.CuCl样品纯度的测定
准确称取CuCl样品0.25g,将其置于足量FeCl3溶液中,待固体完全溶解后,加水50mL和邻菲啰啉指示剂2滴,立即用amol∙L-1 Ce(SO4)2标准溶液滴定至绿色出现且30s不褪色,即为终点,重复2~3次,平均消耗Ce(SO4)2标准溶液bmL(已知: ,
, )
)
(5)滴定时应将Ce(SO4)2标准溶液加入___________ (填“酸式滴定管”或“碱式滴定管”)中;该样品中CuCl的质量分数为___________ ×100%。(用含a、b的代数式表示,列出计算式即可)
(6)下列操作可能会导致样品纯度测量结果偏低的是___________。(填标号)
I.CuCl的制备
取25g CuSO4∙5H2O和6.43gNaCl并加少量水溶解,将溶液倒入如图所示的三颈烧瓶中,加热至50℃,向三颈烧瓶中缓慢滴加Na2SO3和Na2CO3的混合溶液,使其持续反应30min。待反应结束后将混合物静置一段时间,抽滤,沉淀依次用36%的乙酸、无水乙醇、无水乙醚洗涤多次,得白色固体,真空或者充氮气保存。

(2)反应时使用NaCl浓溶液,主要目的是
(3)三颈烧瓶中CuSO4、NaCl、Na2SO3反应生成CuCl的离子方程式为
(4)沉淀用无水乙醇洗涤的目的是
II.CuCl样品纯度的测定
准确称取CuCl样品0.25g,将其置于足量FeCl3溶液中,待固体完全溶解后,加水50mL和邻菲啰啉指示剂2滴,立即用amol∙L-1 Ce(SO4)2标准溶液滴定至绿色出现且30s不褪色,即为终点,重复2~3次,平均消耗Ce(SO4)2标准溶液bmL(已知:
 ,
, )
)(5)滴定时应将Ce(SO4)2标准溶液加入
(6)下列操作可能会导致样品纯度测量结果偏低的是___________。(填标号)
| A.样品在空气中放置时间过长 |
| B.盛装Ce(SO4)2标准溶液的滴定管未用标准溶液润洗 |
| C.锥形瓶中装待测液前未干燥 |
| D.滴定管内部滴定前无气泡,滴定后有气泡 |
您最近一年使用:0次
2024-04-02更新
|
595次组卷
|
4卷引用:题型9 实验综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)
(已下线)题型9 实验综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)压轴题12?化学实验综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)山西省太原市2024届高三一模理综试卷-高中化学河南省郑州市宇华实验学校2024届高三下学期第三次模拟考试化学试题
2024·辽宁鞍山·二模
解题方法
5 . 25℃时,利用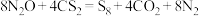 (反应Ⅰ)获得:
(反应Ⅰ)获得: (
( ),同时将生成的
),同时将生成的 溶于水形成
溶于水形成 的溶液Ⅱ,设
的溶液Ⅱ,设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A.反应Ⅰ中转移电子的数目为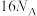 | B.反应Ⅰ中形成 键的数目为 键的数目为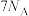 |
C.反应Ⅰ产物中 电子的数目为 电子的数目为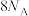 | D.溶液Ⅱ中含 的数目为 的数目为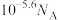 |
您最近一年使用:0次
2024·甘肃兰州·一模
解题方法
6 . 磷烷(PH3)是集成电路、太阳能电池等电子工业生产的原材料。工业上制备PH3的反应原理为: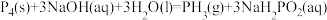 。NA表示阿伏加德罗常数,下列说法正确的是
。NA表示阿伏加德罗常数,下列说法正确的是
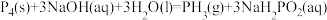 。NA表示阿伏加德罗常数,下列说法正确的是
。NA表示阿伏加德罗常数,下列说法正确的是| A.常温下pH=13的NaOH溶液中水电离出的c(OH-)=0.1mol/L |
B.0.1mol/L的NaH2PO2溶液中 的数目小于0.1NA 的数目小于0.1NA |
| C.3.1g白磷中共价键的数目为0.6NA |
D.每转移3个电子,生成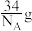 磷烷 磷烷 |
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
7 . 热重分析法测定结晶的含量:氮气气氛中以升温速率10℃/min测定某化合物(K2[Cu(C2O4)2]·nH2O)的热失重曲线,如图所示晶体在107℃失重10.2%,失去全部结晶水。
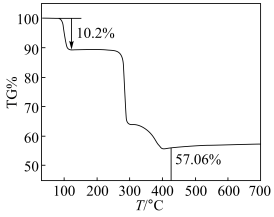
(1)通过热失重分析,蓝色晶体的化学式中n=___________ ,经过实验测定后,蓝色晶体的化学式为___________ 。
(2)加热400℃之后,剩余物质的质量不再发生变化。为探究剩余固体的成分,冷却后取少量固体于试管中,加水溶解有红色不溶物,过滤后向滤液中加入稀盐酸产生无色无味气体。则剩余固体的成分为___________ 。

(1)通过热失重分析,蓝色晶体的化学式中n=
(2)加热400℃之后,剩余物质的质量不再发生变化。为探究剩余固体的成分,冷却后取少量固体于试管中,加水溶解有红色不溶物,过滤后向滤液中加入稀盐酸产生无色无味气体。则剩余固体的成分为
您最近一年使用:0次
2024高三·全国·专题练习
8 . 用热重分析法测定碱式碳酸钴晶体[Co5(CO3)2(OH)6·xH2O]所含结晶水数,将纯净碱式碳酸钴晶体在空气中加热,加热过程中钴元素无损失,失重率与温度的关系如图所示。已知20~190℃为失去结晶水阶段,则 的值为式为
的值为式为___________ ,在 点时剩余固体为氧化物,其化学式为
点时剩余固体为氧化物,其化学式为___________ 。
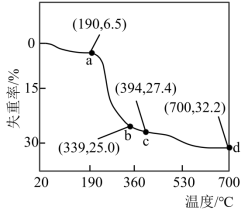
 的值为式为
的值为式为 点时剩余固体为氧化物,其化学式为
点时剩余固体为氧化物,其化学式为
您最近一年使用:0次
2024·吉林·模拟预测
9 . 电解重水( )是制取氘气(
)是制取氘气( )的一种方法。设
)的一种方法。设 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是
 )是制取氘气(
)是制取氘气( )的一种方法。设
)的一种方法。设 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是A. 分子间存在氢键 分子间存在氢键 | B. 的熔、沸点比 的熔、沸点比 高 高 |
C.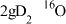 含中子数目为 含中子数目为 | D.制取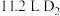 转移的电子数目为 转移的电子数目为 |
您最近一年使用:0次
23-24高三上·河南驻马店·期末
名校
解题方法
10 . 碱式硫酸镁晶须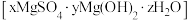 是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含
是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含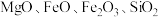 等)为原料制备碱式硫酸镁晶须的流程如图:
等)为原料制备碱式硫酸镁晶须的流程如图:
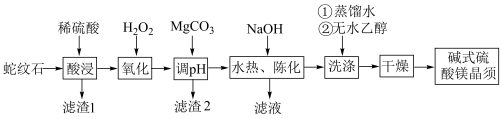
回答下列问题:
(1)酸浸时须将蛇纹石粉碎,其目的是_______ 。
(2)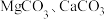 在高温下均易分解,但
在高温下均易分解,但 的分解温度比
的分解温度比 的低,试从结构角度解释其原因:
的低,试从结构角度解释其原因:_______ 。
(3)洗涤步骤中用无水乙醇洗涤的目的是_______ 。
(4)氧化的目的是_______ (用离子方程式表示),为检验溶液中的离子是否完全被氧化,可使用的试剂为_______ (填化学式)。
(5)将碱式硫酸镁晶须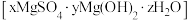 进行热重分析测定其化学式,
进行热重分析测定其化学式, 热重曲线[样品的固体残留率(
热重曲线[样品的固体残留率( )随温度变化]
)随温度变化] (微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为
(微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为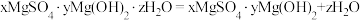 ,第三次失重后获得的晶体的晶胞结构如图2所示。
,第三次失重后获得的晶体的晶胞结构如图2所示。
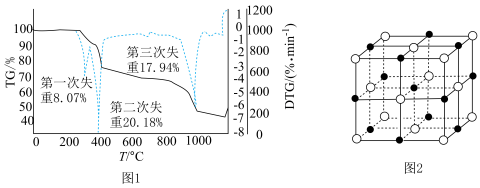
①x、y、z为最简整数比,则碱式硫酸镁晶须的化学式为_______ ;第二次失重发生反应的化学方程式为_______ 。
②图2中的晶胞参数为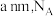 为阿伏加德罗常数的值,则晶胞中白球的配位数为
为阿伏加德罗常数的值,则晶胞中白球的配位数为_______ ,该晶体的密度为_______  。
。
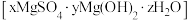 是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含
是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含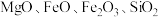 等)为原料制备碱式硫酸镁晶须的流程如图:
等)为原料制备碱式硫酸镁晶须的流程如图:
回答下列问题:
(1)酸浸时须将蛇纹石粉碎,其目的是
(2)
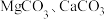 在高温下均易分解,但
在高温下均易分解,但 的分解温度比
的分解温度比 的低,试从结构角度解释其原因:
的低,试从结构角度解释其原因:(3)洗涤步骤中用无水乙醇洗涤的目的是
(4)氧化的目的是
(5)将碱式硫酸镁晶须
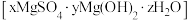 进行热重分析测定其化学式,
进行热重分析测定其化学式, 热重曲线[样品的固体残留率(
热重曲线[样品的固体残留率( )随温度变化]
)随温度变化] (微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为
(微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为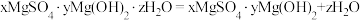 ,第三次失重后获得的晶体的晶胞结构如图2所示。
,第三次失重后获得的晶体的晶胞结构如图2所示。
①x、y、z为最简整数比,则碱式硫酸镁晶须的化学式为
②图2中的晶胞参数为
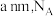 为阿伏加德罗常数的值,则晶胞中白球的配位数为
为阿伏加德罗常数的值,则晶胞中白球的配位数为 。
。
您最近一年使用:0次
2024-01-22更新
|
261次组卷
|
4卷引用:T28-工业流程题



