名校
解题方法
1 . 现有以下几种物质:①NaCl ②Ba(OH)2 ③CH4 ④醋酸(CH3COOH) ⑤NaHSO4 ⑥CO2 ⑦氨水 ⑧氢氧化铁胶体 ⑨FeCl3溶液。
回答下列问题:
(1)上述物质中属于电解质的是________ (填编号)。
(2)标准状况下,4.8g③与________ L⑥含有相同数目的原子。
(3)⑤溶于水的电离方程式为________ 。
(4)下列关于⑧和⑨的说法正确的是________ (填标号)。
A.⑧能产生丁达尔效应,而⑨不能
B.分散质微粒都可以通过滤纸
C.加入硫酸都会先产生沉淀,后溶解
D.将⑦滴加到⑨中可以制备⑧
(5)将少量⑥通入②溶液中,反应的离子方程式为________ 。
回答下列问题:
(1)上述物质中属于电解质的是
(2)标准状况下,4.8g③与
(3)⑤溶于水的电离方程式为
(4)下列关于⑧和⑨的说法正确的是
A.⑧能产生丁达尔效应,而⑨不能
B.分散质微粒都可以通过滤纸
C.加入硫酸都会先产生沉淀,后溶解
D.将⑦滴加到⑨中可以制备⑧
(5)将少量⑥通入②溶液中,反应的离子方程式为
您最近一年使用:0次
2020-11-17更新
|
86次组卷
|
2卷引用:山东省日照市莒县2020-2021学年高一11月模块考试化学试题
2 . 设NA代表阿伏加 德罗常数的数值,判定下列说法是否正确
1.22.4L(标准状况)氩气含有的质子数为18NA__________
2.标准状况下,11.2 LCH4和C2H4混合物中含氢原子数目为2NA__________
3.标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA__________
4.1mol的CO和N2混合气体中含有的质子数为14NA__________
5.标准状况下,5.6LCO2气体中含有的氧原子数目为0.5NA__________
6.1.6g由O2和O3组成的混合物中含有的O原子数目为0.1NA__________
7.常温常压下,8g O2含有的电子数为4NA__________
8.常温常压下,22.4LNO2和CO2的混合气体中O原子数目为2 NA__________
9.标准状况下,22.4LCCl4中含有的CCl4分子数为NA__________
10.常温常压下,18 g H2O中含有的原子总数为3NA__________
11.标准状况下,11.2LCH3CH2OH中含有的分子数目为0.5NA__________
12.常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA__________
1.22.4L(标准状况)氩气含有的质子数为18NA
2.标准状况下,11.2 LCH4和C2H4混合物中含氢原子数目为2NA
3.标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
4.1mol的CO和N2混合气体中含有的质子数为14NA
5.标准状况下,5.6LCO2气体中含有的氧原子数目为0.5NA
6.1.6g由O2和O3组成的混合物中含有的O原子数目为0.1NA
7.常温常压下,8g O2含有的电子数为4NA
8.常温常压下,22.4LNO2和CO2的混合气体中O原子数目为2 NA
9.标准状况下,22.4LCCl4中含有的CCl4分子数为NA
10.常温常压下,18 g H2O中含有的原子总数为3NA
11.标准状况下,11.2LCH3CH2OH中含有的分子数目为0.5NA
12.常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA
您最近一年使用:0次
名校
3 . 完成下列各题:
(1)现有下列9种物质:①氯气;②二氧化硫;③氢氧化铁胶体;④铁;⑤氯化钡;⑥氢氧化钾;⑦氯化铁溶液;⑧酒精(C2H5OH);⑨氧化钙。
用相应化学式填写下列空白:属于酸性氧化物的有____ ,属于电解质的是______ ,属于非电解质的_______ 。(用相应化学式填空)
下列关于③和⑦的说法正确的是____ (填字母序号)。
a.都不稳定,密封静置会产生沉淀 b.③能产生丁达尔效应,而⑦不能
c.分散质粒子都可以通过滤纸 d.加入盐酸都会先产生沉淀,后溶解
(2)标准状况下,2.24 L Cl2的质量为__________ ;有__________ 个氯原子。
(3)10.8g R2O5中氧原子的数目为3.01×1023, 则元素R的相对原子质量为________ ;R元素名称是_______ 。
(4)如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(设NA为阿伏加 德罗常数)______________ 。
(5)由CH4和O2的组成的混和气体,在标况下的密度是H2的14.5倍。则该混合气体中CH4和O2的体积比为_______ 。
(6)物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液体积比为5∶3∶2时,三种溶液中c(Cl−)之比为____________ 。
(1)现有下列9种物质:①氯气;②二氧化硫;③氢氧化铁胶体;④铁;⑤氯化钡;⑥氢氧化钾;⑦氯化铁溶液;⑧酒精(C2H5OH);⑨氧化钙。
用相应化学式填写下列空白:属于酸性氧化物的有
下列关于③和⑦的说法正确的是
a.都不稳定,密封静置会产生沉淀 b.③能产生丁达尔效应,而⑦不能
c.分散质粒子都可以通过滤纸 d.加入盐酸都会先产生沉淀,后溶解
(2)标准状况下,2.24 L Cl2的质量为
(3)10.8g R2O5中氧原子的数目为3.01×1023, 则元素R的相对原子质量为
(4)如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(设NA为阿伏加 德罗常数)
(5)由CH4和O2的组成的混和气体,在标况下的密度是H2的14.5倍。则该混合气体中CH4和O2的体积比为
(6)物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液体积比为5∶3∶2时,三种溶液中c(Cl−)之比为
您最近一年使用:0次
4 . (1)0.5molCH4含_________ 个电子。
(2)下列物质既能导电,又属于电解质的是_______ 。
A NaCl溶液 B铁丝 C稀硫酸 D熔融的氢氧化钠 E 盐酸 F 硫酸
(3)同温同压下,甲容器中HCl气体和乙容器中的NH3所含原子个数相等,则甲乙两容器的体积之比为________ 。
(4)现配制500ml 0.3mol/L稀硫酸溶液,需用量筒量取质量分数为49%,密度为1.5g/cm3的浓硫酸_________ ml。
(5)①20℃、101kPa下,1g氢气和14g氮气的体积相同;
②常温常压下,16g氧气和臭氧的混合气体中含有的质子数为8NA
③0.1L 0.5mol/LCH3CH2OH溶液中含有氢原子数为0.3NA
④常温常压下,28gCO的体积大于22.4L;
⑤分子总数相等的NO2和CO2,所含氧原子数均为2NA。
以上说法正确的是_________________ 。
(2)下列物质既能导电,又属于电解质的是
A NaCl溶液 B铁丝 C稀硫酸 D熔融的氢氧化钠 E 盐酸 F 硫酸
(3)同温同压下,甲容器中HCl气体和乙容器中的NH3所含原子个数相等,则甲乙两容器的体积之比为
(4)现配制500ml 0.3mol/L稀硫酸溶液,需用量筒量取质量分数为49%,密度为1.5g/cm3的浓硫酸
(5)①20℃、101kPa下,1g氢气和14g氮气的体积相同;
②常温常压下,16g氧气和臭氧的混合气体中含有的质子数为8NA
③0.1L 0.5mol/LCH3CH2OH溶液中含有氢原子数为0.3NA
④常温常压下,28gCO的体积大于22.4L;
⑤分子总数相等的NO2和CO2,所含氧原子数均为2NA。
以上说法正确的是
您最近一年使用:0次
解题方法
5 . 国务院强调,“南水北调”工程必须坚持节水、治污和生态环境保护与工程建设相协调,以水资源合理配置为主线,把节水、治污和生态环境保护与调水作为一个完整的系统来分析的原则。在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患。经检测,某工厂废液中含有大量的 、
、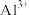 、
、 、
、 。试分析并回答下列问题:
。试分析并回答下列问题:
(1)该废液中可能大量存在的阴离子是________ (填序号)。
A B
B  C
C  D
D 
(2)为了回收废液中的金属银,某同学设计了如图所示的实验方案。若按照该方案获得金属银108g,在保证不污染环境且 循环利用的情况下,可得出理论上应提供标准状况下的
循环利用的情况下,可得出理论上应提供标准状况下的
________ L。

(3)为了实现(2)中氯气的循环利用,有人设想以氢气和氯气为原料利用原电池原理直接制盐酸,假设这种想法可行,下列说法肯定错误的是________ (填序号)。
A 两极材料都用石墨,用稀盐酸作电解质溶液
B 通入氢气的电极为原电池的正极
C 电解质溶液中的阳离子向通入氯气的电极移动
D 通入氯气的电极的电极反应式为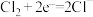
 、
、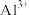 、
、 、
、 。试分析并回答下列问题:
。试分析并回答下列问题:(1)该废液中可能大量存在的阴离子是
A
 B
B  C
C  D
D 
(2)为了回收废液中的金属银,某同学设计了如图所示的实验方案。若按照该方案获得金属银108g,在保证不污染环境且
 循环利用的情况下,可得出理论上应提供标准状况下的
循环利用的情况下,可得出理论上应提供标准状况下的

(3)为了实现(2)中氯气的循环利用,有人设想以氢气和氯气为原料利用原电池原理直接制盐酸,假设这种想法可行,下列说法肯定错误的是
A 两极材料都用石墨,用稀盐酸作电解质溶液
B 通入氢气的电极为原电池的正极
C 电解质溶液中的阳离子向通入氯气的电极移动
D 通入氯气的电极的电极反应式为
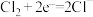
您最近一年使用:0次
6 . 下列说法是否正确
1.22.4LO2中一定含有6.02×1023个氧分子。_________
2.将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol/L。_________
3.18gH2O在标准状况下的体积是22.4L。_________
4.在标准状况时,20mLNH3与60mLO2所含的分子个数比为1:3。_________
1.22.4LO2中一定含有6.02×1023个氧分子。
2.将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol/L。
3.18gH2O在标准状况下的体积是22.4L。
4.在标准状况时,20mLNH3与60mLO2所含的分子个数比为1:3。
您最近一年使用:0次
19-20高二·浙江·期末
7 . 化合物甲(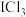 ,
, ),性质类似卤素单质。将2.335g甲加热至完全分解,生成0.01mol液体乙和224mL(标准状况下)黄绿色的单质气体丙。请回答:
),性质类似卤素单质。将2.335g甲加热至完全分解,生成0.01mol液体乙和224mL(标准状况下)黄绿色的单质气体丙。请回答:
(1)甲加热至完全分解的化学方程式是________ 。
(2)乙与水反应的离子方程式是_________ 。
(3)下列有关化合物甲和乙的说法正确的是________ 。(填字母)
A.甲不能与可燃物、碱类一起储运
B.一定条件下乙能与乙烯或苯反应
C.甲分子中各原子均达到8电子稳定结构
D.粗碘中常混有乙,可直接用升华法分离提纯碘
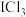 ,
, ),性质类似卤素单质。将2.335g甲加热至完全分解,生成0.01mol液体乙和224mL(标准状况下)黄绿色的单质气体丙。请回答:
),性质类似卤素单质。将2.335g甲加热至完全分解,生成0.01mol液体乙和224mL(标准状况下)黄绿色的单质气体丙。请回答:(1)甲加热至完全分解的化学方程式是
(2)乙与水反应的离子方程式是
(3)下列有关化合物甲和乙的说法正确的是
A.甲不能与可燃物、碱类一起储运
B.一定条件下乙能与乙烯或苯反应
C.甲分子中各原子均达到8电子稳定结构
D.粗碘中常混有乙,可直接用升华法分离提纯碘
您最近一年使用:0次
解题方法
8 . (1)“民以食为天,食以安为先”。近年来屡屡发生的 劣质奶粉、苏丹红、多宝鱼等食品安全事件严重威胁消费者的健康和生命安全。下列有关蛋白质的说法正确的是____________ (填序号)。
A.蛋白质是重要的营养物质,也是提供人体所需能最的主要物质
B.蛋白质在淀粉酶的作用下,可水解成葡萄糖等
C.蛋白质水解的最终产物是氨基酸
(2)奶粉中蛋白质含量的国家标准是:每100 g婴幼儿奶粉中含蛋白质12〜25 g。其测定方法是:奶粉经水解产生氨基酸,再经过其他反应生成氨, 由氨的量计算出氮的量,再由氮的量求出蛋白质的含量(蛋白质含氮量按16%计算)。某市质检局取100 g市场中的某个品牌的奶粉样品进行检验。该样品进行反应后生成的 和 7.5 g 19. 6%的稀硫酸恰好完全反应,通过计算可判断出这种奶粉
和 7.5 g 19. 6%的稀硫酸恰好完全反应,通过计算可判断出这种奶粉__________ (填“属于”或“不属于”)合格奶粉。
A.蛋白质是重要的营养物质,也是提供人体所需能最的主要物质
B.蛋白质在淀粉酶的作用下,可水解成葡萄糖等
C.蛋白质水解的最终产物是氨基酸
(2)奶粉中蛋白质含量的国家标准是:每100 g婴幼儿奶粉中含蛋白质12〜25 g。其测定方法是:奶粉经水解产生氨基酸,再经过其他反应生成氨, 由氨的量计算出氮的量,再由氮的量求出蛋白质的含量(蛋白质含氮量按16%计算)。某市质检局取100 g市场中的某个品牌的奶粉样品进行检验。该样品进行反应后生成的
 和 7.5 g 19. 6%的稀硫酸恰好完全反应,通过计算可判断出这种奶粉
和 7.5 g 19. 6%的稀硫酸恰好完全反应,通过计算可判断出这种奶粉
您最近一年使用:0次
2020-04-09更新
|
306次组卷
|
5卷引用:课时3 糖类、油脂和蛋白质——A学习区 夯实基础(鲁科版(2019)第二册)
课时3 糖类、油脂和蛋白质——A学习区 夯实基础(鲁科版(2019)第二册)课时2 糖类、油脂、蛋白质在生产、生活中的应用——A学习区 夯实基础(人教版必修2)课时2 蛋白质——A学习区 夯实基础(人教版(2019)第二册)必修第二册RJ第7章第四节 基本营养物质 课时2 蛋白质(已下线)考点41 蛋白质-备战2023年高考化学一轮复习考点帮(全国通用)
解题方法
9 . 用NA表示阿伏加德罗常数,判断下列说法是否正确。
1.50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA。(_______)
2.常温下,密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA。(_______)
3.常温下,56 g铁片投入足量浓H2SO4中生成NA个SO2分子。(_______)
4.一定条件下,用 1.5 mol H2和0.5 mol N2,充分反应后可得到NH3分子数为NA。(_______)
5.标准状况下,将22.4 L Cl2通入足量水中充分反应,转移电子数小于NA。(_______)
1.50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA。(_______)
2.常温下,密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA。(_______)
3.常温下,56 g铁片投入足量浓H2SO4中生成NA个SO2分子。(_______)
4.一定条件下,用 1.5 mol H2和0.5 mol N2,充分反应后可得到NH3分子数为NA。(_______)
5.标准状况下,将22.4 L Cl2通入足量水中充分反应,转移电子数小于NA。(_______)
您最近一年使用:0次
10 . 用NA表示阿伏加德罗常数,判断下列说法是否正确。
1.5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA。(_______)
2.0.1 mol Zn与含0.1 mol HCl的盐酸充分反应,转移的电子数目为0.2NA。(_______)
3.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA。(_______)
4.1 mol Na2O2与足量CO2充分反应转移的电子数为2NA。(_______)
5.向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移电子的数目不小于3NA。(_______)
6.1 mol Cl2参加反应转移电子数一定为2NA。(_______)
7.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数小于2NA。(_______)
8.0.3 mol NO2与足量的水反应转移电子数目为0.2NA。(_______)
1.5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA。(_______)
2.0.1 mol Zn与含0.1 mol HCl的盐酸充分反应,转移的电子数目为0.2NA。(_______)
3.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA。(_______)
4.1 mol Na2O2与足量CO2充分反应转移的电子数为2NA。(_______)
5.向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移电子的数目不小于3NA。(_______)
6.1 mol Cl2参加反应转移电子数一定为2NA。(_______)
7.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数小于2NA。(_______)
8.0.3 mol NO2与足量的水反应转移电子数目为0.2NA。(_______)
您最近一年使用:0次



