名校
解题方法
1 . 硫是重要的非金属元素,也是人类较早认识的化学元素之一。人们对硫元素的利用,其本质就是通过各种化学反应,实现含硫元素的物质之间的转化。
(1)硫可以形成分子式为 、
、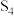 、
、 、
、 的单质,其中
的单质,其中 的分子球棍模型如图所示。下列有关说法正确的是_______。
的分子球棍模型如图所示。下列有关说法正确的是_______。
(2)将 气体通入
气体通入 溶液中,没有看到明显现象,再遇入一种气体(或加入一种物质)后,可产生一种沉淀,该气体(或物质)不可能是_______。
溶液中,没有看到明显现象,再遇入一种气体(或加入一种物质)后,可产生一种沉淀,该气体(或物质)不可能是_______。
(3)用如图所示实验装置(部分夹持仪器已略去)探究铜丝与过量浓硫酸的反应。
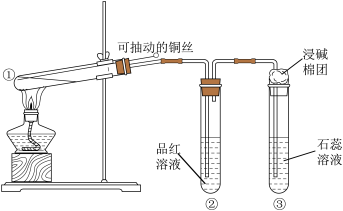
下列实验或说法不合理的是_______。
(4)工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程式是_______ 。不采用铜跟浓硫酸反应来制取硫酸铜的原因是_______ 。
(5)在 溶液中滴加少量
溶液中滴加少量 溶液,发生下列反应。配平反应方程式并用单线桥标出电子转移的方向和数目
溶液,发生下列反应。配平反应方程式并用单线桥标出电子转移的方向和数目_______ 。
_______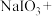 _______
_______ _______
_______ _______
_______ _______
_______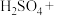 _______
_______
(6)中华人民共和国国家标准(G2762022)规定葡萄酒中 最大使用量为0.25 g⋅L-1,取300.00 mL葡萄酒,通过适当的方法使所含
最大使用量为0.25 g⋅L-1,取300.00 mL葡萄酒,通过适当的方法使所含 全部逸出并用
全部逸出并用 将其全部氧化为
将其全部氧化为 ,消耗浓度为0.0900 mol•L-1NaOH标准溶液25mL,该葡萄酒中
,消耗浓度为0.0900 mol•L-1NaOH标准溶液25mL,该葡萄酒中 含量为
含量为_______ g·L-1。
(7)同学们继续设计实验探究亚硫酸与次氯酸的酸性强弱:甲同学查阅资料得知 为难溶于水的白色沉淀,因此设计了实验方案为:将
为难溶于水的白色沉淀,因此设计了实验方案为:将 通入漂白粉溶液中,若观察到有白色沉淀生成,说明发生反应
通入漂白粉溶液中,若观察到有白色沉淀生成,说明发生反应
 ,则证明亚硫酸性强于次氯酸。乙同学分为甲同学方案的反应原理是错误的,理由是
,则证明亚硫酸性强于次氯酸。乙同学分为甲同学方案的反应原理是错误的,理由是_______ 。
(1)硫可以形成分子式为
 、
、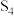 、
、 、
、 的单质,其中
的单质,其中 的分子球棍模型如图所示。下列有关说法正确的是_______。
的分子球棍模型如图所示。下列有关说法正确的是_______。
A.1 mol  单质中含有的S—S键个数为 单质中含有的S—S键个数为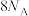 |
B. 、 、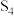 、 、 、 、 互为同位素 互为同位素 |
C.硫的单质在足量的空气中完全燃烧可生成 |
D. 的摩尔质量为32 g/mol 的摩尔质量为32 g/mol |
 气体通入
气体通入 溶液中,没有看到明显现象,再遇入一种气体(或加入一种物质)后,可产生一种沉淀,该气体(或物质)不可能是_______。
溶液中,没有看到明显现象,再遇入一种气体(或加入一种物质)后,可产生一种沉淀,该气体(或物质)不可能是_______。A. | B. | C. | D. |

下列实验或说法不合理的是_______。
A.上下移动①中铜丝可控制 的量 的量 |
B.②中品红溶液是验证 的生成 的生成 |
| C.③中石蕊溶液先变红后褪色 |
D.为确认 生成,向①中加水,观察颜色 生成,向①中加水,观察颜色 |
(5)在
 溶液中滴加少量
溶液中滴加少量 溶液,发生下列反应。配平反应方程式并用单线桥标出电子转移的方向和数目
溶液,发生下列反应。配平反应方程式并用单线桥标出电子转移的方向和数目_______
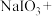 _______
_______ _______
_______ _______
_______ _______
_______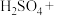 _______
_______
(6)中华人民共和国国家标准(G2762022)规定葡萄酒中
 最大使用量为0.25 g⋅L-1,取300.00 mL葡萄酒,通过适当的方法使所含
最大使用量为0.25 g⋅L-1,取300.00 mL葡萄酒,通过适当的方法使所含 全部逸出并用
全部逸出并用 将其全部氧化为
将其全部氧化为 ,消耗浓度为0.0900 mol•L-1NaOH标准溶液25mL,该葡萄酒中
,消耗浓度为0.0900 mol•L-1NaOH标准溶液25mL,该葡萄酒中 含量为
含量为(7)同学们继续设计实验探究亚硫酸与次氯酸的酸性强弱:甲同学查阅资料得知
 为难溶于水的白色沉淀,因此设计了实验方案为:将
为难溶于水的白色沉淀,因此设计了实验方案为:将 通入漂白粉溶液中,若观察到有白色沉淀生成,说明发生反应
通入漂白粉溶液中,若观察到有白色沉淀生成,说明发生反应
 ,则证明亚硫酸性强于次氯酸。乙同学分为甲同学方案的反应原理是错误的,理由是
,则证明亚硫酸性强于次氯酸。乙同学分为甲同学方案的反应原理是错误的,理由是
您最近一年使用:0次
名校
解题方法
2 . 我国化学家侯德榜发明了联合制碱法,为世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(部分物质已略去)。
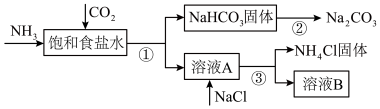
(1)饱和食盐水中通二氧化碳和氨气的化学方程式是_______
(2)下列说法中合理的是_______(填标号)。
(3)一场突如其来的新冠肺炎疫情,给人们的生活带来了巨大的冲击,在疫情期间外出需戴好口罩,返家后立即杀菌消毒。双氧水和84消毒液是日常生活常用的消毒剂,二氧化氯 气体是一种常用高效的自来水消毒剂。
气体是一种常用高效的自来水消毒剂。
①某同学设计如下实验研究 的性质,能证明
的性质,能证明 有还原性的实验是
有还原性的实验是_______ (填序号)
②某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是 与
与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:
促进藻类快速生长。该反应说明氧化性:
_______  (填“>”或“<”);当有
(填“>”或“<”);当有 生成时,转移电子的物质的量为
生成时,转移电子的物质的量为_______ mol。
③ 和浓盐酸在一定温度下反应会生成
和浓盐酸在一定温度下反应会生成 和
和 ,该反应的离子方程式
,该反应的离子方程式_______ ,将 通入到硫化氢溶液中,然后加入少量的稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成,写出二氧化氯与硫化氢溶液反应的化学方程式
通入到硫化氢溶液中,然后加入少量的稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成,写出二氧化氯与硫化氢溶液反应的化学方程式_______ 。

(1)饱和食盐水中通二氧化碳和氨气的化学方程式是
(2)下列说法中合理的是_______(填标号)。
A.副产物 可用作氮肥 可用作氮肥 |
B.溶液B中的主要离子是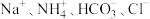 |
C.制碱流程中可回收并循环利用的物质只有碳酸氢钠分解产生的 |
| D.饱和食盐水中应该先通二氧化碳至饱和,再通入氨气至饱和 |
 气体是一种常用高效的自来水消毒剂。
气体是一种常用高效的自来水消毒剂。①某同学设计如下实验研究
 的性质,能证明
的性质,能证明 有还原性的实验是
有还原性的实验是| 序号 | 实验 | 实验现象 |
| 1 | 向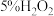 溶液中滴加酸性 溶液中滴加酸性 溶液 溶液 | a.溶液紫色裉去;b.有大量气泡产生 |
| 2 | 向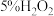 溶液中滴加淀粉碘化钾溶液 溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
 与
与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:
促进藻类快速生长。该反应说明氧化性:
 (填“>”或“<”);当有
(填“>”或“<”);当有 生成时,转移电子的物质的量为
生成时,转移电子的物质的量为③
 和浓盐酸在一定温度下反应会生成
和浓盐酸在一定温度下反应会生成 和
和 ,该反应的离子方程式
,该反应的离子方程式 通入到硫化氢溶液中,然后加入少量的稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成,写出二氧化氯与硫化氢溶液反应的化学方程式
通入到硫化氢溶液中,然后加入少量的稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成,写出二氧化氯与硫化氢溶液反应的化学方程式
您最近一年使用:0次
2023-01-07更新
|
481次组卷
|
3卷引用:辽宁省沈阳市回民中学2022-2023学年高一上学期期末线上考试化学试题
解题方法
3 . 化学对环境和人类生活都会带来影响。
(1)燃煤产生的二氧化硫在气溶胶表界面可被燃煤时产生的锰催化,快速生成硫酸盐加重空气中PM2.5污染。下列措施不能减少燃煤对大气造成污染的是_______ 。
①安装除尘脱氨脱硫设备 ②应用煤炭洗选加工技术 ③将煤炭气化转化为可燃性气体
④燃煤工厂烟囱加高 ⑤开发利用氢能、风能等清洁能源
(2)下列关于胶体的说法正确的是_______ (填标号)。
a.胶体与溶液的本质区别是丁达尔现象
b.按照分散剂的不同可将胶体分为液溶胶、气溶胶和固溶胶
c.已知土壤胶体中的胶粒带负电,施用含氮总量相同的 与
与 ,肥效相同
,肥效相同
(3)明胶是水溶性蛋白质混合物,溶于水可形成胶体。由工业明胶制成的胶囊往往含有超标的重金属铬( ),从而对人体造成伤害。已知
),从而对人体造成伤害。已知 是一种酸根离子,则
是一种酸根离子,则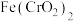 属于
属于_______ (填“酸”“碱”“盐”或“氧化物”),含有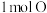 原子的
原子的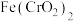 质量为
质量为_______  。
。
(4)将少量混有 的明胶胶体装入半透膜内浸入盛蒸馏水的烧杯中,证明
的明胶胶体装入半透膜内浸入盛蒸馏水的烧杯中,证明 能透过半透膜的实验操作是:取烧杯中的少量液体,向其中加入稀盐酸,再加入
能透过半透膜的实验操作是:取烧杯中的少量液体,向其中加入稀盐酸,再加入_______ ,若产生_______ ,则证明 能透过半透膜。
能透过半透膜。
(1)燃煤产生的二氧化硫在气溶胶表界面可被燃煤时产生的锰催化,快速生成硫酸盐加重空气中PM2.5污染。下列措施不能减少燃煤对大气造成污染的是
①安装除尘脱氨脱硫设备 ②应用煤炭洗选加工技术 ③将煤炭气化转化为可燃性气体
④燃煤工厂烟囱加高 ⑤开发利用氢能、风能等清洁能源
(2)下列关于胶体的说法正确的是
a.胶体与溶液的本质区别是丁达尔现象
b.按照分散剂的不同可将胶体分为液溶胶、气溶胶和固溶胶
c.已知土壤胶体中的胶粒带负电,施用含氮总量相同的
 与
与 ,肥效相同
,肥效相同(3)明胶是水溶性蛋白质混合物,溶于水可形成胶体。由工业明胶制成的胶囊往往含有超标的重金属铬(
 ),从而对人体造成伤害。已知
),从而对人体造成伤害。已知 是一种酸根离子,则
是一种酸根离子,则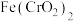 属于
属于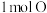 原子的
原子的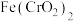 质量为
质量为 。
。(4)将少量混有
 的明胶胶体装入半透膜内浸入盛蒸馏水的烧杯中,证明
的明胶胶体装入半透膜内浸入盛蒸馏水的烧杯中,证明 能透过半透膜的实验操作是:取烧杯中的少量液体,向其中加入稀盐酸,再加入
能透过半透膜的实验操作是:取烧杯中的少量液体,向其中加入稀盐酸,再加入 能透过半透膜。
能透过半透膜。
您最近一年使用:0次
2022-11-11更新
|
169次组卷
|
2卷引用:山东省济南市2022-2023学年高一上学期期中考试化学试题
4 . 回答下列问题:
(1)向沸水中逐滴滴加适量饱和FeCl3溶液,继续加热至液体呈透明的红褐色,形成该分散系的分散质粒子的直径范围是_______ 。利用_______ 效应,证明该分散系。
(2)①56g氮气在标准状况下的体积为_______ ;密度为_______ 。
②3.9gNa2O2中阴、阳离子的个数比为_______ 。
③现有标准状况下CO和CO2混合气体6.72L,其质量为11.6g, 则此混合气体中,CO2和CO的物质的量之比是_______ 。
(3)阅读下列《高铁酸钾使用说明书》,回答问题:
①K2FeO4中铁元素的化合价为_______ 。
②制备K2FeO4需要在_______ (填“酸性”、“碱性”或“中性”)环境中进行。
③下列关于K2FeO4的说法中,不正确的是_______ 。
a.是强氧化性的盐
b.固体保存需要防潮
c.其消毒和净化水的原理相同
d.其净水优点有:作用快,安全性好、无异味
④将K2FeO4与水反应的化学方程式补充完整:_______ 。
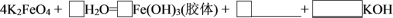
(1)向沸水中逐滴滴加适量饱和FeCl3溶液,继续加热至液体呈透明的红褐色,形成该分散系的分散质粒子的直径范围是
(2)①56g氮气在标准状况下的体积为
②3.9gNa2O2中阴、阳离子的个数比为
③现有标准状况下CO和CO2混合气体6.72L,其质量为11.6g, 则此混合气体中,CO2和CO的物质的量之比是
(3)阅读下列《高铁酸钾使用说明书》,回答问题:
| 高铁酸钾使用说明书 [化学式] K2FeO4 [性状]暗紫色具有金属光泽的粉末,无臭无味 [产品特点]干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气。K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用 [用途]主要用于饮用水消毒净化、城市生活污水和工业污水处理 [用量]消毒净化1 L水投放5 mg K2FeO4即可达到卫生标准 |
②制备K2FeO4需要在
③下列关于K2FeO4的说法中,不正确的是
a.是强氧化性的盐
b.固体保存需要防潮
c.其消毒和净化水的原理相同
d.其净水优点有:作用快,安全性好、无异味
④将K2FeO4与水反应的化学方程式补充完整:
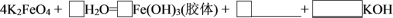
您最近一年使用:0次
名校
5 . 化学与生产生活密切相关,利用所学化学知识回答下列问题。
(1)雷雨天闪电时空气中有 生成。
生成。 与
与 的关系是互为
的关系是互为_______ ,等质量的 和
和 的分子数之比为
的分子数之比为_______ 。
(2)铁路工人经常用铝热反应来焊接钢轨,反应产物为 、Al2O3,
、Al2O3, 溶液可检验反应后的产物中是否有
溶液可检验反应后的产物中是否有 残留,用离子方程式说明其原理
残留,用离子方程式说明其原理_______ 。
(3)阅读下列科普短文并填空。
地表的天然水中含有很多杂质,为满足人们生产生活的需要,必须对其进行处理。利用混凝剂 可除去天然水中的县浮物。
可除去天然水中的县浮物。 在水中发生电离,产生的
在水中发生电离,产生的 与水反应生成
与水反应生成 胶体,可以吸附悬浮物与色素。为获得饮用水,还需对天然水消毒杀菌。过去广泛采用氯水作水体的消毒剂,近年来
胶体,可以吸附悬浮物与色素。为获得饮用水,还需对天然水消毒杀菌。过去广泛采用氯水作水体的消毒剂,近年来 和
和 备受关注。
备受关注。 溶于水能释放大量的原子氧,从而有效杀灭水中的病菌,同时生成具有良好吸附性的
溶于水能释放大量的原子氧,从而有效杀灭水中的病菌,同时生成具有良好吸附性的 胶体,所以
胶体,所以 具有广阔的应用前景。
具有广阔的应用前景。
①可利用_______ 证明 溶于水后得到
溶于水后得到 胶体。
胶体。
②利用数字化实验对光照过程中新制氯水的变化进行检测,下图能表示氯水的 随时间变化的图像是
随时间变化的图像是_______ (填字母),用化学方程式说明这一变化的原因_______ 。
(4)配平 溶于水后发生反应的离子方程式:
溶于水后发生反应的离子方程式:_______ 。
_______ _______
_______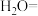 _______
_______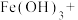 _______
_______ 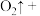 _______
_______ 。
。
每转移电子 ,生成标准状况下
,生成标准状况下 的体积为
的体积为_______ 。
(1)雷雨天闪电时空气中有
 生成。
生成。 与
与 的关系是互为
的关系是互为 和
和 的分子数之比为
的分子数之比为(2)铁路工人经常用铝热反应来焊接钢轨,反应产物为
 、Al2O3,
、Al2O3, 溶液可检验反应后的产物中是否有
溶液可检验反应后的产物中是否有 残留,用离子方程式说明其原理
残留,用离子方程式说明其原理(3)阅读下列科普短文并填空。
地表的天然水中含有很多杂质,为满足人们生产生活的需要,必须对其进行处理。利用混凝剂
 可除去天然水中的县浮物。
可除去天然水中的县浮物。 在水中发生电离,产生的
在水中发生电离,产生的 与水反应生成
与水反应生成 胶体,可以吸附悬浮物与色素。为获得饮用水,还需对天然水消毒杀菌。过去广泛采用氯水作水体的消毒剂,近年来
胶体,可以吸附悬浮物与色素。为获得饮用水,还需对天然水消毒杀菌。过去广泛采用氯水作水体的消毒剂,近年来 和
和 备受关注。
备受关注。 溶于水能释放大量的原子氧,从而有效杀灭水中的病菌,同时生成具有良好吸附性的
溶于水能释放大量的原子氧,从而有效杀灭水中的病菌,同时生成具有良好吸附性的 胶体,所以
胶体,所以 具有广阔的应用前景。
具有广阔的应用前景。①可利用
 溶于水后得到
溶于水后得到 胶体。
胶体。②利用数字化实验对光照过程中新制氯水的变化进行检测,下图能表示氯水的
 随时间变化的图像是
随时间变化的图像是
(4)配平
 溶于水后发生反应的离子方程式:
溶于水后发生反应的离子方程式:_______
 _______
_______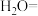 _______
_______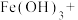 _______
_______ 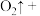 _______
_______ 。
。每转移电子
 ,生成标准状况下
,生成标准状况下 的体积为
的体积为
您最近一年使用:0次
名校
6 . 金属铝在生产生活中有广泛用途。
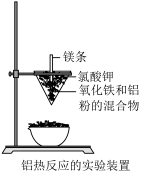
(1)写出工业通过电解法生产铝的化学方程式___________
(2)写出该铝热反应的化学方程式___________ ;利用铝热反应在工业上可冶炼___________ 金属(填编号)。
A.强还原性 B.难熔性 C.易导电 D.活泼
(3)反应结束后,从沙中取出生成的固体物质,该固体可能是铁铝合金,请同学设计实验证明。______
(4)某溶液中含有 0.15mol 的AlCl3,向其中加入 1mol/L 的NaOH溶液,得到沉淀7.8g,加入NaOH溶液的体积为___________ 。

(1)写出工业通过电解法生产铝的化学方程式
(2)写出该铝热反应的化学方程式
A.强还原性 B.难熔性 C.易导电 D.活泼
(3)反应结束后,从沙中取出生成的固体物质,该固体可能是铁铝合金,请同学设计实验证明。
(4)某溶液中含有 0.15mol 的AlCl3,向其中加入 1mol/L 的NaOH溶液,得到沉淀7.8g,加入NaOH溶液的体积为
您最近一年使用:0次
名校
解题方法
7 . 按要求回答下列问题
Ⅰ.化学科学在药物的开发、合成和使用中具有至关重要的作用。如小苏打、氢氧化铝、三硅酸镁等可疗胃酸过多,硫酸亚铁可补铁、防治贫血。试回答下列问题:
(1)写出小苏打与胃酸(主要成分为稀盐酸)作用的离子方程式:___________ 。
(2)利用提供试剂设计实验证明补铁剂中只含亚铁盐(可选试剂:氯水、硫氰化钾、过氧化氢),取补铁剂少许溶于水配成溶液,___________ (填写实验操作、现象和结论)
(3)氢氧化亚铁在空气中极不稳定,易被空气中氧气氧化。这一过程中观察到的现象是___________ ,反应的化学方程式是___________ 。
Ⅱ.镁铝合金是建造航空母舰的主体材料。
(4)镁铝合金的硬度比金属铝的硬度___________ (选填:大、小)。使用该合金前用NaOH溶液处理Al2O3,其离子方程式为___________ 。取一定量的镁铝合金均分为两份,分别与足量的盐酸、NaOH溶液充分反应,产生气体的物质的量之比为5:3,合金中镁铝的物质的量之比为___________ 。
Ⅰ.化学科学在药物的开发、合成和使用中具有至关重要的作用。如小苏打、氢氧化铝、三硅酸镁等可疗胃酸过多,硫酸亚铁可补铁、防治贫血。试回答下列问题:
(1)写出小苏打与胃酸(主要成分为稀盐酸)作用的离子方程式:
(2)利用提供试剂设计实验证明补铁剂中只含亚铁盐(可选试剂:氯水、硫氰化钾、过氧化氢),取补铁剂少许溶于水配成溶液,
(3)氢氧化亚铁在空气中极不稳定,易被空气中氧气氧化。这一过程中观察到的现象是
Ⅱ.镁铝合金是建造航空母舰的主体材料。
(4)镁铝合金的硬度比金属铝的硬度
您最近一年使用:0次
2024-01-08更新
|
54次组卷
|
2卷引用:吉林省长春外国语学校2023-2024学年高一上学期12月月考化学试题
解题方法
8 . 交警部门严厉打击酒后驾驶行为。80mg/100mL>血液中酒精含量≥20mg/100mL为饮酒驾驶;血液中酒精含量≥80mg/100mL为醉酒驾驶。K2Cr2O7是一种橙红色的物质,当其中的铬元素被还原成正三价铬时,颜色有明显变化。据此,当交警让司机对填充了吸附有K2Cr2O7的硅胶颗粒的装置(即酒精含量探测器)吹气,发生反应。
(1)该反应中K2Cr2O7跟_______ (写化学式)发生了反应,反应中氧化剂是_______ ;
(2)若交警测得某司机血液中酒精含量为0.01mol∙L-1,即证明司机是_______ 。(填“饮酒驾驶”或“醉酒驾驶”)
(1)该反应中K2Cr2O7跟
(2)若交警测得某司机血液中酒精含量为0.01mol∙L-1,即证明司机是
您最近一年使用:0次
解题方法
9 . 回答下列问题
(1)消毒液中的有效成分是_______ ,制备 消毒液的反应的化学方程式为
消毒液的反应的化学方程式为_______ 。它的消毒原理是_______ (用化学方程式表示)。由以上反应证明 是弱酸,酸性比碳酸
是弱酸,酸性比碳酸_______ 。
(2)将 和
和 的混合物加入足量的水中充分反应后,生成标准状况下的气体
的混合物加入足量的水中充分反应后,生成标准状况下的气体 ,所得溶液的体积为
,所得溶液的体积为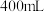 。试计算:
。试计算:
①原混合物中 的质量为
的质量为_______  。
。
②所得溶液的物质的量浓度为_______  。
。
(1)消毒液中的有效成分是
 消毒液的反应的化学方程式为
消毒液的反应的化学方程式为 是弱酸,酸性比碳酸
是弱酸,酸性比碳酸(2)将
 和
和 的混合物加入足量的水中充分反应后,生成标准状况下的气体
的混合物加入足量的水中充分反应后,生成标准状况下的气体 ,所得溶液的体积为
,所得溶液的体积为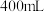 。试计算:
。试计算:①原混合物中
 的质量为
的质量为 。
。②所得溶液的物质的量浓度为
 。
。
您最近一年使用:0次
10 . 化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)在实验室中用浓盐酸与MnO2制取Cl2
①写出反应的离子方程式:_____ 。
②下列收集Cl2的正确装置是_____ 。
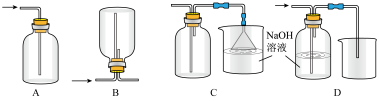
③将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是_____ 。
④若产生标准状况下4.48LCl2,转移的电子数是_____ ,被氧化的HCl的物质的量是:_____ 。
(2)请设计实验证明Fe2+具有还原性:_____ 。
限选试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片。
(3)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为_____ 。(计算结果保留两位小数)
(1)在实验室中用浓盐酸与MnO2制取Cl2
①写出反应的离子方程式:
②下列收集Cl2的正确装置是

③将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是
④若产生标准状况下4.48LCl2,转移的电子数是
(2)请设计实验证明Fe2+具有还原性:
限选试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片。
(3)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为
您最近一年使用:0次



