1 . 高锰酸钾是一种典型的强氧化剂。完成下列填空:
I:在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO +Cu2S+H+
+Cu2S+H+ Cu2++SO2↑+Mn2++H2O(未配平)
Cu2++SO2↑+Mn2++H2O(未配平)
② MnO +CuS +H+
+CuS +H+ Cu2++SO2↑+Mn2++H2O(未配平)
Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是___________(填字母序号)。
II:在稀硫酸中,KMnO4与 (NH4)2Fe(SO4)2也能发生氧化还原反应。
(2)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:_ ___MnO +______Fe2++______H+=_____Mn2+_____Fe3++ ____ H2O
+______Fe2++______H+=_____Mn2+_____Fe3++ ____ H2O
(3)欲配制480mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为___________ g,需要的玻璃仪器有___________
I:在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO
 +Cu2S+H+
+Cu2S+H+ Cu2++SO2↑+Mn2++H2O(未配平)
Cu2++SO2↑+Mn2++H2O(未配平)② MnO
 +CuS +H+
+CuS +H+ Cu2++SO2↑+Mn2++H2O(未配平)
Cu2++SO2↑+Mn2++H2O(未配平)(1)下列关于反应①的说法中错误的是___________(填字母序号)。
| A.被氧化的元素是Cu和S |
| B.氧化剂与还原剂的物质的量之比为8∶5 |
| C.生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol |
| D.还原性的强弱关系是:Mn2+>Cu2S |
II:在稀硫酸中,KMnO4与 (NH4)2Fe(SO4)2也能发生氧化还原反应。
(2)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
 +______Fe2++______H+=_____Mn2+_____Fe3++ ____ H2O
+______Fe2++______H+=_____Mn2+_____Fe3++ ____ H2O(3)欲配制480mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为
您最近一年使用:0次
名校
2 . 二氧化硫是形成酸雨的气体之一,可采用以下方法进行处理:首先将其通入硫酸铁溶液中,发生反应i:SO2+Fe2(SO4)3+2H2O=2H2SO4+2FeSO4。然后再向反应i后的溶液中加入K2Cr2O7溶液,发生反应ii:K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+7H2O+K2SO4。
回答下列问题:
(1)下列有关Fe2(SO4)3的说法正确的是_____ (填标号)。
(2)在K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+7H2O+K2SO4的反应中:
①K2Cr2O7中Cr元素的化合价为____ 。
②氧化产物为____ ,还原剂为____ 。
③由反应i和ii可得氧化性Cr2O
____ 填“>”,“<”或“无法确定”)SO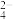 。
。
(3)在SO2+Fe2(SO4)3+2H2O=2H2SO4+2FeSO4的反应中:
①上述反应的离子方程式为_____ 。
②每消耗6.4gSO2,同时生成H2SO4的质量为____ g。
回答下列问题:
(1)下列有关Fe2(SO4)3的说法正确的是
| A.从组成该物质的阴离子来看,属于硫酸盐 |
| B.该物质溶于水,所得溶液呈绿色 |
| C.该物质中氧元素的含量最高 |
| D.在上述反应i中,Fe2(SO4)3只体现还原性 |
①K2Cr2O7中Cr元素的化合价为
②氧化产物为
③由反应i和ii可得氧化性Cr2O

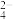 。
。(3)在SO2+Fe2(SO4)3+2H2O=2H2SO4+2FeSO4的反应中:
①上述反应的离子方程式为
②每消耗6.4gSO2,同时生成H2SO4的质量为
您最近一年使用:0次
2022-10-18更新
|
199次组卷
|
2卷引用:辽宁省部分学校2022-2023学年高一上学期10月月考化学试题
名校
解题方法
3 . 硫酸亚铁铵晶体的化学式为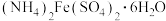 ,是常用的还原剂,实验室制备它的原理为
,是常用的还原剂,实验室制备它的原理为 .已知几种盐的溶解度(g)如下表所示:
.已知几种盐的溶解度(g)如下表所示:
回答下列问题:
(1)下列有关 的说法错误的是_______(填序号)。
的说法错误的是_______(填序号)。
(2)实验室制备硫酸亚铁铵晶体时,从混合液中获取该晶体的操作是_______ 、过滤、洗涤、干燥。
(3)若某次实验中需要使用480mL0.1mol/L硫酸亚铁铵溶液,则实验中需要称取_______ g硫酸亚铁铵晶体。配制时所用的水要先用蒸馏法处理,其目的是_______ 。若定容时仰视容量瓶刻度线,则所配溶液浓度_______ (填“偏高”或“偏低”)。
(4)取20mL所配溶液与足量NaOH溶液反应,将所得沉淀充分放置一段时间后过滤、洗涤、灼烧,最终可得到_______ g固体。
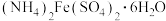 ,是常用的还原剂,实验室制备它的原理为
,是常用的还原剂,实验室制备它的原理为 .已知几种盐的溶解度(g)如下表所示:
.已知几种盐的溶解度(g)如下表所示:| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
 | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 |
 | 70.6 | 73.0 | 75.4 | 78.0 | 81.63 | 84.4 |
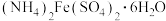 | 12.5 | 17.2 | 33.0 | 40.0 |
回答下列问题:
(1)下列有关
 的说法错误的是_______(填序号)。
的说法错误的是_______(填序号)。| A.是硫酸盐 | B.是铁盐 | C.是含氧酸盐 | D.是可溶性盐 |
(3)若某次实验中需要使用480mL0.1mol/L硫酸亚铁铵溶液,则实验中需要称取
(4)取20mL所配溶液与足量NaOH溶液反应,将所得沉淀充分放置一段时间后过滤、洗涤、灼烧,最终可得到
您最近一年使用:0次
名校
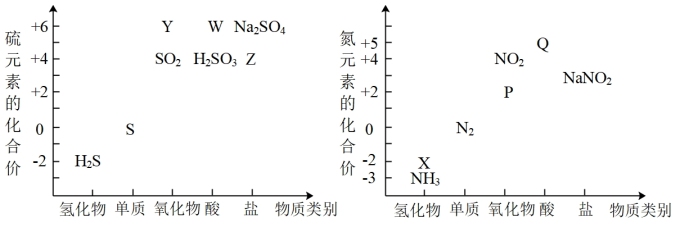
4 . 从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。如图是硫、氮两元素的价类二维图。
请回答下列问题:
(1)物质X可作为火箭发动机的燃料,其结构式为_______ 。
(2)宋代著名法医学家宋慈的 洗冤集录
洗冤集录 中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:
中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为: (反应未配平),已知:
(反应未配平),已知: 为一种不溶于水的灰黑色固体。以下有关说法
为一种不溶于水的灰黑色固体。以下有关说法错误 的是_______(填字母)。
(3)已知物质Z是一种可溶性正盐能被酸性K2Cr2O7溶液氧化为Na2SO4,Cr2O 被还原Cr3+,请写出此反应的离子方程式为
被还原Cr3+,请写出此反应的离子方程式为_______ 。
(4)大苏打 在照相、电影、纺织、化纤、造纸、皮革、农药等方面均有重要用途。现欲在实验室制备大苏打,从氧化还原的角度分析,下列选用的试剂合理的是_______
在照相、电影、纺织、化纤、造纸、皮革、农药等方面均有重要用途。现欲在实验室制备大苏打,从氧化还原的角度分析,下列选用的试剂合理的是_______ 填字母
填字母 。
。
(5)氮的氧化物(NOx)是常见的大气污染物之一, 催化还原氮氧化物
催化还原氮氧化物 技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质
技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质 与NO2的物质的量之比为
与NO2的物质的量之比为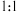 时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,请写出该反应的化学方程式为
时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,请写出该反应的化学方程式为_______ 。
(6)将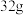 铜与
铜与 一定浓度的物质Q充分反应,铜完全溶解,产生标准状况下的物质
一定浓度的物质Q充分反应,铜完全溶解,产生标准状况下的物质 和二氧化氮混合气体共
和二氧化氮混合气体共 。则混合气体中物质
。则混合气体中物质 的体积为
的体积为_______ 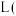 标准状况下
标准状况下 ,待反应结束后,向溶液中加入
,待反应结束后,向溶液中加入 的氢氧化钠溶液,恰好使溶液中的
的氢氧化钠溶液,恰好使溶液中的 全部转化为沉淀,则原物质Q的物质的量浓度为
全部转化为沉淀,则原物质Q的物质的量浓度为_______  。
。

请回答下列问题:
(1)物质X可作为火箭发动机的燃料,其结构式为
(2)宋代著名法医学家宋慈的
 洗冤集录
洗冤集录 中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:
中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为: (反应未配平),已知:
(反应未配平),已知: 为一种不溶于水的灰黑色固体。以下有关说法
为一种不溶于水的灰黑色固体。以下有关说法| A.当银针变黑时,说明所检验的物质中可能有毒 |
B.银针验毒时, 被氧化 被氧化 |
| C.上述验毒反应中氧化剂和还原剂的物质的量之比为4:1 |
D. 在上述验毒反应中作还原剂 在上述验毒反应中作还原剂 |
 被还原Cr3+,请写出此反应的离子方程式为
被还原Cr3+,请写出此反应的离子方程式为(4)大苏打
 在照相、电影、纺织、化纤、造纸、皮革、农药等方面均有重要用途。现欲在实验室制备大苏打,从氧化还原的角度分析,下列选用的试剂合理的是_______
在照相、电影、纺织、化纤、造纸、皮革、农药等方面均有重要用途。现欲在实验室制备大苏打,从氧化还原的角度分析,下列选用的试剂合理的是_______ 填字母
填字母 。
。A. | B. |
C. | D. |
 催化还原氮氧化物
催化还原氮氧化物 技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质
技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质 与NO2的物质的量之比为
与NO2的物质的量之比为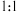 时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,请写出该反应的化学方程式为
时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,请写出该反应的化学方程式为(6)将
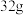 铜与
铜与 一定浓度的物质Q充分反应,铜完全溶解,产生标准状况下的物质
一定浓度的物质Q充分反应,铜完全溶解,产生标准状况下的物质 和二氧化氮混合气体共
和二氧化氮混合气体共 。则混合气体中物质
。则混合气体中物质 的体积为
的体积为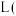 标准状况下
标准状况下 ,待反应结束后,向溶液中加入
,待反应结束后,向溶液中加入 的氢氧化钠溶液,恰好使溶液中的
的氢氧化钠溶液,恰好使溶液中的 全部转化为沉淀,则原物质Q的物质的量浓度为
全部转化为沉淀,则原物质Q的物质的量浓度为 。
。
您最近一年使用:0次
2022-04-18更新
|
329次组卷
|
2卷引用:湖北省新高考联考协作体2021-2022学年高一下学期期中考试化学试题
名校
5 . 卤素单质及其化合物是重要的化工原料,用途广泛。
(1)下列关于卤素及其相关物质的说法不正确的是___________。
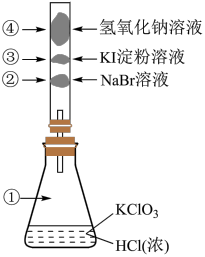
(2)已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是___________ 。
(3)下列关于含卤素物质的实验,说法正确的是___________。
(4)取等浓度的NaBr、NaI的混合溶液,加入一定量氯水后溶液中溶质的情况可能是___________。
(5)将22g NaCl和NaBr的混合粉末溶于水,配成100mL溶液,向溶液中通入足量的Cl2后,将溶液蒸干,得到干燥固体的质量为17.55g,求:
①参加反应中的Cl2在标准状况下的体积为___________ 。
②原混合物中NaCl的物质的量的百分含量为___________ 。(用小数表示,精确到0.01)
(1)下列关于卤素及其相关物质的说法不正确的是___________。
| A.卤素就是氯、溴、碘 | B.氯、溴、碘单质颜色逐渐加深 |
| C.HCl、HBr、HI还原性逐渐增强 | D.卤化银都易见光分解 |
(2)已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是

| ① | ② | ③ | ④ | |
| A | 黄绿色 | 橙色 | 蓝色 | 白色 |
| B | 无色 | 橙色 | 紫色 | 白色 |
| C | 黄绿色 | 橙色 | 蓝色 | 无色 |
| D | 黄绿色 | 无色 | 紫色 | 白色 |
(3)下列关于含卤素物质的实验,说法正确的是___________。
| A.氢气在氯气中燃烧,有苍白色烟雾生成 |
| B.溴水中加入苯振荡,静置后液体分两层,下层为红棕色 |
| C.碘化钾中加入溴水,溶液变黄,说明碘被置换出来 |
| D.卤水都有颜色,都呈酸性 |
(4)取等浓度的NaBr、NaI的混合溶液,加入一定量氯水后溶液中溶质的情况可能是___________。
| A.NaBr、NaI、NaCl | B.NaBr、NaI、NaCl、Br2 |
| C.NaI、NaCl、Br2 | D.NaBr、NaCl、I2 |
(5)将22g NaCl和NaBr的混合粉末溶于水,配成100mL溶液,向溶液中通入足量的Cl2后,将溶液蒸干,得到干燥固体的质量为17.55g,求:
①参加反应中的Cl2在标准状况下的体积为
②原混合物中NaCl的物质的量的百分含量为
您最近一年使用:0次
解题方法
6 . 用NA表示阿伏加德罗常数,判断下列说法是否正确。
1.在常温常压下,18 g H2O与18 g D2O所含电子数均为10NA___________
2.17 g —OH与17 g OH-所含电子数均为10NA___________
3.30 g SiO2中含有硅氧键个数为NA___________
4.32g甲醇中所含共价键数目为5NA___________
5.常温常压下,32gO2和O3的混合气体中含有的原子数为2NA___________
6.56 g乙烯中所含共用电子对数目为12NA___________
7.78 g苯中含有3NA碳碳双键___________
8.60℃时,92 g NO2与N2O4的混合气体中含有的原子总数为6NA___________
1.在常温常压下,18 g H2O与18 g D2O所含电子数均为10NA
2.17 g —OH与17 g OH-所含电子数均为10NA
3.30 g SiO2中含有硅氧键个数为NA
4.32g甲醇中所含共价键数目为5NA
5.常温常压下,32gO2和O3的混合气体中含有的原子数为2NA
6.56 g乙烯中所含共用电子对数目为12NA
7.78 g苯中含有3NA碳碳双键
8.60℃时,92 g NO2与N2O4的混合气体中含有的原子总数为6NA
您最近一年使用:0次
7 . 用NA表示阿伏加德罗常数,判断下列说法是否正确。
1.2.24 L CO2中含有的原子数为0.3NA___________
2.常温下,11.2 L甲烷气体含有的甲烷分子数为0.5NA___________
3.标准状况下,含NA个Cl2分子的气体体积约为22.4 L___________
4.标准状况下,22.4 L SO3中含有SO3分子数为NA___________
5.标准状况下,22.4 L氧气、氮气和CO的混合气体中含有2NA个原子___________
6.用惰性电极电解饱和食盐水,若线路中通过NA个电子,则阴极产生11.2 L气体___________
1.2.24 L CO2中含有的原子数为0.3NA
2.常温下,11.2 L甲烷气体含有的甲烷分子数为0.5NA
3.标准状况下,含NA个Cl2分子的气体体积约为22.4 L
4.标准状况下,22.4 L SO3中含有SO3分子数为NA
5.标准状况下,22.4 L氧气、氮气和CO的混合气体中含有2NA个原子
6.用惰性电极电解饱和食盐水,若线路中通过NA个电子,则阴极产生11.2 L气体
您最近一年使用:0次
解题方法
8 . 用NA表示阿伏加德罗常数,判断下列说法是否正确。
1.50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA。(_______)
2.常温下,密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA。(_______)
3.常温下,56 g铁片投入足量浓H2SO4中生成NA个SO2分子。(_______)
4.一定条件下,用 1.5 mol H2和0.5 mol N2,充分反应后可得到NH3分子数为NA。(_______)
5.标准状况下,将22.4 L Cl2通入足量水中充分反应,转移电子数小于NA。(_______)
1.50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA。(_______)
2.常温下,密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA。(_______)
3.常温下,56 g铁片投入足量浓H2SO4中生成NA个SO2分子。(_______)
4.一定条件下,用 1.5 mol H2和0.5 mol N2,充分反应后可得到NH3分子数为NA。(_______)
5.标准状况下,将22.4 L Cl2通入足量水中充分反应,转移电子数小于NA。(_______)
您最近一年使用:0次
9 . 用NA表示阿伏加德罗常数,判断下列说法是否正确。
1.5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA。(_______)
2.0.1 mol Zn与含0.1 mol HCl的盐酸充分反应,转移的电子数目为0.2NA。(_______)
3.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA。(_______)
4.1 mol Na2O2与足量CO2充分反应转移的电子数为2NA。(_______)
5.向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移电子的数目不小于3NA。(_______)
6.1 mol Cl2参加反应转移电子数一定为2NA。(_______)
7.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数小于2NA。(_______)
8.0.3 mol NO2与足量的水反应转移电子数目为0.2NA。(_______)
1.5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA。(_______)
2.0.1 mol Zn与含0.1 mol HCl的盐酸充分反应,转移的电子数目为0.2NA。(_______)
3.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA。(_______)
4.1 mol Na2O2与足量CO2充分反应转移的电子数为2NA。(_______)
5.向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移电子的数目不小于3NA。(_______)
6.1 mol Cl2参加反应转移电子数一定为2NA。(_______)
7.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数小于2NA。(_______)
8.0.3 mol NO2与足量的水反应转移电子数目为0.2NA。(_______)
您最近一年使用:0次
解题方法
10 . 甲烷(CH4)是一种无色无味的气体,是天然气的主要成分,燃烧的方程式是:CH4+2O2 CO2+2H2O。
CO2+2H2O。
(1)下列说法中正确的是______ 。
(2)1mol任何粒子的粒子数叫做阿伏加德罗常数符号为NA。0.5mol甲烷含有的原子数为______ 。
(3)在标准状况下,两个容积相同的储气瓶中分别盛有氧气和甲烷,则两瓶气体具有相同的______ 。
(4)若甲烷与氧气按质量比1:4混合时极易爆炸,此时甲烷与氧气的体积比为______ 。
(5)现有2molCH4,它的摩尔质量是______ ,这些CH4完全燃烧,需消耗氧气______ g,这些氧气约含有______ 个氧分子。
(6)标准状况下,CH4的密度为______ (保留3位有效数字).如果11.2LCH4中含有x个氢原子,则阿伏加德罗常数的值为______ 。
(7)在标准状况下,11.2升甲烷充分燃烧,将生成的气体通入200mL某浓度的氢氧化钠溶液中,恰好完全反应生成碳酸钠。求:
①参加反应的氢氧化钠物质的量为______ 。
②所用氢氧化钠溶液的物质的量浓度为______ 。
③向反应后的溶液中加水至500mL,求此时碳酸钠的物质的量浓度为______ 。
 CO2+2H2O。
CO2+2H2O。(1)下列说法中正确的是
| A.物质的量就是物质的质量 | B.阿伏伽德罗常数就是6.02×1023 |
| C.物质的量的单位是摩尔 | D.甲烷的摩尔质量是16g |
| A.0.5NA | B.NA | C.1.5NA | D.2.5NA |
| A.质量 | B.原子总数 | C.密度 | D.分子数 |
| A.1:4 | B.1:2 | C.1:1 | D.2:1 |
(6)标准状况下,CH4的密度为
(7)在标准状况下,11.2升甲烷充分燃烧,将生成的气体通入200mL某浓度的氢氧化钠溶液中,恰好完全反应生成碳酸钠。求:
①参加反应的氢氧化钠物质的量为
②所用氢氧化钠溶液的物质的量浓度为
③向反应后的溶液中加水至500mL,求此时碳酸钠的物质的量浓度为
您最近一年使用:0次



