解题方法
1 . 回答下列问题
(1)消毒液中的有效成分是_______ ,制备 消毒液的反应的化学方程式为
消毒液的反应的化学方程式为_______ 。它的消毒原理是_______ (用化学方程式表示)。由以上反应证明 是弱酸,酸性比碳酸
是弱酸,酸性比碳酸_______ 。
(2)将 和
和 的混合物加入足量的水中充分反应后,生成标准状况下的气体
的混合物加入足量的水中充分反应后,生成标准状况下的气体 ,所得溶液的体积为
,所得溶液的体积为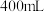 。试计算:
。试计算:
①原混合物中 的质量为
的质量为_______  。
。
②所得溶液的物质的量浓度为_______  。
。
(1)消毒液中的有效成分是
 消毒液的反应的化学方程式为
消毒液的反应的化学方程式为 是弱酸,酸性比碳酸
是弱酸,酸性比碳酸(2)将
 和
和 的混合物加入足量的水中充分反应后,生成标准状况下的气体
的混合物加入足量的水中充分反应后,生成标准状况下的气体 ,所得溶液的体积为
,所得溶液的体积为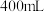 。试计算:
。试计算:①原混合物中
 的质量为
的质量为 。
。②所得溶液的物质的量浓度为
 。
。
您最近一年使用:0次
名校
2 .  是一种化工原料,可以制备多种物质,如图所示。请回答下列问题:
是一种化工原料,可以制备多种物质,如图所示。请回答下列问题:
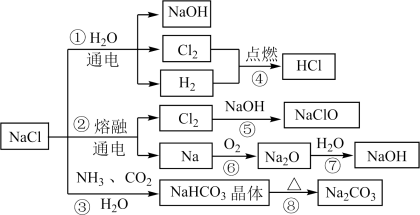
(1)图所列转化反应中属于氧化还原反应的有_______ (填图中序号)
(2)反应④的现象是_______ 。
(3)工业上制取 主要采用反应①,而不采用反应⑦的方法,主要原因是
主要采用反应①,而不采用反应⑦的方法,主要原因是_______ 。
(4)某同学将新制的饱和氯水滴入含有酚酞的氢氧化钠稀溶液中,当滴到一定量时,红色突然褪去,该同学分析红色突然褪去的原因可能有两种:①氯水中的酸或氯分子与 发生反应,将
发生反应,将 消耗所致;②氯水中次氯酸的强氧化性,使红色褪去所致。设计实验证明红色褪去的原因:取褪色后的溶液于试管中,向其中滴加
消耗所致;②氯水中次氯酸的强氧化性,使红色褪去所致。设计实验证明红色褪去的原因:取褪色后的溶液于试管中,向其中滴加 溶液,如果
溶液,如果_______ ,则是原因①;若_______ ,则是原因②。
(5) 作为在潜水艇和消防员呼吸面具中的供氧剂,已知某潜水艇中有50人,若每人每小时消耗
作为在潜水艇和消防员呼吸面具中的供氧剂,已知某潜水艇中有50人,若每人每小时消耗 在标准状况下体积为44.8L,假设所需要的
在标准状况下体积为44.8L,假设所需要的 全由
全由 所提供,则每小时所
所提供,则每小时所 的质量为
的质量为_______ kg。
(6)反应③和⑧是工业制备纯碱的主要原理,以下是两种制碱法的工艺流程图:
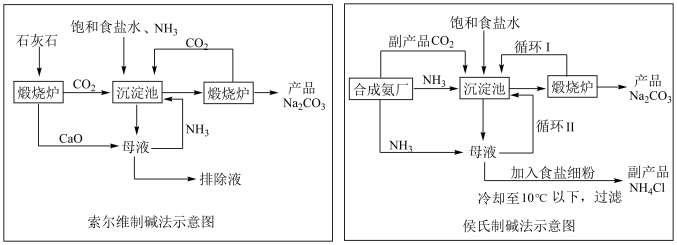
下列说法正确的是_______ (填序号)。
A.用 制取纯碱的过程中,利用了物质溶解度的差异
制取纯碱的过程中,利用了物质溶解度的差异
B.沉淀池中 与
与 的通入顺序为先通入
的通入顺序为先通入 ,再通入
,再通入
C.索尔维制碱法所得“排出液”的主要成分为
D.侯氏制碱法循环利用的物质主要是 和
和
E.侯氏制碱法中母液经过循环Ⅱ进入沉淀池,从而使原料 的利用率大大提升
的利用率大大提升
F.侯氏制碱法在母液中加入食盐细粉目的是提高 的浓度,促进
的浓度,促进 结晶析出
结晶析出
G.检验产品 中是否含有
中是否含有 的操作方法是取少量试样溶于水,加入过量的稀硝酸,再滴加
的操作方法是取少量试样溶于水,加入过量的稀硝酸,再滴加 溶液,观察是否有白色沉淀生成
溶液,观察是否有白色沉淀生成
 是一种化工原料,可以制备多种物质,如图所示。请回答下列问题:
是一种化工原料,可以制备多种物质,如图所示。请回答下列问题:
(1)图所列转化反应中属于氧化还原反应的有
(2)反应④的现象是
(3)工业上制取
 主要采用反应①,而不采用反应⑦的方法,主要原因是
主要采用反应①,而不采用反应⑦的方法,主要原因是(4)某同学将新制的饱和氯水滴入含有酚酞的氢氧化钠稀溶液中,当滴到一定量时,红色突然褪去,该同学分析红色突然褪去的原因可能有两种:①氯水中的酸或氯分子与
 发生反应,将
发生反应,将 消耗所致;②氯水中次氯酸的强氧化性,使红色褪去所致。设计实验证明红色褪去的原因:取褪色后的溶液于试管中,向其中滴加
消耗所致;②氯水中次氯酸的强氧化性,使红色褪去所致。设计实验证明红色褪去的原因:取褪色后的溶液于试管中,向其中滴加 溶液,如果
溶液,如果(5)
 作为在潜水艇和消防员呼吸面具中的供氧剂,已知某潜水艇中有50人,若每人每小时消耗
作为在潜水艇和消防员呼吸面具中的供氧剂,已知某潜水艇中有50人,若每人每小时消耗 在标准状况下体积为44.8L,假设所需要的
在标准状况下体积为44.8L,假设所需要的 全由
全由 所提供,则每小时所
所提供,则每小时所 的质量为
的质量为(6)反应③和⑧是工业制备纯碱的主要原理,以下是两种制碱法的工艺流程图:

下列说法正确的是
A.用
 制取纯碱的过程中,利用了物质溶解度的差异
制取纯碱的过程中,利用了物质溶解度的差异B.沉淀池中
 与
与 的通入顺序为先通入
的通入顺序为先通入 ,再通入
,再通入
C.索尔维制碱法所得“排出液”的主要成分为

D.侯氏制碱法循环利用的物质主要是
 和
和
E.侯氏制碱法中母液经过循环Ⅱ进入沉淀池,从而使原料
 的利用率大大提升
的利用率大大提升F.侯氏制碱法在母液中加入食盐细粉目的是提高
 的浓度,促进
的浓度,促进 结晶析出
结晶析出G.检验产品
 中是否含有
中是否含有 的操作方法是取少量试样溶于水,加入过量的稀硝酸,再滴加
的操作方法是取少量试样溶于水,加入过量的稀硝酸,再滴加 溶液,观察是否有白色沉淀生成
溶液,观察是否有白色沉淀生成
您最近一年使用:0次
名校
解题方法
3 . 按要求回答下列问题:
(1)下列物质中,属于电解质的有___________ (填序号)。
A.铜丝 B.烧碱 C.盐酸 D. E.水玻璃
E.水玻璃
(2)已知实验室可选用 与浓盐酸反应制备
与浓盐酸反应制备 ,其反应的离子方程式为
,其反应的离子方程式为___________ ,若该反应转移1.2mol  ,则标况下产生
,则标况下产生 的体积为
的体积为___________ L。
(3)玉石的主要成分基本都属于硅酸盐,则南阳玉(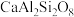 )表示为氧化物的形式是
)表示为氧化物的形式是___________ 。
(4)已知某磁铁矿中含 和
和 的杂质,为了测定矿石中铁元素的含量,现进行如下实验:
的杂质,为了测定矿石中铁元素的含量,现进行如下实验:
Ⅰ.准确称取a g矿石并磨成粉,加入过量的稀盐酸,充分反应后过滤;
Ⅱ.向滤液中加入过量NaOH溶液,充分反应后过滤、洗涤、干燥,将沉淀灼烧至恒重,称取剩余固体质量为b g。
①步骤Ⅰ中 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
②步骤Ⅱ中为了证明沉淀已经洗净的操作方法是___________ 。
③该铁矿石中铁元素的质量分数为___________ (含a、b的代数式表示)。
(1)下列物质中,属于电解质的有
A.铜丝 B.烧碱 C.盐酸 D.
 E.水玻璃
E.水玻璃(2)已知实验室可选用
 与浓盐酸反应制备
与浓盐酸反应制备 ,其反应的离子方程式为
,其反应的离子方程式为 ,则标况下产生
,则标况下产生 的体积为
的体积为(3)玉石的主要成分基本都属于硅酸盐,则南阳玉(
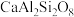 )表示为氧化物的形式是
)表示为氧化物的形式是(4)已知某磁铁矿中含
 和
和 的杂质,为了测定矿石中铁元素的含量,现进行如下实验:
的杂质,为了测定矿石中铁元素的含量,现进行如下实验:Ⅰ.准确称取a g矿石并磨成粉,加入过量的稀盐酸,充分反应后过滤;
Ⅱ.向滤液中加入过量NaOH溶液,充分反应后过滤、洗涤、干燥,将沉淀灼烧至恒重,称取剩余固体质量为b g。
①步骤Ⅰ中
 发生反应的化学方程式为
发生反应的化学方程式为②步骤Ⅱ中为了证明沉淀已经洗净的操作方法是
③该铁矿石中铁元素的质量分数为
您最近一年使用:0次
2021-09-08更新
|
924次组卷
|
2卷引用:重庆市第八中学校2022届高三上学期入学摸底测试化学试题
解题方法
4 . 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是___ ,证明Fe3+存在的现象是___ 。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式___ 。
(3)某工程师为了从使用过的腐蚀废液(主要含Fe3+、Fe2+、Cu2+、Cl-)中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:
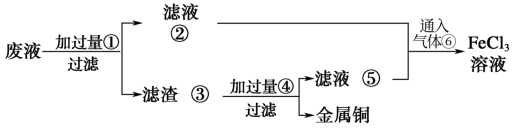
请写出上述实验中加入或生成的有关物质的化学式。
①___ ,④___ 。
(4))写出向②⑤的混合液中通入⑥的离子方程式:___ 。
(5)将铜片放入0.1mol/LFeCl3溶液中,反应一段时间后取出铜片,溶液中c(Fe3+):c(Fe2+)=2:3,则此时溶液中的Cu2+与Fe3+的物质的量之比为___ 。
(1)检验溶液中Fe3+存在的试剂是
(2)写出FeCl3溶液与金属铜发生反应的离子方程式
(3)某工程师为了从使用过的腐蚀废液(主要含Fe3+、Fe2+、Cu2+、Cl-)中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式。
①
(4))写出向②⑤的混合液中通入⑥的离子方程式:
(5)将铜片放入0.1mol/LFeCl3溶液中,反应一段时间后取出铜片,溶液中c(Fe3+):c(Fe2+)=2:3,则此时溶液中的Cu2+与Fe3+的物质的量之比为
您最近一年使用:0次
名校
解题方法
5 . 央视《每周质量报告》曝光了少数明胶企业将皮革废料熬制成工业明胶,出售给个别制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,从而对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。2010版《中国药典》明确规定,药用胶囊使用的明胶原料,重金属铬的含量均不得超过2mg•kg-1。
(1)已知有毒胶囊中含有Fe(CrO2)2,其中铬元素是+3价,则其中铁元素的化合价为___ ;如果某明胶原料100kg中含有铁元素的质量为0.56g,则药用胶囊使用的这种明胶原料重金属铬的含量___ (填“超标”或“不超标”)。
(2)区别明胶溶于水的分散系和Na2SO4溶液的方法是___ 。
(3)将饱和FeCl3溶液分别滴入下述液体中,能形成胶体的是___ 。
A.冷水 B.沸水 C.NaCl溶液 D.NaOH溶液
(4)已知胶体的分散质不能透过半透膜,但小分子或离子能透过半透膜。现将10mL明胶溶于水的分散系与5mLNa2SO4溶液混合后装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中。写出证明Na+能透过半透膜的实验方法(具体操作):___ 。
(1)已知有毒胶囊中含有Fe(CrO2)2,其中铬元素是+3价,则其中铁元素的化合价为
(2)区别明胶溶于水的分散系和Na2SO4溶液的方法是
(3)将饱和FeCl3溶液分别滴入下述液体中,能形成胶体的是
A.冷水 B.沸水 C.NaCl溶液 D.NaOH溶液
(4)已知胶体的分散质不能透过半透膜,但小分子或离子能透过半透膜。现将10mL明胶溶于水的分散系与5mLNa2SO4溶液混合后装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中。写出证明Na+能透过半透膜的实验方法(具体操作):
您最近一年使用:0次
2021-03-16更新
|
168次组卷
|
2卷引用:河北省保定市2020-2021学年高一上学期期末考试化学试题
解题方法
6 . 如图的坐标系是部分含硫化合物的转化关系图。

(1)X的名称为_____ ,Z的化学式为_____ 。
(2)用图中物质之间的反应,证明SO2有氧化性的反应的化学方程式为_____ 。
(3)若X能与Na2O2的反应生成Y,则该反应的化学方程式为_____ 。
(4)已知: +I2+H2O=
+I2+H2O= +2I-+2H+。某溶液中可能含有大量的Na+、
+2I-+2H+。某溶液中可能含有大量的Na+、 、Fe2+、K+、I-、
、Fe2+、K+、I-、 、
、 。向该溶液中滴加少量溴水,溶液仍呈无色,依此可判断该溶液中肯定含有
。向该溶液中滴加少量溴水,溶液仍呈无色,依此可判断该溶液中肯定含有_____ ;肯定不能含有_____ 。
(5)向50mL浓硫酸中加入铜片,加热,反应一段时间,共收集到2.24L(标准状况)的SO2,将反应后的混合物加水稀释,再加入足量锌粉放出15.68L(标准状况)的H2,则原浓硫酸的物质的量浓度为_____ ,整个过程消耗锌粉的质量为_____ 。

(1)X的名称为
(2)用图中物质之间的反应,证明SO2有氧化性的反应的化学方程式为
(3)若X能与Na2O2的反应生成Y,则该反应的化学方程式为
(4)已知:
 +I2+H2O=
+I2+H2O= +2I-+2H+。某溶液中可能含有大量的Na+、
+2I-+2H+。某溶液中可能含有大量的Na+、 、Fe2+、K+、I-、
、Fe2+、K+、I-、 、
、 。向该溶液中滴加少量溴水,溶液仍呈无色,依此可判断该溶液中肯定含有
。向该溶液中滴加少量溴水,溶液仍呈无色,依此可判断该溶液中肯定含有(5)向50mL浓硫酸中加入铜片,加热,反应一段时间,共收集到2.24L(标准状况)的SO2,将反应后的混合物加水稀释,再加入足量锌粉放出15.68L(标准状况)的H2,则原浓硫酸的物质的量浓度为
您最近一年使用:0次
19-20高一·浙江·阶段练习
7 . 请回答下列问题。
(1)设NA表示阿伏加德罗常数:
①6.8g熔触的KHSO4中含有___ 个阳离子;
②0.1molNa2O2与水完全反应,转移______ 个电子;
③标准状况下,22.4L氩气含有原子数为____________ ;
④常温常压下,32gO2和O3的混合物含有_____ NA个氧原子。
(2)食盐不慎洒落在天然气的火焰上,观察的现象是________ ,该变化是________ 变化(填“物理”或“化学”)。
(3)清理卫生间时,因混合使用“洁厕灵”(主要成分是稀盐酸)与84消毒液(主要成分是次氯酸钠)而发生氯气中毒事件。请从氧化还原反应的角度分析原因:________________ 。
(4)下列反应可用于检查司机是否酒后开车:2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3(绿色)+3CH3COOH+2K2SO4+( )。方程式中空格内的系数和物质(化学式)为_____ 该反应中氧化产物是___________ ;还原产物是___________ ;反应中生成0.1molCr3+离子,转移的电子总数为________ 个。
(5)由工业明胶制成的胶囊往往含有超标的重金属铬,会对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。现有10mL明胶的水溶液与5mLK2SO4溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明 能够透过半透膜
能够透过半透膜___________ 。
(1)设NA表示阿伏加德罗常数:
①6.8g熔触的KHSO4中含有
②0.1molNa2O2与水完全反应,转移
③标准状况下,22.4L氩气含有原子数为
④常温常压下,32gO2和O3的混合物含有
(2)食盐不慎洒落在天然气的火焰上,观察的现象是
(3)清理卫生间时,因混合使用“洁厕灵”(主要成分是稀盐酸)与84消毒液(主要成分是次氯酸钠)而发生氯气中毒事件。请从氧化还原反应的角度分析原因:
(4)下列反应可用于检查司机是否酒后开车:2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3(绿色)+3CH3COOH+2K2SO4+( )。方程式中空格内的系数和物质(化学式)为
(5)由工业明胶制成的胶囊往往含有超标的重金属铬,会对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。现有10mL明胶的水溶液与5mLK2SO4溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明
 能够透过半透膜
能够透过半透膜
您最近一年使用:0次
解题方法
8 . 锰及其化合物用途广泛,是生产不锈钢、合金钢、铝锰合金、铜锰合金等的合金元素,高锰酸钾在医疗上用作消毒剂,锰也是人体内多种酶的组成元素。
(1)用酸性KMnO4溶液与亚铁盐的反应证明Fe2+具有还原性、MnO 具有氧化性,最合适的亚铁盐是
具有氧化性,最合适的亚铁盐是________ [从“FeSO4”、“FeCl2”和“Fe(NO3)2”中选择填入]。
(2)工业上由二氧化锰通过铝热反应制备锰,写出反应的化学方程式:________________________ 。
(3)等物质的量的Al、Mn分别与足量的稀硫酸反应,产生H2的体积比(同温同压)为3∶2,写出Mn与稀硫酸反应的化学方程式:________________________ 。
(4)在熔融的Mn和KOH混合物中通入O2可制备K2MnO4。若用MnO2代替Mn也可制得K2MnO4,两种情况下制备相同量的K2MnO4消耗O2的物质的量之比为________ 。
(1)用酸性KMnO4溶液与亚铁盐的反应证明Fe2+具有还原性、MnO
 具有氧化性,最合适的亚铁盐是
具有氧化性,最合适的亚铁盐是(2)工业上由二氧化锰通过铝热反应制备锰,写出反应的化学方程式:
(3)等物质的量的Al、Mn分别与足量的稀硫酸反应,产生H2的体积比(同温同压)为3∶2,写出Mn与稀硫酸反应的化学方程式:
(4)在熔融的Mn和KOH混合物中通入O2可制备K2MnO4。若用MnO2代替Mn也可制得K2MnO4,两种情况下制备相同量的K2MnO4消耗O2的物质的量之比为
您最近一年使用:0次
9 . 氢化铝锂(LiAlH4)是化工生产中广泛应用于药物合成的常用试剂。
(1)LiAlH4可将乙醛转化为乙醇,LiAlH4作该反应的______ 剂(选填“氧化”“还原”“催化”),用____ (填试剂名称)可检验乙醛已完全转化。
(2)配平化学反应方程式。
______ LiAlH4+______ H2SO4→______ Li2SO4+_______ Al2(SO4)3+_______ H2↑
该反应中H2SO4体现________ 性。若上述反应中电子转移数目为0.2NA个,则生成标准状况下氢气体积为_____________ 。
(3)现有两种浓度的LiOH溶液,已知a溶液的pH大于b溶液,则两种溶液中由水电离的c(H+)大小关系是:a_____ b(选填“>”、“<”或“=”)。
(4)铝和氧化铁高温下反应得到的熔融物通常为铁铝合金,设计实验证明其含金属铝。
_____________________________
(1)LiAlH4可将乙醛转化为乙醇,LiAlH4作该反应的
(2)配平化学反应方程式。
该反应中H2SO4体现
(3)现有两种浓度的LiOH溶液,已知a溶液的pH大于b溶液,则两种溶液中由水电离的c(H+)大小关系是:a
(4)铝和氧化铁高温下反应得到的熔融物通常为铁铝合金,设计实验证明其含金属铝。
您最近一年使用:0次
名校
解题方法
10 . 现有CO和CO2的混合气体20克,其在标准状况下的体积为11.2L。据此回答下列问题:
(1)该混合气体总的物质的量为______ ,其平均摩尔质量为_______ 。
(2)混合气体中碳原子的个数为________ 。(用NA表示阿伏伽德罗常数的值)
(3)若将该混合气体全部通过下图装置进行实验。

则:①气球中收集的气体是______ ,其质量为_______ 克
②从A瓶中获得沉淀质量的操作是_____ 、称量。
③若要证明A瓶溶液中的阳离子是否沉淀完全,其方法为_______ 。
(1)该混合气体总的物质的量为
(2)混合气体中碳原子的个数为
(3)若将该混合气体全部通过下图装置进行实验。

则:①气球中收集的气体是
②从A瓶中获得沉淀质量的操作是
③若要证明A瓶溶液中的阳离子是否沉淀完全,其方法为
您最近一年使用:0次
2018-03-31更新
|
146次组卷
|
6卷引用:四川省双流中学2017-2018学年高一3月月考化学试题



