名校
解题方法
1 . (1)我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料。请用离子方程式来证明它是一种两性氧化物:___________ 、_________________ .
(2)取等质量的两份某镁铝合金分别加入足量的稀盐酸和氢氧化钠溶液中,产生的标准状况下H2体积分别为33.6L、22.4L则该合金中镁,铝的物质的量之比为___________ 。
(3)Cl2O为国际公认高效安全灭菌消毒剂,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,补充完整并配平方程式:__ Cl2+ Na2CO3+ — NaHCO3+ NaCl+ Cl2O。
(2)取等质量的两份某镁铝合金分别加入足量的稀盐酸和氢氧化钠溶液中,产生的标准状况下H2体积分别为33.6L、22.4L则该合金中镁,铝的物质的量之比为
(3)Cl2O为国际公认高效安全灭菌消毒剂,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,补充完整并配平方程式:
您最近一年使用:0次
解题方法
2 . 一定量的CO2 通入体积为 50mL 的 NaOH 溶液中,为了测定应后溶液的成分,向其中滴加 1.0mol/L 的盐酸,加入盐酸的体积和生成 CO2的体积(标准状况下)的关系如图所示。

(1)OA 段发生反应的离子方程式为:_______________________________ 。
(2)溶液中溶质是:_____________ ,其物质的量之比为______________ 。
(3)原 NaOH 溶液的物质的量浓度为_____________ 。
(4)原 NaOH 溶液中通入 CO2 气体体积_________ mL。
(5)当向 NaOH 溶液中通入少量 CO2时,溶液中的溶质是 NaOH 和 Na2CO3,设计如下实验证明该溶质的组成,请补充完整。

(1)OA 段发生反应的离子方程式为:
(2)溶液中溶质是:
(3)原 NaOH 溶液的物质的量浓度为
(4)原 NaOH 溶液中通入 CO2 气体体积
(5)当向 NaOH 溶液中通入少量 CO2时,溶液中的溶质是 NaOH 和 Na2CO3,设计如下实验证明该溶质的组成,请补充完整。
| 实验方案 | 实验现象 | 实验结论 |
| 取少量溶液于试管中,加入足量 BaCl2溶液 | 说明溶液中含有 Na2CO3 | |
| 说明溶液中含有 NaOH |
您最近一年使用:0次
名校
3 . 铝热反应是铝的一个重要性质,该性质用途十分广泛.“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.已知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如表:
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?_____ (填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是________ ,反应的离子方程式为_____________________ 。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是_________ (填序号)。
A、浓硫酸 B、稀硫酸 C、稀硝酸 D、氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出,此时溶液中氮元素的存在形式只有NO3-和NH4+,铁元素的存在形式为Fe3+,在反应结束后的溶液中,逐滴加入6mol•L﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:

(1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式:___________ ;
(2)在CD段,沉淀的物质的量减少,则此阶段发生反应的离子方程式为________________ ;
(3)熔融物中铝元素的物质的量为_______ mol。
(4)B点对应的沉淀的物质的量为____ mol。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
| 沸点/℃ | 2 467 | 2 980 | 2 750 | ﹣ |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是
A、浓硫酸 B、稀硫酸 C、稀硝酸 D、氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出,此时溶液中氮元素的存在形式只有NO3-和NH4+,铁元素的存在形式为Fe3+,在反应结束后的溶液中,逐滴加入6mol•L﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:

(1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式:
(2)在CD段,沉淀的物质的量减少,则此阶段发生反应的离子方程式为
(3)熔融物中铝元素的物质的量为
(4)B点对应的沉淀的物质的量为
您最近一年使用:0次
名校
解题方法
4 . 完成下列问题
(1)绿矾晶体(FeSO4·7H2O)由于保存不妥或长久放置,容易部分或全部被氧化,现有一瓶绿矾样品,想了解其是否被氧化和被氧化的程度,试选择合适的试剂,根据相关的实验现象进行推测(可供选择的试剂:KSCN溶液、酸性KMnO4溶液、Cl2水、NaOH溶液、BaCl2溶液等)。
①证明其完全没有被氧化的试剂是 现象是_______ ;
②证明其已完全被氧化的试剂是 现象是_______ 。
(2)已知FeSO4·7H2O的溶解度曲线如下图所示,则从硫酸亚铁饱和溶液中提取绿矾晶体采用的操作是_______ 。

(3)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成SPFS可表示成Fex(OH)y(SO4)z•nH2O。工业上常用的一种制备流程为:

取5.349g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀8.155g,向上述滤液中加入NH3•H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.000g。确定该固体聚合硫酸铁样品的化学式。(写计算过程)_______
(1)绿矾晶体(FeSO4·7H2O)由于保存不妥或长久放置,容易部分或全部被氧化,现有一瓶绿矾样品,想了解其是否被氧化和被氧化的程度,试选择合适的试剂,根据相关的实验现象进行推测(可供选择的试剂:KSCN溶液、酸性KMnO4溶液、Cl2水、NaOH溶液、BaCl2溶液等)。
①证明其完全没有被氧化的试剂是 现象是
②证明其已完全被氧化的试剂是 现象是
(2)已知FeSO4·7H2O的溶解度曲线如下图所示,则从硫酸亚铁饱和溶液中提取绿矾晶体采用的操作是

(3)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成SPFS可表示成Fex(OH)y(SO4)z•nH2O。工业上常用的一种制备流程为:

取5.349g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀8.155g,向上述滤液中加入NH3•H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.000g。确定该固体聚合硫酸铁样品的化学式。(写计算过程)
您最近一年使用:0次
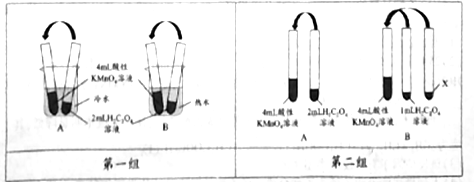
5 . 完成下列有关KMnO4溶液和H2C2O4溶液的实验:
【实验一】用0.01mol/L 酸性KmnO4溶液和0.2mol/L H2C2O4溶液分别进行了如图所示的三组实验,用于探究不同条件对化学反应速率的影响。回答下列问题:
(1)KMnO4溶液需用_____ 进行酸化,参加反应的物质n(KMnO4):n(H2C2O4)=_____ .
(2)第一组实验中褪色时间更长的是:_____ (填“A”或“B”)组实验。
(3)第二组实验中B组实验中X为:__________ 。
(4)第三组实验发现Mn2+能加快该反应的速率,催化剂Y的化学式为_________ 。
【实验二】测定某乙二酸晶体(H2C2O4·xH2O)中的x值,具体操作如下:
(5)滴定:称取2.52g 乙二酸晶体,配成100mL溶液,准确量取25.00mL乙二酸溶液于锥形瓶中,加少量酸酸化,将0.1mol/L KMnO4标准溶液装入_____ (填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,需将锥形瓶摇动一段时间后,紫红色才慢慢褪去,再继续滴加时,紫红色就很快褪去了。出现上述现象的原因是_______ 。待到______ ,证明达到滴定终点。
(6)计算:再重复上述操作3次,记录数据如下表:
则x为__________ 。
(7)误差分析:下列操作会导致测量的乙二酸溶液浓度偏高的是_______ (填序号)
A.配制KMnO4标准溶液定容时,仰视观察刻度线
B.不小心将少量酸性KMnO4标准溶液滴到锥形瓶外
C.滴定前锥形瓶中有少量蒸馏水
D.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
E.观察读数时,滴定前仰视读数,滴定后俯视读数
【实验一】用0.01mol/L 酸性KmnO4溶液和0.2mol/L H2C2O4溶液分别进行了如图所示的三组实验,用于探究不同条件对化学反应速率的影响。回答下列问题:
(1)KMnO4溶液需用
(2)第一组实验中褪色时间更长的是:
(3)第二组实验中B组实验中X为:

(4)第三组实验发现Mn2+能加快该反应的速率,催化剂Y的化学式为
【实验二】测定某乙二酸晶体(H2C2O4·xH2O)中的x值,具体操作如下:
(5)滴定:称取2.52g 乙二酸晶体,配成100mL溶液,准确量取25.00mL乙二酸溶液于锥形瓶中,加少量酸酸化,将0.1mol/L KMnO4标准溶液装入
(6)计算:再重复上述操作3次,记录数据如下表:
实验次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.00 | 20.10 |
2 | 1.00 | 20.90 |
3 | 0.20 | 20.20 |
4 | 0.00 | 22.10 |
则x为
(7)误差分析:下列操作会导致测量的乙二酸溶液浓度偏高的是
A.配制KMnO4标准溶液定容时,仰视观察刻度线
B.不小心将少量酸性KMnO4标准溶液滴到锥形瓶外
C.滴定前锥形瓶中有少量蒸馏水
D.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
E.观察读数时,滴定前仰视读数,滴定后俯视读数
您最近一年使用:0次
6 . 物质的量相关计算。
(1)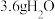 的物质的量是
的物质的量是_______ mol,含有_______ 个中子。
(2)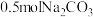 中含
中含_______ mol ,
,_______ 个 。
。
(3)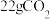 在标准状况下的体积是
在标准状况下的体积是_______ L。
(4)某金属氯化物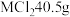 ,含有
,含有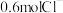 ,则该氯化物的摩尔质量为
,则该氯化物的摩尔质量为_______ 。
(5).碲(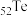 )的某化合物是常用的VCR光盘记录材料之一,可在激光照射下记录、储存信号。已知碲与O同主族,则下列关于碲及其化合物的说法正确的是_______(填字母)。
)的某化合物是常用的VCR光盘记录材料之一,可在激光照射下记录、储存信号。已知碲与O同主族,则下列关于碲及其化合物的说法正确的是_______(填字母)。
(1)
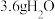 的物质的量是
的物质的量是(2)
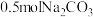 中含
中含 ,
, 。
。(3)
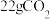 在标准状况下的体积是
在标准状况下的体积是(4)某金属氯化物
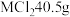 ,含有
,含有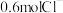 ,则该氯化物的摩尔质量为
,则该氯化物的摩尔质量为(5).碲(
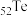 )的某化合物是常用的VCR光盘记录材料之一,可在激光照射下记录、储存信号。已知碲与O同主族,则下列关于碲及其化合物的说法正确的是_______(填字母)。
)的某化合物是常用的VCR光盘记录材料之一,可在激光照射下记录、储存信号。已知碲与O同主族,则下列关于碲及其化合物的说法正确的是_______(填字母)。| A.单质碲在常温下是固体 |
B.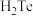 比 比 稳定 稳定 |
C.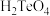 的酸性比 的酸性比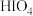 弱 弱 |
D. 通入 通入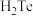 溶液中不发生反应 溶液中不发生反应 |
您最近一年使用:0次
名校
解题方法
7 . 2023年9月23日晚,第19届杭州亚运会开幕式上主火炬被引燃,火炬采用的燃料是甲醇( ),是通过
),是通过 加氢得到的。一种
加氢得到的。一种 的“捕捉”和转化过程如下:在高压时将烟道气中
的“捕捉”和转化过程如下:在高压时将烟道气中 溶解于甲醇(
溶解于甲醇( ),得到二氧化碳的甲醇溶液;用“捕捉”到的二氧化碳与氢气在一定条件下生产甲醇,同时生成水。
),得到二氧化碳的甲醇溶液;用“捕捉”到的二氧化碳与氢气在一定条件下生产甲醇,同时生成水。
(1)常温常压下,用等质量的a. b.
b. c.
c. d.
d. 四种气体分别吹出四个气球,气球体积由大到小排列的顺序是
四种气体分别吹出四个气球,气球体积由大到小排列的顺序是___________ (填序号,假设气球的材质相同)。
(2)下列说法错误的是___________。
(3)每生产1吨这种甲醇,可以消耗___________ 吨 。
。
(4)甲醇燃烧的火焰接近无色,而亚运会火炬的火焰颜色是亮黄色的,很可能是添加了含 和
和___________ (填写离子符号)的盐类。
 ),是通过
),是通过 加氢得到的。一种
加氢得到的。一种 的“捕捉”和转化过程如下:在高压时将烟道气中
的“捕捉”和转化过程如下:在高压时将烟道气中 溶解于甲醇(
溶解于甲醇( ),得到二氧化碳的甲醇溶液;用“捕捉”到的二氧化碳与氢气在一定条件下生产甲醇,同时生成水。
),得到二氧化碳的甲醇溶液;用“捕捉”到的二氧化碳与氢气在一定条件下生产甲醇,同时生成水。(1)常温常压下,用等质量的a.
 b.
b. c.
c. d.
d. 四种气体分别吹出四个气球,气球体积由大到小排列的顺序是
四种气体分别吹出四个气球,气球体积由大到小排列的顺序是(2)下列说法错误的是___________。
| A.整个过程有助于减少温室气体排放 |
| B.二氧化碳的甲醇溶液,溶剂是甲醇 |
| C.转化过程中的“一定条件”可能需要合适的催化剂 |
D.转化过程中发生反应的化学方程式: |
 。
。(4)甲醇燃烧的火焰接近无色,而亚运会火炬的火焰颜色是亮黄色的,很可能是添加了含
 和
和
您最近一年使用:0次
名校
8 . 卤素单质及其化合物是重要的化工原料,用途广泛。
(1)下列关于卤素及其相关物质的说法不正确的是___________。
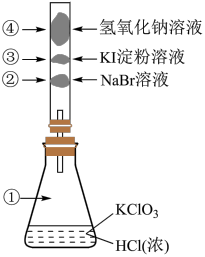
(2)已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是___________ 。
(3)下列关于含卤素物质的实验,说法正确的是___________。
(4)取等浓度的NaBr、NaI的混合溶液,加入一定量氯水后溶液中溶质的情况可能是___________。
(5)将22g NaCl和NaBr的混合粉末溶于水,配成100mL溶液,向溶液中通入足量的Cl2后,将溶液蒸干,得到干燥固体的质量为17.55g,求:
①参加反应中的Cl2在标准状况下的体积为___________ 。
②原混合物中NaCl的物质的量的百分含量为___________ 。(用小数表示,精确到0.01)
(1)下列关于卤素及其相关物质的说法不正确的是___________。
| A.卤素就是氯、溴、碘 | B.氯、溴、碘单质颜色逐渐加深 |
| C.HCl、HBr、HI还原性逐渐增强 | D.卤化银都易见光分解 |
(2)已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是

| ① | ② | ③ | ④ | |
| A | 黄绿色 | 橙色 | 蓝色 | 白色 |
| B | 无色 | 橙色 | 紫色 | 白色 |
| C | 黄绿色 | 橙色 | 蓝色 | 无色 |
| D | 黄绿色 | 无色 | 紫色 | 白色 |
(3)下列关于含卤素物质的实验,说法正确的是___________。
| A.氢气在氯气中燃烧,有苍白色烟雾生成 |
| B.溴水中加入苯振荡,静置后液体分两层,下层为红棕色 |
| C.碘化钾中加入溴水,溶液变黄,说明碘被置换出来 |
| D.卤水都有颜色,都呈酸性 |
(4)取等浓度的NaBr、NaI的混合溶液,加入一定量氯水后溶液中溶质的情况可能是___________。
| A.NaBr、NaI、NaCl | B.NaBr、NaI、NaCl、Br2 |
| C.NaI、NaCl、Br2 | D.NaBr、NaCl、I2 |
(5)将22g NaCl和NaBr的混合粉末溶于水,配成100mL溶液,向溶液中通入足量的Cl2后,将溶液蒸干,得到干燥固体的质量为17.55g,求:
①参加反应中的Cl2在标准状况下的体积为
②原混合物中NaCl的物质的量的百分含量为
您最近一年使用:0次
9 . 某含铬矿石的回收生产中得到BaCrO4的样品,为了测定其中BaCrO4的含量,进行以下实验: =2I−+S4O
=2I−+S4O ;②CrO
;②CrO 的还原产物为Cr3+;③杂质不参与相关反应
的还原产物为Cr3+;③杂质不参与相关反应
1.样品中BaCrO4(摩尔质量为Mg·mol−l)的质量分数为_____ (用字母表示)。
2.若加入的HI溶液过量太多,测定结果会_____。
3.用还原法可以将硝酸厂烟气中的大量氮氧化物(NOx),转化为无害物质。常温下,将NO与H2的混合气体通入Ce(SO4) 2与Ce2 (SO4)3的混合溶液中,其转化过程如图所示。下列说法错误的是_____。
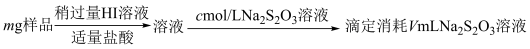
 =2I−+S4O
=2I−+S4O ;②CrO
;②CrO 的还原产物为Cr3+;③杂质不参与相关反应
的还原产物为Cr3+;③杂质不参与相关反应1.样品中BaCrO4(摩尔质量为Mg·mol−l)的质量分数为
2.若加入的HI溶液过量太多,测定结果会_____。
| A.偏高 | B.偏低 | C.无影响 | D.无法确定 |
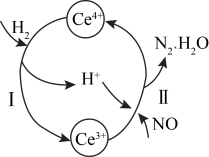
| A.反应I的离子反应方程式为:2Ce4++H2=2Ce3++2H+ |
| B.反应II中氧化剂与还原剂的物质的量之比为1:2 |
| C.反应前溶液中c(Ce4+)一定等于反应后溶液中的c(Ce4+) |
| D.反应过程中混合溶液内Ce3+和Ce4+的总数一定保持不变 |
您最近一年使用:0次
名校
10 . 请根据硫元素的价类二维图,回答下列问题:___________ (填化学式)。
(2)宋代著名法医学家宋慈的 洗冤集录
洗冤集录 中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法
中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法错误 的是___________(填字母)。
(3)Y转化为Z可以选择下列试剂___________ 。
A.酸性KMnO4溶液 B.FeCl2溶液 C.NaOH溶液 D.X的水溶液
写出你所选试剂将Y转化为Z的离子方程式___________ 。
(4)若N是CuSO4,某同学设计了甲和乙两种方法制备:
甲: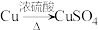 乙:
乙:
①写出甲方法反应的化学方程式:___________ 。
②甲和乙方法更合理的是___________ (填“甲”或“乙”),理由是___________ (答两点)。
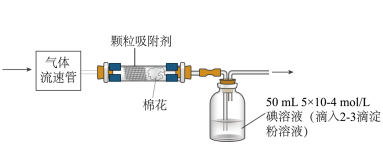
(5)已知空气中SO2的最大允许排放浓度不得超过0.02 mg•L-1,可通过下列装置定量分析空气中SO2的含量。___________ mg•L-1(结果精确到0.001)。

(2)宋代著名法医学家宋慈的
 洗冤集录
洗冤集录 中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法
中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法| A.当银针变黑时,说明所检验的物质中可能有毒 |
| B.银针验毒时,Ag被氧化 |
| C.X在上述验毒反应中作还原剂 |
| D.上述验毒反应中氧化剂和还原剂的物质的量之比为4∶1 |
(3)Y转化为Z可以选择下列试剂
A.酸性KMnO4溶液 B.FeCl2溶液 C.NaOH溶液 D.X的水溶液
写出你所选试剂将Y转化为Z的离子方程式
(4)若N是CuSO4,某同学设计了甲和乙两种方法制备:
甲:
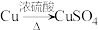 乙:
乙:
①写出甲方法反应的化学方程式:
②甲和乙方法更合理的是
(5)已知空气中SO2的最大允许排放浓度不得超过0.02 mg•L-1,可通过下列装置定量分析空气中SO2的含量。
您最近一年使用:0次
2024-04-29更新
|
242次组卷
|
2卷引用:四川省南充高级中学2023-2024学年高一下学期3月月考化学试题



