1 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.标准状况下,22.4 g 含有的原子数为 含有的原子数为 |
B.标准状况下,11.2 L 含有的分子数大于 含有的分子数大于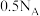 |
C.100 mL 1 mol⋅L 稀硫酸含有的H原子数为 稀硫酸含有的H原子数为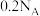 |
D.39 g 与水反应转移的电子数为 与水反应转移的电子数为 |
您最近一年使用:0次
2 . 下列物质中,所含分子数最多的是
| A.0.8mol氦气 | B.标况下,4.48 L二氧化硫 |
| C.3.01×1023个甲烷分子 | D.16 g臭氧 |
您最近一年使用:0次
3 . 已知3.01×1022个X2气体分子的质量为1.6 g,则X的相对原子质量为
| A.16 | B.32 | C.64 | D.96 |
您最近一年使用:0次
名校
4 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.16 g  中含有的电子总数为 中含有的电子总数为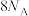 |
B.0.1 mol异丁烷中含有共价键的数目为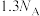 |
C.17 g  通入水中,溶液中 通入水中,溶液中 分子数为 分子数为 |
D.2 mol  与1 mol 与1 mol 的混合气体在一定条件下充分反应,转移的电子数为 的混合气体在一定条件下充分反应,转移的电子数为 |
您最近一年使用:0次
名校
5 . 设NA为阿伏加德罗常数的值,下列叙述中一定正确的是
| A.—定条件下,向0.1L容器内通入4.6 g NO2气体,NO2的物质的量浓度为1mol/L |
| B.标准状况下,2.24 L HF中含有的极性键数目为0.1NA |
| C.50mL0.1mol/LCH3COOH溶液和 10mL0.5mol/LCH3COOH溶液中所含CH3COOH分子数不相等 |
| D.1molFe与高温水蒸气反应,转移电子的数目为3NA |
您最近一年使用:0次
名校
解题方法
6 .  及其盐都是重要的化工原料。
及其盐都是重要的化工原料。
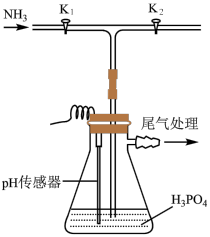
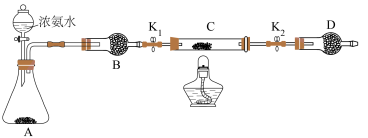
(1)向生石灰中滴加浓氨水,可以快速制取氨气,发生反应的化学方程式为_______ ;盛放浓氨水的仪器名称为_______ ,选用下图中的装置制备干燥的 ,连接顺序为a→
,连接顺序为a→_______ →尾气吸收(按气流方向,用小写字母表示)。_______ 。 性质实验的装置如图。
性质实验的装置如图。_______ ,稳定后,关闭活塞1;再打开活塞2,瓶Ⅱ中的现象是_______ 。
(3)某研究小组用磷酸( )吸收氨气制备干粉灭火剂磷酸氢二铵[
)吸收氨气制备干粉灭火剂磷酸氢二铵[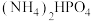 ],装置如图所示。当溶液pH为8.0~9.0时,停止通
],装置如图所示。当溶液pH为8.0~9.0时,停止通 ,即可制得[
,即可制得[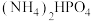 ]溶液。实验过程中,当出现
]溶液。实验过程中,当出现_______ 现象时,应及时关闭 ,打开
,打开 。
。 和
和 混合物,称取该混合物固体样品3.62g,加入足量NaOH溶液,充分反应,生成
混合物,称取该混合物固体样品3.62g,加入足量NaOH溶液,充分反应,生成 896mL(标准状况),
896mL(标准状况),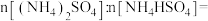
_______ 。
 及其盐都是重要的化工原料。
及其盐都是重要的化工原料。(1)向生石灰中滴加浓氨水,可以快速制取氨气,发生反应的化学方程式为
 ,连接顺序为a→
,连接顺序为a→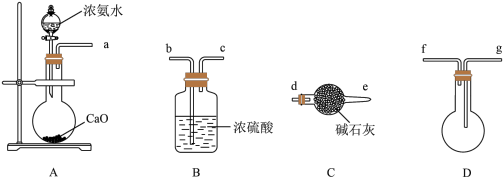
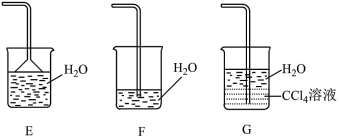
 性质实验的装置如图。
性质实验的装置如图。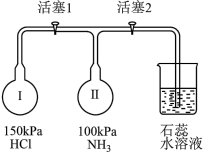
(3)某研究小组用磷酸(
 )吸收氨气制备干粉灭火剂磷酸氢二铵[
)吸收氨气制备干粉灭火剂磷酸氢二铵[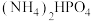 ],装置如图所示。当溶液pH为8.0~9.0时,停止通
],装置如图所示。当溶液pH为8.0~9.0时,停止通 ,即可制得[
,即可制得[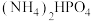 ]溶液。实验过程中,当出现
]溶液。实验过程中,当出现 ,打开
,打开 。
。
 和
和 混合物,称取该混合物固体样品3.62g,加入足量NaOH溶液,充分反应,生成
混合物,称取该混合物固体样品3.62g,加入足量NaOH溶液,充分反应,生成 896mL(标准状况),
896mL(标准状况),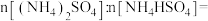
您最近一年使用:0次
名校
7 . 设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.2.3gNa与O2完全反应,转移的电子数为0.2 NA |
| B.常温常压下,22.4LN2所含分子数为NA |
| C.标准状况下,11.2LH2O中含有的原子数为1.5 NA |
D. 的 的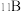 中含有0.6 NA个中子 中含有0.6 NA个中子 |
您最近一年使用:0次
名校
解题方法
8 . Y2-原子核内有x个电子,其质量数为n,则mgY的氧化物所含质子的物质的量为
A.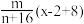 | B.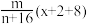 |
C.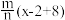 | D.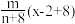 |
您最近一年使用:0次
2024-03-14更新
|
80次组卷
|
2卷引用:南阳华龙高级中学2023-2024学年高一下学期3月月考化学试题
名校
解题方法
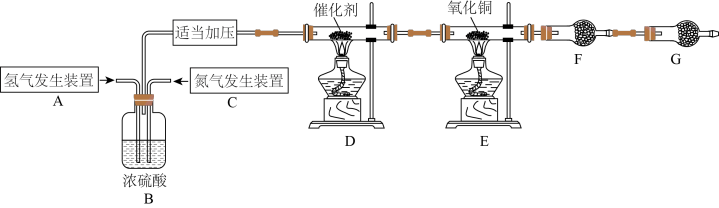
9 . 某学习小组根据氨气还原氧化铜的反应,设计实验测定铜元素相对原子质量Ar(Cu)(近似值)。甲同学模拟合成氨工业制备氨气,反应前先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算Ar(Cu)。装置图如下: 。请回答下列问题:
。请回答下列问题:
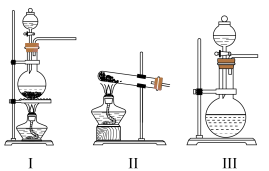
(1)C装置应选用______ (填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(2)装置B的作用是:①使气体混合均匀;②______ ;③______ 。
(3)氨气还原炽热氧化铜(产物之一为空气中含量最多的气体)化学方程式为____________________ 。
(4)干燥管F中盛放的干燥剂为______(填字母代号)。
(5)G装置的作用是①______ ;②______ 。
若没有G装置,测得结果Ar(Cu)______ (填“偏大”“偏小”或“无影响”)。
(6)乙同学认为上述装置操作麻烦,对原装置改进,新装置如图所示。实验前将石英玻璃管(带两端开关K1和K2)(设为装置C)称重,记为m1 g。将氧化铜装入石英玻璃管中,再次将装置C称重,记为m2 g。按下图连接好装置进行实验,通入NH3,充分反应直至C恒重,记为m3 g。______ (填化学式)
②根据实验记录,计算铜元素相对原子质量Ar(Cu)=______ (用含有m1、m2、m3的式子表示)。
 。请回答下列问题:
。请回答下列问题:(1)C装置应选用
(2)装置B的作用是:①使气体混合均匀;②
(3)氨气还原炽热氧化铜(产物之一为空气中含量最多的气体)化学方程式为
(4)干燥管F中盛放的干燥剂为______(填字母代号)。
| A.五氧化二磷 | B.无水CuSO4 | C.碱石灰 | D.无水CaCl2 |
(5)G装置的作用是①
若没有G装置,测得结果Ar(Cu)
(6)乙同学认为上述装置操作麻烦,对原装置改进,新装置如图所示。实验前将石英玻璃管(带两端开关K1和K2)(设为装置C)称重,记为m1 g。将氧化铜装入石英玻璃管中,再次将装置C称重,记为m2 g。按下图连接好装置进行实验,通入NH3,充分反应直至C恒重,记为m3 g。
②根据实验记录,计算铜元素相对原子质量Ar(Cu)=
您最近一年使用:0次
2024-03-12更新
|
585次组卷
|
5卷引用:河南省郑州市宇华实验学校2023-2024学年高一下学期3月月考化学试题
10 . 设 表示阿伏加德罗常数的值,下列说法中正确的个数为
表示阿伏加德罗常数的值,下列说法中正确的个数为
①标准状况下,11.2 L  中所含碳原子数目为
中所含碳原子数目为
②6.9gNa与 完全反应,转移的电子数为
完全反应,转移的电子数为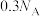
③标准状况下,11.2L 溶于水转移的电子总数为
溶于水转移的电子总数为
④18g 和18g
和18g 中含有的质子数均为
中含有的质子数均为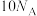
⑤常温常压下,2lg氧气和27g臭氧中含有的氧原子总数为
⑥40 mL 10 mol⋅L 浓盐酸与足量
浓盐酸与足量 充分反应,生成
充分反应,生成 的分子数为
的分子数为
| A.1个 | B.2个 | C.3个 | D.4个 |
您最近一年使用:0次



