名校
1 . 共和国勋章获得者钟南山院士强调,要注意疫情防控常态化,坚持做好日常消毒工作。常见的消毒剂有漂白粉、84消毒液(有效成分NaClO)、双氧水等。
Ⅰ.已知某“84消毒液”瓶体部分标签如下所示:84消毒液:(有效成分)NaClO;(规格)1000mL;(质量分数)25%;(密度)1.19g/cm3
(1)该“84消毒液”的物质的量浓度为_______  (计算结果保留两位有效数字)。
(计算结果保留两位有效数字)。
(2)“84消毒液”与“洁厕灵”(主要成分为盐酸)一起使用反而会弄巧成拙,产生有毒的气体,造成中毒事件。写出反应的离子方程式:_______ ;
(3)实验室用 的浓盐酸配制
的浓盐酸配制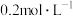 的盐酸240mL;得浓盐酸的体积为
的盐酸240mL;得浓盐酸的体积为_______ mL;使用的定量仪器有_______ 。
(4)84消毒液若与双氧水溶液混合减弱或失去杀菌消毒功能(反应产物之一是 ),解释原因
),解释原因_______ 。
Ⅱ.实验室制备84消毒液的装置如图1所示:
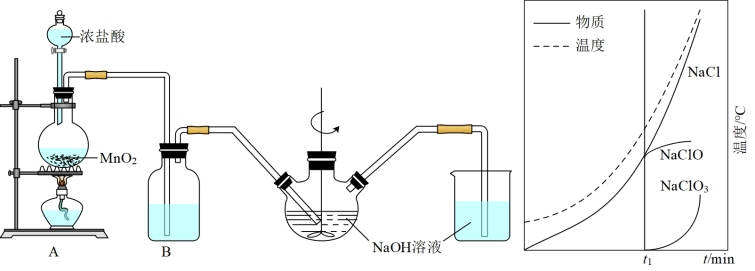
(5)装置B中盛放的试剂是_______ ;简述该装置对制取NaClO的作用_______ 。
(6)三颈烧瓶中生成各物质的物质的量和溶液的温度随时间的变化如图2所示。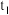 分钟后所发生主要反应的化学方程式为
分钟后所发生主要反应的化学方程式为_______ 。
Ⅰ.已知某“84消毒液”瓶体部分标签如下所示:84消毒液:(有效成分)NaClO;(规格)1000mL;(质量分数)25%;(密度)1.19g/cm3
(1)该“84消毒液”的物质的量浓度为
 (计算结果保留两位有效数字)。
(计算结果保留两位有效数字)。(2)“84消毒液”与“洁厕灵”(主要成分为盐酸)一起使用反而会弄巧成拙,产生有毒的气体,造成中毒事件。写出反应的离子方程式:
(3)实验室用
 的浓盐酸配制
的浓盐酸配制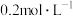 的盐酸240mL;得浓盐酸的体积为
的盐酸240mL;得浓盐酸的体积为(4)84消毒液若与双氧水溶液混合减弱或失去杀菌消毒功能(反应产物之一是
 ),解释原因
),解释原因Ⅱ.实验室制备84消毒液的装置如图1所示:

(5)装置B中盛放的试剂是
(6)三颈烧瓶中生成各物质的物质的量和溶液的温度随时间的变化如图2所示。
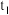 分钟后所发生主要反应的化学方程式为
分钟后所发生主要反应的化学方程式为
您最近一年使用:0次
2 . 实验室里需用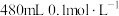 的
的 溶液。现有下列仪器:
溶液。现有下列仪器:
A.烧杯 B.500mL量筒 C.500mL容量瓶 D.玻璃棒 E.天平
(1)用无水 固体配制时,必须使用的仪器有
固体配制时,必须使用的仪器有___________ (填序号),还缺少的玻璃仪器是___________ (写名称)。
(2)用托盘天平称取无水 固体的质量为
固体的质量为___________ g。
(3)假如其他操作均准确无误,下列操作会使所配置溶液浓度偏大的是___________(填序号)。
(4)将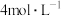 的
的 溶液稀释成
溶液稀释成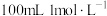 的
的 溶液,需要用量筒量取
溶液,需要用量筒量取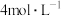 的
的 溶液
溶液___________ mL。
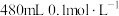 的
的 溶液。现有下列仪器:
溶液。现有下列仪器:A.烧杯 B.500mL量筒 C.500mL容量瓶 D.玻璃棒 E.天平
(1)用无水
 固体配制时,必须使用的仪器有
固体配制时,必须使用的仪器有(2)用托盘天平称取无水
 固体的质量为
固体的质量为(3)假如其他操作均准确无误,下列操作会使所配置溶液浓度偏大的是___________(填序号)。
| A.定容时俯视观察刻度线 |
B.移液时,对用于溶解 的烧杯没有洗涤 的烧杯没有洗涤 |
| C.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水 |
| D.定容后,将容量瓶振荡摇匀,静置时发现液面低于刻度线,又补加水至刻度线 |
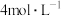 的
的 溶液稀释成
溶液稀释成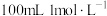 的
的 溶液,需要用量筒量取
溶液,需要用量筒量取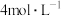 的
的 溶液
溶液
您最近一年使用:0次
2022-01-20更新
|
313次组卷
|
2卷引用:安徽省蚌埠市2021-2022学年高一上学期期末学业水平测试化学试题
3 . 孔雀石铜矿(含Cu、Fe、Al等元素)是工业上提取铁、铜等金属的原材料,某工厂由孔雀石铜矿制备单质铜和绿矾( )的工艺流程如下:
)的工艺流程如下:
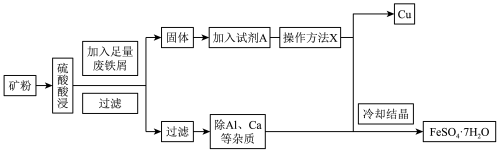
回答下列问题:
(1)试剂A为___________ ,此步骤涉及反应的离子方程式是___________ ,1molA参与上述反应转移电子的物质的量为___________ 。
(2)操作X是___________ 。
(3)实验室需要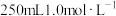 稀硫酸,化学小组用98%浓硫酸(
稀硫酸,化学小组用98%浓硫酸(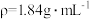 )配制上述稀硫酸,配制过程中可能用到下列仪器:①100mL量筒②25mL量筒③烧杯④托盘天平⑤250mL容量瓶⑥胶头滴管⑦玻璃棒,按使用时出现的先后顺序排列是___________。
)配制上述稀硫酸,配制过程中可能用到下列仪器:①100mL量筒②25mL量筒③烧杯④托盘天平⑤250mL容量瓶⑥胶头滴管⑦玻璃棒,按使用时出现的先后顺序排列是___________。
(4)将稀释后的硫酸转移到容量瓶之前需___________ 。若将稀释后的硫酸立即转移到容量瓶将使所配溶液的物质的量浓度___________ 。(填“偏高”“偏低”或“无影响”)
 )的工艺流程如下:
)的工艺流程如下:
回答下列问题:
(1)试剂A为
(2)操作X是
(3)实验室需要
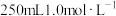 稀硫酸,化学小组用98%浓硫酸(
稀硫酸,化学小组用98%浓硫酸(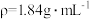 )配制上述稀硫酸,配制过程中可能用到下列仪器:①100mL量筒②25mL量筒③烧杯④托盘天平⑤250mL容量瓶⑥胶头滴管⑦玻璃棒,按使用时出现的先后顺序排列是___________。
)配制上述稀硫酸,配制过程中可能用到下列仪器:①100mL量筒②25mL量筒③烧杯④托盘天平⑤250mL容量瓶⑥胶头滴管⑦玻璃棒,按使用时出现的先后顺序排列是___________。| A.①③⑤⑦⑥ | B.②③⑦⑤⑥ | C.④③⑤⑦⑥ | D.①③⑦⑤⑥ |
您最近一年使用:0次
名校
4 . Ⅰ.共和国勋章获得者钟南山院士强调,要注意疫情防控常态化,坚持做好日常消毒工作。含氯消毒剂在卫生防疫方面起着重要的作用。常见的含氯消毒剂有漂白粉、84消毒液等。
(1)漂白粉和84消毒液具有杀菌消毒功能,主要是因为两者均含有___________ (填离子符号)。
(2)以下实验能鉴别Ca(ClO)2溶液和NaClO溶液的是___________ (填字母序号)。
A.焰色反应 B.加入Na2CO3溶液 C.加入NaCl稀溶液
(3)84消毒液与双氧水溶液混合会发生反应,减弱杀菌消毒功能。该反应生成三种常见物质,其中一种是O2,写出反应的化学方程式:___________ 。
Ⅱ.已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。回答下列问题:
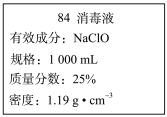
(4)该“84消毒液”的物质的量浓度约为___________ mol·L-1(计算结果保留两位有效数字)。
(5)某同学取50 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中所含钠离子的物质的量n(Na+)=___________ mol。
(6) “84消毒液”与“洁厕灵”(主要成分为盐酸)一起使用反而会弄巧成拙,产生有毒的气体,造成中毒事件。实验室用12.5 mol·L-1的浓盐酸配制0.2 mol·L-1的盐酸240 mL。
①配制240 mL 0.2 mol·L-1的盐酸应量取浓盐酸的体积为___________ mL,应选用___________ mL的容量瓶。
②下列操作对所配溶液的浓度有何影响?(填“偏大”“偏小”或“无影响”)
A.定容时,俯视刻度线,浓度___________ ;
B.用量筒量取浓盐酸时俯视观察凹液面,浓度___________ ;
C.容量瓶在使用前未干燥,里面有少量蒸馏水,浓度___________ 。
(1)漂白粉和84消毒液具有杀菌消毒功能,主要是因为两者均含有
(2)以下实验能鉴别Ca(ClO)2溶液和NaClO溶液的是
A.焰色反应 B.加入Na2CO3溶液 C.加入NaCl稀溶液
(3)84消毒液与双氧水溶液混合会发生反应,减弱杀菌消毒功能。该反应生成三种常见物质,其中一种是O2,写出反应的化学方程式:
Ⅱ.已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。回答下列问题:

(4)该“84消毒液”的物质的量浓度约为
(5)某同学取50 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中所含钠离子的物质的量n(Na+)=
(6) “84消毒液”与“洁厕灵”(主要成分为盐酸)一起使用反而会弄巧成拙,产生有毒的气体,造成中毒事件。实验室用12.5 mol·L-1的浓盐酸配制0.2 mol·L-1的盐酸240 mL。
①配制240 mL 0.2 mol·L-1的盐酸应量取浓盐酸的体积为
②下列操作对所配溶液的浓度有何影响?(填“偏大”“偏小”或“无影响”)
A.定容时,俯视刻度线,浓度
B.用量筒量取浓盐酸时俯视观察凹液面,浓度
C.容量瓶在使用前未干燥,里面有少量蒸馏水,浓度
您最近一年使用:0次
2021-12-21更新
|
279次组卷
|
3卷引用:广西钦州市第一中学2021-2022学年高一上学期期中考试化学试题
解题方法
5 . 实验室用质量分数为20.0%的盐酸配制250mL0.400 稀盐酸。请填写完整以下实验步骤并回答有关问题:
稀盐酸。请填写完整以下实验步骤并回答有关问题:
(1)步骤1:计算。查得室温下20.0%的盐酸密度为1.095 ,则该盐酸的物质的量浓度为
,则该盐酸的物质的量浓度为___________  。进而计算得出配制所需20.0%盐酸的体积。
。进而计算得出配制所需20.0%盐酸的体积。
(2)步骤2:称量。本次实验量取盐酸所需量筒规格为___________ mL。
步骤3:稀释。将量取的盐酸倒入烧杯,再倒入适量蒸馏水,静置,待溶液温度恢复至室温。
(3)步骤4:转移、洗涤。将烧杯中的溶液转移到容量瓶需使用___________ 引流。用适量蒸馏水洗涤烧杯等仪器,洗涤液转入容量瓶,重复2~3次。容量瓶内液面未达瓶颈前将瓶内溶液混匀。
(4)步骤5:定容、摇匀:加蒸馏水至距离刻度线1~2cm处,平视环形刻度线,改用___________ 逐滴加水至凹液面最低处与刻度线相切。摇匀,倒入试剂瓶并贴上标签。
(5)使用容量瓶前必须进行的一步操作是___________ 。
(6)在配制过程中,其他操作都正确,下列操作会引起浓度偏低的是___________ (填字母)。
A.容量瓶洗净后未干燥,有蒸馏水残留
B.量取盐酸后用蒸馏水将量筒内残留盐酸洗出并转入容量瓶
C.稀释盐酸的烧杯未用蒸馏水洗涤
D.转移稀释后的盐酸时少量溶液顺着容量瓶口流至瓶外
E.定容时俯视刻度线
F.摇匀后发现液面低于刻度线,重新定容至刻度线
 稀盐酸。请填写完整以下实验步骤并回答有关问题:
稀盐酸。请填写完整以下实验步骤并回答有关问题:(1)步骤1:计算。查得室温下20.0%的盐酸密度为1.095
 ,则该盐酸的物质的量浓度为
,则该盐酸的物质的量浓度为 。进而计算得出配制所需20.0%盐酸的体积。
。进而计算得出配制所需20.0%盐酸的体积。(2)步骤2:称量。本次实验量取盐酸所需量筒规格为
步骤3:稀释。将量取的盐酸倒入烧杯,再倒入适量蒸馏水,静置,待溶液温度恢复至室温。
(3)步骤4:转移、洗涤。将烧杯中的溶液转移到容量瓶需使用
(4)步骤5:定容、摇匀:加蒸馏水至距离刻度线1~2cm处,平视环形刻度线,改用
(5)使用容量瓶前必须进行的一步操作是
(6)在配制过程中,其他操作都正确,下列操作会引起浓度偏低的是
A.容量瓶洗净后未干燥,有蒸馏水残留
B.量取盐酸后用蒸馏水将量筒内残留盐酸洗出并转入容量瓶
C.稀释盐酸的烧杯未用蒸馏水洗涤
D.转移稀释后的盐酸时少量溶液顺着容量瓶口流至瓶外
E.定容时俯视刻度线
F.摇匀后发现液面低于刻度线,重新定容至刻度线
您最近一年使用:0次
解题方法
6 . 实验是化学的基础,配制一定物质的量浓度溶液是必修1的重要实验,按要求填写下列空白。
(1)用固体配制溶液:某同学按下列步骤配制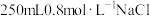 溶液。
溶液。
①实验室提供了以下仪器:烧杯、 量筒、玻璃棒、托盘天平(带砝码)、胶头滴管,还缺少的玻璃仪器是
量筒、玻璃棒、托盘天平(带砝码)、胶头滴管,还缺少的玻璃仪器是_______ 。在所缺少的仪器上无需有的标记是_______ (填字母序号)。
A.浓度B.温度C.刻度线D.容量
②实验步骤:
A.计算所需 的质量并用托盘天平称量
的质量并用托盘天平称量 的质量为
的质量为_______ g。
B.将 加入
加入 烧杯中,并加入适量水完全溶解后,将烧杯中溶液转移至一定容积的容量瓶中,为了防止溶液溅出,应采取的措施是
烧杯中,并加入适量水完全溶解后,将烧杯中溶液转移至一定容积的容量瓶中,为了防止溶液溅出,应采取的措施是_______ 。
C.向容量瓶中加蒸馏水至刻度线,在进行此操作时当加水至刻度线1~2厘米处应如何操作:_______ 。
③取出该 溶液
溶液 加水稀释到
加水稀释到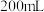 ,稀释后溶液中
,稀释后溶液中 的物质的量浓度是
的物质的量浓度是_______ 。
(2)用浓溶液配制稀溶液:实验室现需要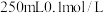 的盐酸溶液,准备用密度为
的盐酸溶液,准备用密度为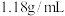 ,质量分数为36.5%浓盐酸来配制。
,质量分数为36.5%浓盐酸来配制。
①浓盐酸的物质的量浓度为_______  。
。
②配制 的盐酸溶液,用量筒量取浓盐酸的体积约为
的盐酸溶液,用量筒量取浓盐酸的体积约为_______  。
。
(3)误差分析:配制 溶液和稀盐酸时,以下操作会使结果偏高的是_______(填字母序号)。
溶液和稀盐酸时,以下操作会使结果偏高的是_______(填字母序号)。
(1)用固体配制溶液:某同学按下列步骤配制
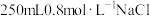 溶液。
溶液。①实验室提供了以下仪器:烧杯、
 量筒、玻璃棒、托盘天平(带砝码)、胶头滴管,还缺少的玻璃仪器是
量筒、玻璃棒、托盘天平(带砝码)、胶头滴管,还缺少的玻璃仪器是A.浓度B.温度C.刻度线D.容量
②实验步骤:
A.计算所需
 的质量并用托盘天平称量
的质量并用托盘天平称量 的质量为
的质量为B.将
 加入
加入 烧杯中,并加入适量水完全溶解后,将烧杯中溶液转移至一定容积的容量瓶中,为了防止溶液溅出,应采取的措施是
烧杯中,并加入适量水完全溶解后,将烧杯中溶液转移至一定容积的容量瓶中,为了防止溶液溅出,应采取的措施是C.向容量瓶中加蒸馏水至刻度线,在进行此操作时当加水至刻度线1~2厘米处应如何操作:
③取出该
 溶液
溶液 加水稀释到
加水稀释到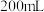 ,稀释后溶液中
,稀释后溶液中 的物质的量浓度是
的物质的量浓度是(2)用浓溶液配制稀溶液:实验室现需要
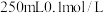 的盐酸溶液,准备用密度为
的盐酸溶液,准备用密度为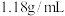 ,质量分数为36.5%浓盐酸来配制。
,质量分数为36.5%浓盐酸来配制。①浓盐酸的物质的量浓度为
 。
。②配制
 的盐酸溶液,用量筒量取浓盐酸的体积约为
的盐酸溶液,用量筒量取浓盐酸的体积约为 。
。(3)误差分析:配制
 溶液和稀盐酸时,以下操作会使结果偏高的是_______(填字母序号)。
溶液和稀盐酸时,以下操作会使结果偏高的是_______(填字母序号)。| A.量取浓盐酸时仰视读数 |
| B.混匀后液面低于刻度线,加水补齐 |
| C.定容时俯视容量瓶瓶颈的刻度线 |
D.未洗涤溶解 的烧杯 的烧杯 |
您最近一年使用:0次
解题方法
7 . 某次实验需要使用480 mL、0.1 mol/L的Na2CO3溶液,现用Na2CO3·10H2O配制该溶液,回答下列问题。
(1)实验中需要称取_______ g Na2CO3·10H2O,溶解前_______ (填“需要”、“不需要”)通过加热方法除去结晶水。
(2)配制步骤可表示如下图所示。
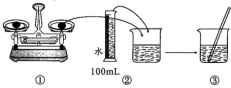

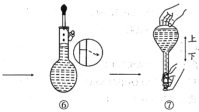
其中有错误的操作是_______ (填“编号”),当液面距刻度线_______ cm时改用胶头滴管滴加蒸馏水。
(3)在配制过程中,下列操作会使溶液浓度偏小的是_______(填字母)。
(4)取20 mL所配溶液与0.2 mol/LBaCl2溶液混合,若二者恰好反应完,则所用BaCl2溶液体积是_______ 。若取10 mL所配制的溶液,将其稀释至50 mL,则稀释后的溶液中c(Na2CO3)=_______ ,所加水的体积_______ (填“等于”、“小于”、“大于”)40 mL。
(1)实验中需要称取
(2)配制步骤可表示如下图所示。



其中有错误的操作是
(3)在配制过程中,下列操作会使溶液浓度偏小的是_______(填字母)。
| A.移液时,未洗涤烧杯内壁和玻璃棒 |
| B.定容时俯视刻度线 |
| C.未冷却到室温就将溶液转移到容量瓶并定容 |
| D.定容后塞上瓶塞反复摇匀,静置后液面低于刻度线,再加水至刻度线 |
您最近一年使用:0次
名校
解题方法
8 . 硫酸和氢氟酸(HF)的溶液可作为矿物中稀有元素的萃取液。实验室模拟生产该萃取液,要求萃取液中硫酸的浓度为2mol·L-1,氢氟酸的浓度为4mol·L-1。现有一批回收酸液共40mL,经测定其中氢氟酸浓度25mol·L-1,硫酸的浓度为1mol·L-1。
(1)现要用此回收酸配制上述萃取液,40mL回收酸液经稀释可以得到4mol·L-1的氢氟酸的体积为___________ mL。
(2)在40mL回收酸中加入___________ mL密度为1.84g·cm-3、浓度为98%的浓硫酸,然后再稀释得到符合要求的萃取液。在此过程中,配制该萃取液所需玻璃仪器有烧杯、玻璃棒、试剂瓶、胶头滴管、量筒和___________ 。若加入浓硫酸后,立刻定容至相应体积,则所得浓度会___________ (填“偏大”或“偏小”或“不变”)
(1)现要用此回收酸配制上述萃取液,40mL回收酸液经稀释可以得到4mol·L-1的氢氟酸的体积为
(2)在40mL回收酸中加入
您最近一年使用:0次
20-21高一上·江苏镇江·阶段练习
名校
9 . 实验室用密度为1.19 g/mL、质量分数为36.5%的浓盐酸配制500 mL 0.100 mol/L盐酸。回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为_______ 。
(2)①该实验中需要用量筒量取上述浓盐酸的体积为_______
②该配制实验中所需要的主要玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、_______ 。
③定容时,向容量瓶中加蒸馏水至液面接近刻度线_______ 处,改用_______ 逐滴滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
(3)配制过程中,下列操作中会导致结果偏高的是_______ (填序号)。
①量取浓盐酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时有少量水
③稀释后立即移液
④移液时不小心有少量液体溅出
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)已知软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) MnCl2+ Cl2↑+2H2O。现将一定量软锰矿石与200ml的浓盐酸反应(杂质不参加反应),制得标况下氯气5.6L。
MnCl2+ Cl2↑+2H2O。现将一定量软锰矿石与200ml的浓盐酸反应(杂质不参加反应),制得标况下氯气5.6L。
求①参加反应的HCl的质量_____
②反应后溶液中MnCl2的物质的量浓度_____ (反应前后溶液的体积不变)
(5)实验室为确定一瓶稀NaOH的浓度,用上述所配的盐酸溶液中和25.00mL该NaOH溶液,当酸与碱恰好完全反应时,消耗盐酸溶液22.50mL。试求该NaOH的物质的量浓度_____ 。
(1)该浓盐酸中HCl的物质的量浓度为
(2)①该实验中需要用量筒量取上述浓盐酸的体积为
②该配制实验中所需要的主要玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、
③定容时,向容量瓶中加蒸馏水至液面接近刻度线
(3)配制过程中,下列操作中会导致结果偏高的是
①量取浓盐酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时有少量水
③稀释后立即移液
④移液时不小心有少量液体溅出
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)已知软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)
 MnCl2+ Cl2↑+2H2O。现将一定量软锰矿石与200ml的浓盐酸反应(杂质不参加反应),制得标况下氯气5.6L。
MnCl2+ Cl2↑+2H2O。现将一定量软锰矿石与200ml的浓盐酸反应(杂质不参加反应),制得标况下氯气5.6L。求①参加反应的HCl的质量
②反应后溶液中MnCl2的物质的量浓度
(5)实验室为确定一瓶稀NaOH的浓度,用上述所配的盐酸溶液中和25.00mL该NaOH溶液,当酸与碱恰好完全反应时,消耗盐酸溶液22.50mL。试求该NaOH的物质的量浓度
您最近一年使用:0次



