解题方法
1 . 下列反应的离子方程式书写正确的是
A. 溶液与醋酸溶液反应: 溶液与醋酸溶液反应: |
B. 溶液与 溶液与 溶液反应: 溶液反应: |
C.电解饱和食盐水: |
D.向 溶液中通入过量的 溶液中通入过量的 : : |
您最近半年使用:0次
名校
2 . 下列离子方程式书写正确的是
A.向苯酚钠溶液中通入少量CO2:2C6H5O-+H2O+CO2→2C6H5OH+ |
B.CuSO4与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O=Cu(OH)2↓+2 |
C.1-溴丙烷与NaOH水溶液共热:CH3CH2CH2Br+OH- CH3CH=CH2↑+Br-+H2O CH3CH=CH2↑+Br-+H2O |
D.乙醇被酸性KMnO4溶液氧化成乙酸:5CH3CH2OH+4 +12H+=5CH3COOH+4Mn2++11H2O +12H+=5CH3COOH+4Mn2++11H2O |
您最近半年使用:0次
昨日更新
|
116次组卷
|
2卷引用:安徽省六安第一中学2023-2024学年高二下学期期中考试化学试题
3 . 海水提溴
(1)主要流程
Cl2+2Br-=Br2+2Cl-(氧化)
Br2+SO2+2H2O=2HBr+H2SO4(富集)
Cl2+2Br-=_______ (提取)
(1)主要流程
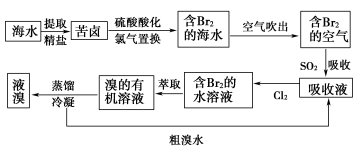
Cl2+2Br-=Br2+2Cl-(氧化)
Br2+SO2+2H2O=2HBr+H2SO4(富集)
Cl2+2Br-=
您最近半年使用:0次
2024高三·全国·专题练习
4 . 稀有金属元素铼(Re)和锰同族,铼和钛是航天工程不可缺少的材料。某烟道灰的主要成分为Re2O7、TiO2、SiO2、CuO、 Fe2O3,从中提取铼粉和钛的流程如图所示: 被Zn还原为+4价的铼。ZnO为两性氧化物,溶于碱生成ZnO
被Zn还原为+4价的铼。ZnO为两性氧化物,溶于碱生成ZnO 。
。
回答下列问题:
(1)“碱浸”过程Re2O7、SiO2分别发生反应的离子方程式为___________ 、___________ 。
(2)“氧化溶解”过程中Re(OH)4转化为ReO ,该反应中还原剂与氧化剂的物质的量之比为
,该反应中还原剂与氧化剂的物质的量之比为___________ 。
(3)“酸溶”过程得到的钛在溶液中以TiO2+形式存在,其“水解”反应的离子方程式为___________ 。
(4)“转化”过程中加入Fe的作用是___________ ;所得晶体主要成分的化学式中含有7个结晶水,其化学式是___________ 。
(5)“冶钛”过程中将TiO2先转化为TiCl4,再用Mg进行还原,写出高温条件下用Mg还原TiCl4的化学方程式:___________ 。
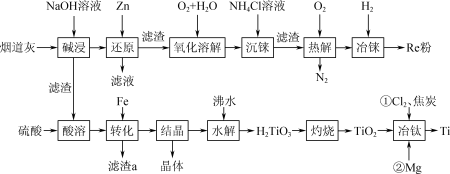
 被Zn还原为+4价的铼。ZnO为两性氧化物,溶于碱生成ZnO
被Zn还原为+4价的铼。ZnO为两性氧化物,溶于碱生成ZnO 。
。回答下列问题:
(1)“碱浸”过程Re2O7、SiO2分别发生反应的离子方程式为
(2)“氧化溶解”过程中Re(OH)4转化为ReO
 ,该反应中还原剂与氧化剂的物质的量之比为
,该反应中还原剂与氧化剂的物质的量之比为(3)“酸溶”过程得到的钛在溶液中以TiO2+形式存在,其“水解”反应的离子方程式为
(4)“转化”过程中加入Fe的作用是
(5)“冶钛”过程中将TiO2先转化为TiCl4,再用Mg进行还原,写出高温条件下用Mg还原TiCl4的化学方程式:
您最近半年使用:0次
2024高三下·全国·专题练习
解题方法
5 . 废旧铅蓄电池的铅膏中主要含有 、
、 、
、 和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
一定条件下,一些金属氢氧化物沉淀时的 如下表:
如下表:
回答下列问题:
(1)在“脱硫”中 转化反应的离子方程式为
转化反应的离子方程式为________ ,用沉淀溶解平衡原理解释选择 的原因
的原因________ 。
(2)在“脱硫”中,加入 不能使铅膏中
不能使铅膏中 完全转化,原因是
完全转化,原因是________ 。
(3)在“酸浸”中,除加入醋酸( ),还要加入
),还要加入 。
。
(ⅰ)能被 氧化的离子是
氧化的离子是________ ;
(ⅱ) 促进了金属Pb在醋酸中转化为
促进了金属Pb在醋酸中转化为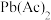 ,其化学方程式为
,其化学方程式为________ ;
(ⅲ) 也能使
也能使 转化为
转化为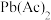 ,
, 的作用是
的作用是________ 。
 、
、 、
、 和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。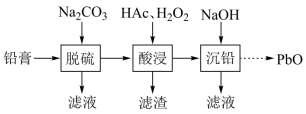
| 难溶电解质 |  |  |  |  |
 | 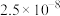 | 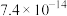 | 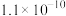 |  |
 如下表:
如下表:| 金属氢氧化物 |  |  |  | 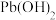 |
| 开始沉淀的pH | 2.3 | 6.8 | 3.5 | 7.2 |
| 完全沉淀的pH | 3.2 | 8.3 | 4.6 | 9.1 |
(1)在“脱硫”中
 转化反应的离子方程式为
转化反应的离子方程式为 的原因
的原因(2)在“脱硫”中,加入
 不能使铅膏中
不能使铅膏中 完全转化,原因是
完全转化,原因是(3)在“酸浸”中,除加入醋酸(
 ),还要加入
),还要加入 。
。(ⅰ)能被
 氧化的离子是
氧化的离子是(ⅱ)
 促进了金属Pb在醋酸中转化为
促进了金属Pb在醋酸中转化为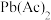 ,其化学方程式为
,其化学方程式为(ⅲ)
 也能使
也能使 转化为
转化为 ,
, 的作用是
的作用是
您最近半年使用:0次
6 . 由CuSO4溶液制取[Cu(NH3)4]SO4·H2O的实验如下:
步骤1:向盛有4mL0.1mol·L-1CuSO4溶液的试管中,滴加几滴1mol·L-1氨水,有蓝色沉淀生成。
步骤2:继续滴加氨水并振荡试管,沉淀溶解,得到深蓝色溶液。
步骤3:向试管中加入8mL95%乙醇,并用玻璃棒摩擦试管壁,有深蓝色晶体析出。
下列说法正确的是
步骤1:向盛有4mL0.1mol·L-1CuSO4溶液的试管中,滴加几滴1mol·L-1氨水,有蓝色沉淀生成。
步骤2:继续滴加氨水并振荡试管,沉淀溶解,得到深蓝色溶液。
步骤3:向试管中加入8mL95%乙醇,并用玻璃棒摩擦试管壁,有深蓝色晶体析出。
下列说法正确的是
| A.1mol[Cu(NH3)4]2+含有12mol共价键 |
| B.步骤2所发生反应的离子方程式为Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- |
| C.步骤3中用玻璃棒摩擦试管壁是为了防止晶体析出时附着在试管壁上 |
| D.H2O与Cu2+的配位能力大于NH3 |
您最近半年使用:0次
2024高三·全国·专题练习
解题方法
7 . 宏观辨识与微观探析是化学学科核心素养之一。下列化学反应表示正确的是
A.苯酚钠溶液通入CO2后变浑浊: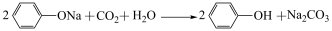 |
B.向FeSO4溶液中加入NH4HCO3溶液得到FeCO3沉淀:Fe2++HCO =FeCO3↓+H+ =FeCO3↓+H+ |
C.强碱溶液中ClO-与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO +3Cl-+H2O+4H+ +3Cl-+H2O+4H+ |
| D.用少量氨水吸收废气中的SO2:NH3·H2O+SO2=NH4HSO3 |
您最近半年使用:0次
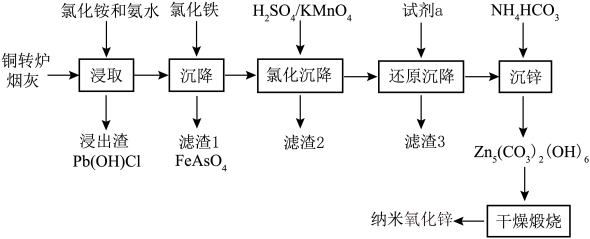
8 . 纳米氧化锌具有颗粒微小、比表面积大、分散性好、疏松多孔等物理特性和极强的化学活性,目前已广泛用于橡胶、陶瓷、催化剂、涂料和磁性材料的辅助生产。以铜转炉烟灰为原料,采用浸取、均相沉淀、干燥煅烧等工艺制备纳米氧化锌的工艺方法过程简单,生产成本低。具体流程如下:
铜转炉烟灰主要化学成分分析结果/%
以上金属元素在铜转炉烟灰中均以硫酸盐和氧化物形式存在,砷以砷酸盐形式存在。
流程中涉及离子的氢氧化物溶度积常数如下表:
请回答下列问题:
(1)“浸取”温度应选择40℃左右为宜。温度高于40℃,浸出率随温度升高而降低的原因可能是___________ 。
(2)若“浸取”所得滤液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___________ 。
(3)在“沉降”过程中,FeCl3作沉淀剂可起到两点作用,一是与砷酸根结合生成FeAsO4沉淀,二是___________ ,缩短沉降时间。
(4)用酸性高锰酸钾溶液“氧化沉降”时,需调整溶液pH=5,使还原产物为MnO2,滤渣2的主要成分为___________ (填化学式)。
(5)“还原沉降”选用的“试剂a”为___________ (填化学式)。
(6)“沉锌”反应的离子方程式为___________ 。
(7)若想通过“干燥煅烧”得到更多活性较高的纳米氧化锌,应在“沉锌”时注意调整HCO 和Zn2+的浓度,以保证最终沉淀物粒径在1μm以下,通过下表可判断,当Zn2+的浓度恒定在0.8mol·L-1时,HCO
和Zn2+的浓度,以保证最终沉淀物粒径在1μm以下,通过下表可判断,当Zn2+的浓度恒定在0.8mol·L-1时,HCO 的浓度为
的浓度为___________ ,沉淀物的粒径最佳。
铜转炉烟灰主要化学成分分析结果/%
| Cu | Zn | Pb | Fe(Ⅱ) | As |
| 10.30 | 8.75 | 19.07 | 2.51 | 4.68 |
流程中涉及离子的氢氧化物溶度积常数如下表:
| 离子 | Cu2+ | Zn2+ | Fe2+ | Fe3+ |
| Ksp | 2.2×10-20 | 6.7×10-17 | 8.0×10-16 | 4.0×10-38 |
(1)“浸取”温度应选择40℃左右为宜。温度高于40℃,浸出率随温度升高而降低的原因可能是
(2)若“浸取”所得滤液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为
(3)在“沉降”过程中,FeCl3作沉淀剂可起到两点作用,一是与砷酸根结合生成FeAsO4沉淀,二是
(4)用酸性高锰酸钾溶液“氧化沉降”时,需调整溶液pH=5,使还原产物为MnO2,滤渣2的主要成分为
(5)“还原沉降”选用的“试剂a”为
(6)“沉锌”反应的离子方程式为
(7)若想通过“干燥煅烧”得到更多活性较高的纳米氧化锌,应在“沉锌”时注意调整HCO
 和Zn2+的浓度,以保证最终沉淀物粒径在1μm以下,通过下表可判断,当Zn2+的浓度恒定在0.8mol·L-1时,HCO
和Zn2+的浓度,以保证最终沉淀物粒径在1μm以下,通过下表可判断,当Zn2+的浓度恒定在0.8mol·L-1时,HCO 的浓度为
的浓度为n(HCO )/n(Zn2+) )/n(Zn2+) | 粒度分布质量分数/% | ||||
| 0.0~0.1μm | 0.1~0.5μm | 0.5~1.0μm | 1.0~5.0μm | 5.0μm以上 | |
| 2 | 25.3 | 38.41 | 34.55 | 1.74 | 0.001 |
| 2.5 | 40.82 | 50.35 | 8.37 | 0.46 | 0.001 |
| 3 | 35.2 | 55.37 | 8.2 | 1.23 | 0.001 |
您最近半年使用:0次
9 . 明矾[KAl(SO4)2·12H2O]是重要的化工原料,下列与明矾相关的实验设计中,所得结论错误的是
| 选项 | 实验方案 | 现象 | 结论 |
| A | 用铂丝蘸取明矾溶液置于无色火焰上灼烧 | 灼烧时火焰呈紫色 | 明矾中含有K+ |
| B | 向明矾溶液中加入Na2CO3溶液 | 有白色沉淀生成和气泡逸出 | Al3+与CO 在水溶液中发生离子反应:2Al3++3CO 在水溶液中发生离子反应:2Al3++3CO +3H2O=2Al(OH)3↓+3CO2↑ +3H2O=2Al(OH)3↓+3CO2↑ |
| C | 向明矾溶液中加入一定量的Ba(OH)2溶液 | 有白色沉淀生成 | 有BaSO4和Al(OH)3沉淀生成 |
| D | 明矾溶液中加入过量NaF后再加浓氨水 | 无白色沉淀生成 | Al3+会与F-反应,且反应后溶液中的Al3+浓度很低 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2024高三·全国·专题练习
10 . 下列说法错误的是
A.向硫酸铵溶液中加入氢氧化钡溶液,发生反应的离子方程式为Ba2++SO =BaSO4↓ =BaSO4↓ |
| B.漂白粉与洁厕剂(含盐酸)混用可能有氯气产生 |
| C.高纯硅可以制成计算机、通信设备和家用电器等的芯片,以及光伏电站、人造卫星和电动汽车等的硅太阳能电池 |
| D.常温下,铁、铝与浓硫酸能发生反应 |
您最近半年使用:0次



