名校
1 . 铜是生物必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式_____________________________ 。
(2)为了保护环境和节约资源,通常先用 和稀硫酸的混合溶液溶出废旧卬刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式
和稀硫酸的混合溶液溶出废旧卬刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式__________________________ 。
(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜,该工艺的中间过程会发生反应: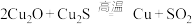 ,该反应的氧化剂是
,该反应的氧化剂是________ ;当生成 时,反应中转移的电子为
时,反应中转移的电子为______  。
。
(4)研究性学习小组用“间接碘量法”测定某试样中 (不含能与I-反应的氧化性杂质)的含量,取
(不含能与I-反应的氧化性杂质)的含量,取 试样配成
试样配成 溶液,每次取
溶液,每次取 ,滴加
,滴加 溶液后有白色碘化物沉淀生成,写出该反应的离子方程式
溶液后有白色碘化物沉淀生成,写出该反应的离子方程式__________________________ 。
(5)继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫化硫酸钠标准溶液滴定,发生反应的化学方程式为: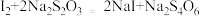 ,平均消耗
,平均消耗 的
的 溶液
溶液 。则试样中
。则试样中 的质量分数为
的质量分数为______________________ 。
(1)写出铜与稀硝酸反应的化学方程式
(2)为了保护环境和节约资源,通常先用
 和稀硫酸的混合溶液溶出废旧卬刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式
和稀硫酸的混合溶液溶出废旧卬刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜,该工艺的中间过程会发生反应:
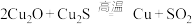 ,该反应的氧化剂是
,该反应的氧化剂是 时,反应中转移的电子为
时,反应中转移的电子为 。
。(4)研究性学习小组用“间接碘量法”测定某试样中
 (不含能与I-反应的氧化性杂质)的含量,取
(不含能与I-反应的氧化性杂质)的含量,取 试样配成
试样配成 溶液,每次取
溶液,每次取 ,滴加
,滴加 溶液后有白色碘化物沉淀生成,写出该反应的离子方程式
溶液后有白色碘化物沉淀生成,写出该反应的离子方程式(5)继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫化硫酸钠标准溶液滴定,发生反应的化学方程式为:
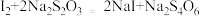 ,平均消耗
,平均消耗 的
的 溶液
溶液 。则试样中
。则试样中 的质量分数为
的质量分数为
您最近一年使用:0次
2020-04-29更新
|
123次组卷
|
2卷引用:天津市滨海新区塘沽一中2020届高三第一次月考
解题方法
2 . 根据所学知识,回答下列问题:
(1)高铁酸钠(Na2FeO4)可作为高效、多功能水处理剂,其摩尔质量是__________ 。高铁酸钠可与水反应生成Fe(OH)3胶体、氢氧化钠和氧气,写出相应的离子方程式:_____________ 。
(2)戴维通过电解法首先制得了金属钠,随后几十年内,工业上采用铁粉和氢氧化钠高温熔融的方法制得钠蒸气,同时获得Fe3O4和氢气。写出该反应的化学方程式_____________ ,该反应中属于电解质但不属于氧化物的物质是________________ (填化学式),若制得22.4L(折算为标准状况下)钠蒸气,转移电子的数目为________________ 。
(3)漂白粉常用于饮水、污水、排泄物及被污染的环境消毒,其主要成分是氯化钙和次氯酸钙[Ca(ClO)2],有效成分为次氯酸钙。为测得某漂白粉的有效成分含量,称取A g漂白粉样品溶解,往所得溶液中通入CO2至不再产生沉淀为止,反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,若反应生成次氯酸(HClO)的物质的量为Kmol,则该漂白粉中有效成分的质量分数为___________ %(用含A、K的式子表示)。
(1)高铁酸钠(Na2FeO4)可作为高效、多功能水处理剂,其摩尔质量是
(2)戴维通过电解法首先制得了金属钠,随后几十年内,工业上采用铁粉和氢氧化钠高温熔融的方法制得钠蒸气,同时获得Fe3O4和氢气。写出该反应的化学方程式
(3)漂白粉常用于饮水、污水、排泄物及被污染的环境消毒,其主要成分是氯化钙和次氯酸钙[Ca(ClO)2],有效成分为次氯酸钙。为测得某漂白粉的有效成分含量,称取A g漂白粉样品溶解,往所得溶液中通入CO2至不再产生沉淀为止,反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,若反应生成次氯酸(HClO)的物质的量为Kmol,则该漂白粉中有效成分的质量分数为
您最近一年使用:0次
3 . CaO2难溶于水,溶于酸生成过氧化氢,在医药上用作杀菌剂、防腐剂等。
Ⅰ.CaO2制备原理:Ca(OH)2(s)+H2O2(aq)=CaO2(s)+2H2O(l);ΔH<0
不同浓度的H2O2对反应生成CaO2产率的影响如下表:
(1)分析题给信息,解释H2O2浓度大于20%后CaO2产率反而减小的原因:___________ 。
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量。
步骤1:准确称取0.04~0.05g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:分别加入30mL蒸馏水和2 mL盐酸(3mol∙L-1),振荡使之溶解;
步骤3:向锥形瓶中加入5mLKI溶液(100g·L-1);
步骤4:用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后________ ,用硫代硫酸钠标准溶液继续滴定,________ ,记录数据;
步骤5:平行测定3次,计算试样中CaO2的质量分数。滴定时发生的反应为2Na2S2O3+I2=Na2S4O6+2NaI。
(2)过氧化钙溶解时选用盐酸而不选用硫酸溶液的原因是___________ 。
(3)加入KI溶液后发生反应的离子方程式为____________ 。
(4)请补充完整实验步骤4中的内容:____________ ;____________ 。
Ⅰ.CaO2制备原理:Ca(OH)2(s)+H2O2(aq)=CaO2(s)+2H2O(l);ΔH<0
不同浓度的H2O2对反应生成CaO2产率的影响如下表:
| H2O2/% | 5 | 10 | 15 | 20 | 25 | 30 |
| CaO2/% | 62.40 | 63.10 | 63.20 | 64.54 | 62.42 | 60.40 |
(1)分析题给信息,解释H2O2浓度大于20%后CaO2产率反而减小的原因:
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量。
步骤1:准确称取0.04~0.05g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:分别加入30mL蒸馏水和2 mL盐酸(3mol∙L-1),振荡使之溶解;
步骤3:向锥形瓶中加入5mLKI溶液(100g·L-1);
步骤4:用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后
步骤5:平行测定3次,计算试样中CaO2的质量分数。滴定时发生的反应为2Na2S2O3+I2=Na2S4O6+2NaI。
(2)过氧化钙溶解时选用盐酸而不选用硫酸溶液的原因是
(3)加入KI溶液后发生反应的离子方程式为
(4)请补充完整实验步骤4中的内容:
您最近一年使用:0次
14-15高三上·江苏南通·阶段练习
4 . 钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为______ ;步骤③中反应的离子方程式为:______ 。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将______ (填“偏高”、或“偏低”或“不变”)。
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程______ 。
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程
您最近一年使用:0次
5 . 某研究性学习小组欲由硫铁矿烧渣(主要成分为Fe、Fe2O3、SiO2、Al2O3)制备绿矾(FeSO4·7H2O)并测定烧渣中铁元素的含量,流程图如下:

(1)操作a的名称是_____________ 。
(2)加入足量试剂X后,发生反应的离子方程式为_____________ 、_____________ 。
(3)向溶液2中滴加KSCN溶液,无明显现象。向固体中加入足量稀硫酸后,发生氧化还原反应的离子方程式是_______ 、_________ 。
(4)硫铁矿烧渣中铁元素的质量分数为________ 。

(1)操作a的名称是
(2)加入足量试剂X后,发生反应的离子方程式为
(3)向溶液2中滴加KSCN溶液,无明显现象。向固体中加入足量稀硫酸后,发生氧化还原反应的离子方程式是
(4)硫铁矿烧渣中铁元素的质量分数为
您最近一年使用:0次
6 . CoCl2·6H2O是一种饲料营养强化剂。工业上利用水钴矿〔主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等〕制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)水钴矿进行预处理时加入Na2SO3的主要作用是____________________ 。
(2)写出NaClO3在浸出液中发生主要反应的离子方程式_______________________ ;
若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式_____________________ 。
(3) “操作1”中包含3个基本实验操作,它们依次是_______________ 、________________ 和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________ 。
(4)浸出液加Na2CO3调pH至5.2时,过滤所得到的沉淀成分为________________ 。
(5)萃取剂的作用是__________________ 。
(6)为测定粗产品中CoCl2·6H2O的含量,称取16.4克的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤,将沉淀烘干后称其质量为4.6克。则粗产品中CoCl2·6H2O的质量分数是________________ 。

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)水钴矿进行预处理时加入Na2SO3的主要作用是
(2)写出NaClO3在浸出液中发生主要反应的离子方程式
若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式
(3) “操作1”中包含3个基本实验操作,它们依次是
(4)浸出液加Na2CO3调pH至5.2时,过滤所得到的沉淀成分为
(5)萃取剂的作用是
(6)为测定粗产品中CoCl2·6H2O的含量,称取16.4克的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤,将沉淀烘干后称其质量为4.6克。则粗产品中CoCl2·6H2O的质量分数是
您最近一年使用:0次
7 . 某铝合金中含有铁、铝、镁、铜、硅。为了测定该合金中铝的含量,现设计了如下实验:

已知:Si+2NaOH+H2O=Na2 Si O3+2H2↑,H2Si O3是不溶于水的弱酸。
(1)固体A的成分是:____________ ,溶液M中的阴离子有:____________________
(2)步骤③中生成沉淀的离子方程式为:_____________________________________
(3)步骤④中,用到的仪器有三脚架、酒精灯以及________________________________
(4)在空气中将NaOH溶液滴入FeCl2溶液中,观察到的现象是_____________________ ,反应的化学方程式是________________________ ,_____________________
(5)该样品中铝的质量分数是:_______________________________ (用a、b表示)。
(6)下列因操作不当,会使测定结果偏大的是___________

已知:Si+2NaOH+H2O=Na2 Si O3+2H2↑,H2Si O3是不溶于水的弱酸。
(1)固体A的成分是:
(2)步骤③中生成沉淀的离子方程式为:
(3)步骤④中,用到的仪器有三脚架、酒精灯以及
(4)在空气中将NaOH溶液滴入FeCl2溶液中,观察到的现象是
(5)该样品中铝的质量分数是:
(6)下列因操作不当,会使测定结果偏大的是
| A.第①步中加入NaOH溶液不足 | B.第②步中加入盐酸不足时 |
| C.第④步中的沉淀未用蒸馏水洗涤 | D.第④步对沉淀灼烧不充分 |
您最近一年使用:0次
名校
8 . 某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其它成分不与盐酸反应或氢氧化钠反应):
①配制0.100 稀盐酸和0.100
稀盐酸和0.100 氢氧化钠溶液;
氢氧化钠溶液;
②取一粒药片(0.10g)研碎后加入20.0 蒸馏水;
蒸馏水;
③用0.100 氢氧化钠溶液中和过量的稀盐酸,记录所消耗的体积;
氢氧化钠溶液中和过量的稀盐酸,记录所消耗的体积;
④加入25.0 0.100
0.100 稀盐酸。请回答下列问题:
稀盐酸。请回答下列问题:
(1)测定过程的正确操作顺序为_______________________ (填序号)。
(2)测定过程中发生反应的离子方程式_________________ 、______________________ 。
(3)该测定实验共进行了五次。实验室现有50 、100
、100 、250
、250 、500
、500 4种规格的容量瓶,则配制盐酸应选用的容量瓶的规格为
4种规格的容量瓶,则配制盐酸应选用的容量瓶的规格为_________ ,理由是______________________ 。
(4)某同学4次测定所消耗的 溶液的体积如下:
溶液的体积如下:
请根据这位同学的实验数据,计算药片中碳酸钙的质量分数____________________ 。
①配制0.100
 稀盐酸和0.100
稀盐酸和0.100 氢氧化钠溶液;
氢氧化钠溶液;②取一粒药片(0.10g)研碎后加入20.0
 蒸馏水;
蒸馏水;③用0.100
 氢氧化钠溶液中和过量的稀盐酸,记录所消耗的体积;
氢氧化钠溶液中和过量的稀盐酸,记录所消耗的体积;④加入25.0
 0.100
0.100 稀盐酸。请回答下列问题:
稀盐酸。请回答下列问题:(1)测定过程的正确操作顺序为
(2)测定过程中发生反应的离子方程式
(3)该测定实验共进行了五次。实验室现有50
 、100
、100 、250
、250 、500
、500 4种规格的容量瓶,则配制盐酸应选用的容量瓶的规格为
4种规格的容量瓶,则配制盐酸应选用的容量瓶的规格为(4)某同学4次测定所消耗的
 溶液的体积如下:
溶液的体积如下:测定次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 13.00 | 12.90 | 12.95 | 13.10 | 13.05 |
您最近一年使用:0次
9 . 已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓) CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于___________ (用字母代号填写)
A.酸 B.非电解质 C.盐 D. 酸性氧化物
(2)SO2与O2的混合气体中,氧元素的质量分数为70%,则SO2与O2的物质的量之比是___________ ,
(3)一定量的铜片与200mL18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的物质的量为___________ mol,
(4)将反应后所得到的CuSO4溶液与足量Ba(OH)2溶液充分反应的离子方程式是___________
 CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:(1)A物质可以导致酸雨的形成。则A应该属于
A.酸 B.非电解质 C.盐 D. 酸性氧化物
(2)SO2与O2的混合气体中,氧元素的质量分数为70%,则SO2与O2的物质的量之比是
(3)一定量的铜片与200mL18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的物质的量为
(4)将反应后所得到的CuSO4溶液与足量Ba(OH)2溶液充分反应的离子方程式是
您最近一年使用:0次
2020-12-19更新
|
157次组卷
|
2卷引用:江西省余干县新时代学校2020-2021学年高一上学期阶段测试(二)化学试题
解题方法
10 . 现有三种可溶性物质A、B、C,其中有一种是碱,两种是盐,溶于水后电离产生的离子如表所示:
为鉴别它们,分别完成一些实验。请根据实验的结果回答下列问题:
(1)A溶液与B溶液反应可生成气体X。A溶液与B溶液反应的离子方程式为______ 。
(2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应。则C的化学式为______ ,B溶于水后的电离方程式为______ 。
(3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E.B溶液与C溶液反应至中性的离子方程式为______ 。
(4)D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为bL,则求算E在混合物中的质量分数的表达式为______ 。
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO SO SO |
为鉴别它们,分别完成一些实验。请根据实验的结果回答下列问题:
(1)A溶液与B溶液反应可生成气体X。A溶液与B溶液反应的离子方程式为
(2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应。则C的化学式为
(3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E.B溶液与C溶液反应至中性的离子方程式为
(4)D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为bL,则求算E在混合物中的质量分数的表达式为
您最近一年使用:0次




