1 . 氮是生命所需的重要元素,是蛋白质的重要组成部分。亚硝酸(HNO2)是一种亮蓝色的弱酸,电离平衡常数为4.6×10-4;亚硝酸既有氧化性,又有还原性。亚硝酸溶液微热即分解。亚硝酸钠(NaNO2)是肉制品生产中最常使用的一种食品添加剂。氨气的燃烧热316.25kJ·mol-1,肼(N2H4)为无色油状液体,有类似于氨的刺鼻气味,是一种强极性化合物。下列说法正确的是
A.HNO2与KMnO4酸性溶液反应:5NO +2 +2 +6H+=5 +6H+=5 +2Mn2++3H2O +2Mn2++3H2O |
| B.氨气燃烧的热化学方程式:4NH3(g)+3O2(g)=6H2O(g)+2N2(g) ΔH=-1265kJ·mol-1 |
| C.肼(N2H4)—空气碱性燃料电池的负极反应:N2H4+4e-=4H++N2↑ |
| D.氢氧化铜溶于氨水的化学方程式:Cu(OH)2+4NH3=[Cu(NH3)4](OH)2 |
您最近半年使用:0次
2 . 为了探究铁及其化合物的氧化性和还原性,某同学设计如下实验方案,其中符合实验要求且完全正确的是
| 选项 | 实验操作 | 实验现象 | 离子反应 | 实验结论 |
| A | 在氯化亚铁溶液中滴加新制氯水 | 浅绿色溶液变成棕黄色溶液 |  |  具有还原性 具有还原性 |
| B | 在氯化亚铁溶液中加入锌片 | 浅绿色溶液变成无色溶液 |  |  具有氧化性 具有氧化性 |
| C | 在氯化铁溶液中加入铁粉 | 棕黄色溶液变成浅绿色溶液 | 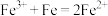 | 铁单质具有还原性 |
| D | 在氯化铁溶液中加入铜粉 | 蓝色溶液变成棕黄色溶液 | 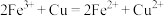 |  具有氧化性 具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2020高三·全国·专题练习
3 . 为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验方案,其中符合实验要求且完全正确的是
| 选项 | 实验操作 | 实验现象 | 离子方程式 | 实验结论 |
| A | 在氯化亚铁溶液中滴加新制氯水 | 浅绿色溶液变成棕黄色溶液 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有还原性 |
| B | 在氯化亚铁溶液中加入锌片 | 浅绿色溶液变成无色溶液 | Fe2++Zn=Fe+Zn2+ | Fe2+具有还原性 |
| C | 在氯化铁溶液中加入铁粉 | 棕黄色溶液变成浅绿色溶液 | Fe3++Fe=2Fe2+ | 铁单质具有还原性 |
| D | 在氯化铁溶液中加入铜粉 | 蓝色溶液变成棕黄色溶液 | 2Fe3++Cu=2Fe2++Cu2+ | Fe3+具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
4 . 为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验方案,其中符合实验要求且完全正确的是( )
| 选项 | 实验操作 | 实验现象 | 离子反应 | 实验结论 |
| A | 向氯化亚铁溶液中通入氯气 | 浅绿色溶液变成棕黄色溶液 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有还原性 |
| B | 在氯化亚铁溶液中加入锌片 | 浅绿色溶液变成无色溶液 | Fe2++Zn=Fe+Zn2+ | Fe2+具有还原性 |
| C | 在氯化铁溶液中加入铁粉 | 棕黄色溶液变成浅绿色溶液 | Fe3++Fe=2Fe2+ | 铁单质具有还原性 |
| D | 在氯化铁溶液中加入铜粉 | 蓝色溶液变成棕黄色溶液 | 2Fe3++Cu=2Fe2++Cu2+ | Fe2+具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2019-12-05更新
|
474次组卷
|
6卷引用:鲁科版必修一2019—2020学年第三章检测试题
鲁科版必修一2019—2020学年第三章检测试题(已下线)【南昌新东方】外国语2019-2020 高一(上)期末(已下线)考点12 常见金属元素单质及其重要化合物3——铁、铜-2020年【衔接教材·暑假作业】新高三一轮复习化学(已下线)第三单元 物质的性质与转化(基础过关)-2020-2021学年高一化学必修第一册单元测试定心卷 (鲁科版2019)江西省南昌市外国语学校2019-2020学年高一上学期期末考试化学试题黑龙江省大庆市肇州县肇州中学2020-2021学年高一下学期第一次月考化学试题
名校
5 . 铁是最常见的金属之一、纳米铁粉可用于处理酸性含氮废水(主要含 );铁易被腐蚀,经碱性发蓝处理可增强其抗腐蚀性,方法为:用
);铁易被腐蚀,经碱性发蓝处理可增强其抗腐蚀性,方法为:用 与
与 进行浸泡,在表面形成
进行浸泡,在表面形成 的同时有
的同时有 生成;铁与砷反应得到的
生成;铁与砷反应得到的 可被
可被 还原得到
还原得到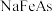 ,
,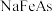 难溶于水,是一种超导材料。镍
难溶于水,是一种超导材料。镍 与
与 单质化学性质相似,金属活动性比铁略低。酸性条件下,
单质化学性质相似,金属活动性比铁略低。酸性条件下, 的氧化性强于
的氧化性强于 ,
, 的盐与碱反应可以转化为不溶性的
的盐与碱反应可以转化为不溶性的 。下列反应的离子方程式正确的是
。下列反应的离子方程式正确的是
 );铁易被腐蚀,经碱性发蓝处理可增强其抗腐蚀性,方法为:用
);铁易被腐蚀,经碱性发蓝处理可增强其抗腐蚀性,方法为:用 与
与 进行浸泡,在表面形成
进行浸泡,在表面形成 的同时有
的同时有 生成;铁与砷反应得到的
生成;铁与砷反应得到的 可被
可被 还原得到
还原得到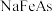 ,
,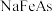 难溶于水,是一种超导材料。镍
难溶于水,是一种超导材料。镍 与
与 单质化学性质相似,金属活动性比铁略低。酸性条件下,
单质化学性质相似,金属活动性比铁略低。酸性条件下, 的氧化性强于
的氧化性强于 ,
, 的盐与碱反应可以转化为不溶性的
的盐与碱反应可以转化为不溶性的 。下列反应的离子方程式正确的是
。下列反应的离子方程式正确的是A.纳米铁粉处理酸性含 废水: 废水: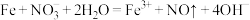 |
B.铁的发蓝处理: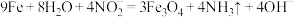 |
C. 溶液中加少量氨水: 溶液中加少量氨水: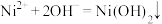 |
D. 与浓盐酸反应: 与浓盐酸反应: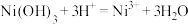 |
您最近半年使用:0次
2023-06-28更新
|
238次组卷
|
5卷引用:江苏省苏州市2022-2023学年高一下学期学业质量阳光指标调研卷化学试题
解题方法
6 . 化学上常用标准电极电势 (氧化型/还原型)比较物质氧化能力。
(氧化型/还原型)比较物质氧化能力。 值越高,氧化型物质的氧化能力越强,
值越高,氧化型物质的氧化能力越强, 值与体系的pH有关,根据表格数据分析,下列说法中正确的是
值与体系的pH有关,根据表格数据分析,下列说法中正确的是
 (氧化型/还原型)比较物质氧化能力。
(氧化型/还原型)比较物质氧化能力。 值越高,氧化型物质的氧化能力越强,
值越高,氧化型物质的氧化能力越强, 值与体系的pH有关,根据表格数据分析,下列说法中正确的是
值与体系的pH有关,根据表格数据分析,下列说法中正确的是| 氧化型/还原型 | 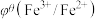 | 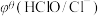 |
| 酸性介质 | 0.77 V | 1.49 V |
| 氧化型/还原型 | 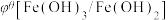 |  |
| 碱性介质 | -0.56 V | x |
| 氧化型/还原型 |  | 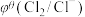 |
| 碱性介质 | 0.72 V | 1.63 V |
| A.表格数据分析,氧化性:Cl2>HClO |
| B.Fe2O3与浓盐酸发生反应:Fe2O3+2Cl-+6H+=2Fe2++Cl2↑+3H2O |
| C.从图中数据可知,氧化型物质的氧化性随着溶液酸性增强而减弱 |
| D.若x=0.81 V,碱性条件下可发生反应:Fe(OH)2+2NaClO+2NaOH=Fe2FeO4+2NaCl+2H2O |
您最近半年使用:0次
2022-10-28更新
|
277次组卷
|
3卷引用:湖南省三湘名校教育联盟2022-2023学年高三上学期第一次大联考化学试题
解题方法
7 . 实验室常用 MnO2与浓盐酸反应制取 Cl2,其反应的化学方程式为∶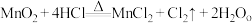 。
。
(1)浓盐酸在反应中显示出来的性质是:酸性和___________ (填"氧化性"或"还原性")。
(2)若该反应产生1mol Cl2时,转移电子的物质的量是___________ 。
(3)该反应的离子方程式为:___________ 。
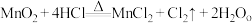 。
。(1)浓盐酸在反应中显示出来的性质是:酸性和
(2)若该反应产生1mol Cl2时,转移电子的物质的量是
(3)该反应的离子方程式为:
您最近半年使用:0次
名校
解题方法
8 . 已知酸性: ,且强酸可以制弱酸,氧化性:
,且强酸可以制弱酸,氧化性: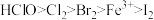 还原性
还原性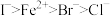 下列有关离子反应或离子方程式的叙述中,正确的是( )
下列有关离子反应或离子方程式的叙述中,正确的是( )
 ,且强酸可以制弱酸,氧化性:
,且强酸可以制弱酸,氧化性: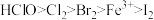 还原性
还原性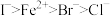 下列有关离子反应或离子方程式的叙述中,正确的是( )
下列有关离子反应或离子方程式的叙述中,正确的是( ) | A.向溴水中加入足量氯化亚铁溶液能使溴水褪色 |
B.能使pH试纸显蓝色的溶液中,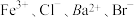 能大量共存 能大量共存 |
C.向Ca(ClO)2溶液中通入少量CO2的离子方程式 |
D.向FeI2溶液中滴加少量氯水,反应的离子方程式为: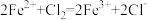 |
您最近半年使用:0次
9 . 储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。
(1)请用双线桥法标出电子转移方向和数目___ 。
(2)上述反应中氧化剂是___ (填化学式),被氧化的元素是___ (填元素符号)。
(3)H2SO4在上述反应中表现出来的性质是___ (填序号)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为___ L。
(5)下列离子方程式的书写及评价均合理的是___ 。
(6)将一定量Mg、Al合金溶于1mol·L-1的HCl溶液中,进而向所得溶液中滴加1mol·L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示。下列结论中正确的是___ 。
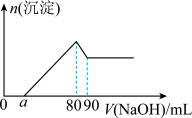
A.溶解“一定量Mg、A1合金”的HCl溶液的体积为90mL
B.Al的物质的量为0.01mol
C.可算出实验中产生H2的物质的量为0.04mol
D.若a=20,可算出Mg的物质的量为0.04mol
(1)请用双线桥法标出电子转移方向和数目
(2)上述反应中氧化剂是
(3)H2SO4在上述反应中表现出来的性质是
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为
(5)下列离子方程式的书写及评价均合理的是
| 选项 | 离子方程式 | 评价 |
| A | 将1molCl2通入含1molFeI2溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
| B | 1mol·L-1的NaAlO2溶液和2.5mol·L-1的HCl溶液等体积互相均匀混合:2AlO2-+5H+=Al3++Al(OH)3↓+H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2∶3 |
| C | 过量SO2通入NaClO溶液中:SO2+H2O+ClO-=HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
| D | Ca(HCO3)2溶液与足量的NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |

A.溶解“一定量Mg、A1合金”的HCl溶液的体积为90mL
B.Al的物质的量为0.01mol
C.可算出实验中产生H2的物质的量为0.04mol
D.若a=20,可算出Mg的物质的量为0.04mol
您最近半年使用:0次
2014高三·全国·专题练习
名校
10 . 已知HNO2在低温下较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表。
下列有关说法错误的是( )。
| pH范围 | >7 | <7 |
| 产物 | NO3- | NO、N2O、N2中的一种 |
下列有关说法错误的是( )。
| A.碱性条件下,NaNO2与NaClO反应的离子方程式为NO2-+ClO-=NO3-+Cl- |
| B.向冷的NaNO2溶液中通入CO2可得到HNO2 |
| C.向冷的NaNO2溶液中加入稀硫酸可得到HNO2 |
| D.向冷的NaNO2溶液中加入滴有淀粉的氢碘酸,溶液变蓝色 |
您最近半年使用:0次



