名校
1 . 2019年是元素周期表诞生150周年,元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
(1)元素①~⑧中,金属性最强的是___________ (填元素符号)。
(2)元素⑦的原子结构示意图是___________ 。
(3)比较元素②、③的最高价氧化物对应水化物的酸性:___________ (填化学式)。说明你判断的理由:___________ 。
(4)主族元素砷(As)的部分信息如图所示。

下列说法正确的是___________ (填序号)。
a.砷元素的最高化合价为+4
b.推测砷有多种氧化物
c.③的气态氢化物的还原性大于砷的气态氢化物的还原性
(5)②⑥两种元素以原子个数比1:1形成的一种化合物,是一种重要的高温耐磨材料。该物质中,②元素显___________ (填“正”或“负”)化合价,从原子结构角度解释原因是___________ 。
(6)与⑧同主族的元素溴和碘可以发生下列置换反应:Br2+2I-=2Br-+I2,I2+2BrO =2IO
=2IO +Br2,这两个置换反应矛盾吗?简述理由
+Br2,这两个置换反应矛盾吗?简述理由___________ 。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ||||||||
(1)元素①~⑧中,金属性最强的是
(2)元素⑦的原子结构示意图是
(3)比较元素②、③的最高价氧化物对应水化物的酸性:
(4)主族元素砷(As)的部分信息如图所示。

下列说法正确的是
a.砷元素的最高化合价为+4
b.推测砷有多种氧化物
c.③的气态氢化物的还原性大于砷的气态氢化物的还原性
(5)②⑥两种元素以原子个数比1:1形成的一种化合物,是一种重要的高温耐磨材料。该物质中,②元素显
(6)与⑧同主族的元素溴和碘可以发生下列置换反应:Br2+2I-=2Br-+I2,I2+2BrO
 =2IO
=2IO +Br2,这两个置换反应矛盾吗?简述理由
+Br2,这两个置换反应矛盾吗?简述理由
您最近一年使用:0次
解题方法
2 . 某小组同学探究卤族元素性质递变规律,设计如下实验:
(1)实验①的离子方程式为_______ 。实验②的现象是_______ 。
(2)综合实验①②③,Cl2、Br2、I2单质的氧化性由强到弱的顺序是_______ (用化学式表示);从原子结构的角度解释上述递变规律。_______
(3)实验中加入CCl4萃取的目的是_______ ;CCl4可以作为萃取剂的原因是_______ 。
| 序号 | 过程 | 现象 | 结论 |
| ① | 向NaBr溶液中加入少量氯水,再加入CCl4,振荡后静置 | 液体分层,下层呈红棕色 | 氧化性:Cl2>Br2 |
| ② | 向KI溶液中加入少量氯水,再加入CCl4,振荡后静置 | 氧化性:Cl2>I2 | |
| ③ | 向KI溶液中加入少量溴水,再加入CCl4,振荡后静置 |
(2)综合实验①②③,Cl2、Br2、I2单质的氧化性由强到弱的顺序是
(3)实验中加入CCl4萃取的目的是
您最近一年使用:0次
名校
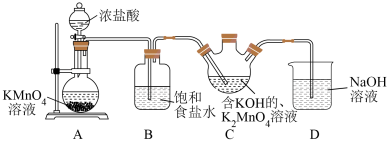
3 .  是一种常见的氧化剂,广泛用于生活中作消毒剂。某小组设计实验探究
是一种常见的氧化剂,广泛用于生活中作消毒剂。某小组设计实验探究 的氧化能力与介质pH的关系(已知
的氧化能力与介质pH的关系(已知 溶液呈绿色,酸性条件下发生歧化反应生成
溶液呈绿色,酸性条件下发生歧化反应生成 和
和 )。
)。
请回答下列问题:
(1)装置A中盛放 溶液的仪器名称为
溶液的仪器名称为___________ ,实验开始前应进行的操作为___________ ,装置D的作用为___________ 。
(2)装置A中浓盐酸在反应中表现出来的性质是___________ 。
(3)由实验推知,A中氧化性:
___________ (填“>”、“<”或“=”) ;若装置C中绿色溶液变为紫红色,
;若装置C中绿色溶液变为紫红色,___________ (填“能”或“不能”)根据此现象判断 的氧化性强于
的氧化性强于 。
。
(4)有关高锰酸钾的实验及现象如表所示。
①已知实验Ⅰ中氧化产物为 ,则实验Ⅰ中发生反应的离子方程式为
,则实验Ⅰ中发生反应的离子方程式为___________ 。
②实验结论:其他条件相同,介质pH越低, 氧化性越
氧化性越___________ (填“强”或“弱”)。
 是一种常见的氧化剂,广泛用于生活中作消毒剂。某小组设计实验探究
是一种常见的氧化剂,广泛用于生活中作消毒剂。某小组设计实验探究 的氧化能力与介质pH的关系(已知
的氧化能力与介质pH的关系(已知 溶液呈绿色,酸性条件下发生歧化反应生成
溶液呈绿色,酸性条件下发生歧化反应生成 和
和 )。
)。
请回答下列问题:
(1)装置A中盛放
 溶液的仪器名称为
溶液的仪器名称为(2)装置A中浓盐酸在反应中表现出来的性质是
(3)由实验推知,A中氧化性:

 ;若装置C中绿色溶液变为紫红色,
;若装置C中绿色溶液变为紫红色, 的氧化性强于
的氧化性强于 。
。(4)有关高锰酸钾的实验及现象如表所示。
| 实验 | 装置 | 试剂R(5 mL含0.1 mol·L  的溶液) 的溶液) | 现象(通入乙烯的体积相等) |
| Ⅰ | 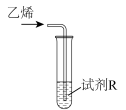 |  溶液 溶液 | 较快产生黑色沉淀 |
| Ⅱ | KOH和 溶液 溶液 | 紫红色溶液较慢变为绿色溶液 | |
| Ⅲ | 稀硫酸和 溶液 溶液 | 紫红色溶液很快变为无色溶液 |
 ,则实验Ⅰ中发生反应的离子方程式为
,则实验Ⅰ中发生反应的离子方程式为②实验结论:其他条件相同,介质pH越低,
 氧化性越
氧化性越
您最近一年使用:0次
2023-10-27更新
|
253次组卷
|
5卷引用:河北省邢台市五岳联盟2023-2024学年高三上学期10月期中考试化学试题
名校
解题方法
4 . 实验小组探究 溶液与
溶液与 溶液的反应及其速率,实验操作和现象如下。
溶液的反应及其速率,实验操作和现象如下。
已知:i. 能完全电离,且具有强氧化性,
能完全电离,且具有强氧化性, 易被还原为
易被还原为 ;
;
ⅱ.淀粉检测 的灵敏度很高,遇低浓度的
的灵敏度很高,遇低浓度的 即可快速变蓝:
即可快速变蓝:
ii. 可与
可与 发生反应:
发生反应: 。
。
(1)实验1-1的目的是_______ 。
(2) 与
与 反应的离子方程式为
反应的离子方程式为_______ 。
为了研究 与
与 反应的速率,小组同学分别向两支试管中加入下列试剂,并记录变色时间,如下表。
反应的速率,小组同学分别向两支试管中加入下列试剂,并记录变色时间,如下表。
(3)加入 溶液后溶液变蓝的时间明显增长,甲同学对此提出猜想:
溶液后溶液变蓝的时间明显增长,甲同学对此提出猜想:
猜想1: 先与
先与 反应,使
反应,使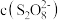 降低;
降低;
猜想2: 先与
先与 反应,_______。
反应,_______。
请回答:
①甲同学提出猜想1的依据:由信息i推测, 的还原性
的还原性_______ (填“强于”或“弱于”) 的。
的。
②乙同学根据实验2-2中数据认为,假定 与
与 反应,溶液中剩余
反应,溶液中剩余 的浓度
的浓度_______ (填“大于”或“小于”)实验2-1中 的起始浓度,由此证明猜想1不成立。
的起始浓度,由此证明猜想1不成立。
③补全 猜想2:_______ 。
(4)查阅文献表明猜想2成立。
①实验2-2中, 内未检测到
内未检测到 与
与 反应,从反应机理角度分析可能的原因是
反应,从反应机理角度分析可能的原因是_______ 。
②根据实验2-2的数据,计算30s内的平均反应速率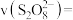
_______  (写出计算式)。
(写出计算式)。
 溶液与
溶液与 溶液的反应及其速率,实验操作和现象如下。
溶液的反应及其速率,实验操作和现象如下。已知:i.
 能完全电离,且具有强氧化性,
能完全电离,且具有强氧化性, 易被还原为
易被还原为 ;
;ⅱ.淀粉检测
 的灵敏度很高,遇低浓度的
的灵敏度很高,遇低浓度的 即可快速变蓝:
即可快速变蓝:ii.
 可与
可与 发生反应:
发生反应: 。
。| 编号 | 1-1 | 1-2 |
| 实验操作 |  |  |
| 现象 | 无明显现象 | 溶液立即变蓝 |
(1)实验1-1的目的是
(2)
 与
与 反应的离子方程式为
反应的离子方程式为为了研究
 与
与 反应的速率,小组同学分别向两支试管中加入下列试剂,并记录变色时间,如下表。
反应的速率,小组同学分别向两支试管中加入下列试剂,并记录变色时间,如下表。| 编号 | 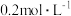  溶液 溶液 |   溶液 溶液 | 蒸馏水 | 淀粉溶液/滴 | 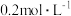  溶液 溶液 | 变色时间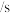 |
| 2-1 | 2 | 0 | 2.8 | 2 | 0.2 | 立即 |
| 2-2 | 2 | 0.8 | 0.2 | 2 | 2 | 30 |
(3)加入
 溶液后溶液变蓝的时间明显增长,甲同学对此提出猜想:
溶液后溶液变蓝的时间明显增长,甲同学对此提出猜想:猜想1:
 先与
先与 反应,使
反应,使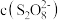 降低;
降低;猜想2:
 先与
先与 反应,_______。
反应,_______。请回答:
①甲同学提出猜想1的依据:由信息i推测,
 的还原性
的还原性 的。
的。②乙同学根据实验2-2中数据认为,假定
 与
与 反应,溶液中剩余
反应,溶液中剩余 的浓度
的浓度 的起始浓度,由此证明猜想1不成立。
的起始浓度,由此证明猜想1不成立。③
(4)查阅文献表明猜想2成立。
①实验2-2中,
 内未检测到
内未检测到 与
与 反应,从反应机理角度分析可能的原因是
反应,从反应机理角度分析可能的原因是②根据实验2-2的数据,计算30s内的平均反应速率
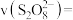
 (写出计算式)。
(写出计算式)。
您最近一年使用:0次
名校
5 . 大海中蕴藏着丰富的资源,部分化学资源获取途径如图:

(1)下列有关说法正确的是_______ 。
A.步骤Ⅰ中除去粗盐中的杂质离子Ca2+、Mg2+、SO ,加入试剂的先后顺序可以是Na2CO3、NaOH、BaCl2
,加入试剂的先后顺序可以是Na2CO3、NaOH、BaCl2
B.不能用澄清的石灰水鉴别NaHCO3溶液和Na2CO3溶液
C.在第Ⅱ、Ⅲ、Ⅳ步骤中,溴元素均被氧化
(2)步骤Ⅳ蒸馏过程中不可能用到的仪器有_______。
(3)步骤Ⅲ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的化学方程式为_______ 。
(4)经过步骤Ⅱ已获得Br2,不直接用含Br2的稀溶液进行蒸馏,而要经过“空气吹出、SO2吸收、通入氯气”后再蒸馏,其目的是_______ 。
(5)根据流程中的反应可判断SO2、Cl2、Br2三种物质的氧化性由强到弱的顺序为_______ 。

(1)下列有关说法正确的是
A.步骤Ⅰ中除去粗盐中的杂质离子Ca2+、Mg2+、SO
 ,加入试剂的先后顺序可以是Na2CO3、NaOH、BaCl2
,加入试剂的先后顺序可以是Na2CO3、NaOH、BaCl2B.不能用澄清的石灰水鉴别NaHCO3溶液和Na2CO3溶液
C.在第Ⅱ、Ⅲ、Ⅳ步骤中,溴元素均被氧化
(2)步骤Ⅳ蒸馏过程中不可能用到的仪器有_______。
| A.温度计 | B.容量瓶 | C.直形冷凝管 | D.酒精灯 |
(4)经过步骤Ⅱ已获得Br2,不直接用含Br2的稀溶液进行蒸馏,而要经过“空气吹出、SO2吸收、通入氯气”后再蒸馏,其目的是
(5)根据流程中的反应可判断SO2、Cl2、Br2三种物质的氧化性由强到弱的顺序为
您最近一年使用:0次
2023-09-26更新
|
135次组卷
|
2卷引用:新疆伊犁州“华-伊高中联盟校”2022-2023学年高一下学期期末考试化学试题
名校
6 . 某同学学习过元素周期律、元素周期表后,在做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关的实验现象。现在请你帮助该同学整理并完成实验报告。
实验目的:探究同主族元素性质的递变规律。
(1)实验用品。
仪器:试管、___________ (请填写一种主要的玻璃仪器的名称)。
药品:新制氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳。
(2)实验内容(在如表横线中填写相关内容):
(3)实验结论:___________ 。
(4)问题和讨论:
①实验②中发生反应的离子方程式为___________ 。
②由于 过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举一个事实说明F的非金属性比Cl的非金属性强:
过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举一个事实说明F的非金属性比Cl的非金属性强:___________ 。
实验目的:探究同主族元素性质的递变规律。
(1)实验用品。
仪器:试管、
药品:新制氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳。
(2)实验内容(在如表横线中填写相关内容):
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量的新制氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈 |
| ② | 向盛有少量碘化钾溶液的试管中滴加少量 | 液体分为两层,下层呈紫红色 |
(4)问题和讨论:
①实验②中发生反应的离子方程式为
②由于
 过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举一个事实说明F的非金属性比Cl的非金属性强:
过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举一个事实说明F的非金属性比Cl的非金属性强:
您最近一年使用:0次
名校
7 . 某小组为探究物质氧化性和还原性的变化规律进行了如下实验:向一定浓度的 溶液和饱和
溶液和饱和 的混合溶液中加入适量氨水,观察到产生红褐色沉淀,经检验,红褐色沉淀含
的混合溶液中加入适量氨水,观察到产生红褐色沉淀,经检验,红褐色沉淀含 。
。
分析 产生的原因:
产生的原因:
(1)甲同学认为是 氧化所致。验证如下:向
氧化所致。验证如下:向 溶液中滴入氨水,生成的白色沉淀迅速变为灰绿色,一段时间后有红褐色沉淀生成。
溶液中滴入氨水,生成的白色沉淀迅速变为灰绿色,一段时间后有红褐色沉淀生成。
①生成白色沉淀的离子方程式是___________________ 。
②产生红褐色沉淀: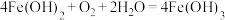 。若将其拆分为两部分反应,则有:还原反应:
。若将其拆分为两部分反应,则有:还原反应: 。氧化反应:
。氧化反应:___________________ 。
(2)乙同学认为产生 的原因可能是
的原因可能是 氧化所致.验证如下(溶液A:饱和
氧化所致.验证如下(溶液A:饱和 溶液
溶液 溶液;已排除空气的影响):
溶液;已排除空气的影响):
①Ⅰ中可能产生 ,运用氧化还原反应规律分析产生
,运用氧化还原反应规律分析产生 的合理性:
的合理性:_________________________ 。
②检验:滤出Ⅰ中不溶物,用稀 溶解,未检出
溶解,未检出 。分析原因:
。分析原因:
i.Ⅰ中未生成 。
。
ⅱ.Ⅰ中生成了 。由于
。由于__________ (用离子方程式表示),因此未检出 。
。
(3)设计实验(Ⅲ)确认 的作用(已排除空气的影响),装置示意图如下所示。
的作用(已排除空气的影响),装置示意图如下所示。

①图中溶液a是__________ 。经检验,实验中产生了 。
。
②Ⅱ、Ⅲ中均含 。Ⅲ中产生了
。Ⅲ中产生了 ,Ⅱ中未产生
,Ⅱ中未产生 ,试解释原因
,试解释原因_________________ 。
 溶液和饱和
溶液和饱和 的混合溶液中加入适量氨水,观察到产生红褐色沉淀,经检验,红褐色沉淀含
的混合溶液中加入适量氨水,观察到产生红褐色沉淀,经检验,红褐色沉淀含 。
。分析
 产生的原因:
产生的原因:(1)甲同学认为是
 氧化所致。验证如下:向
氧化所致。验证如下:向 溶液中滴入氨水,生成的白色沉淀迅速变为灰绿色,一段时间后有红褐色沉淀生成。
溶液中滴入氨水,生成的白色沉淀迅速变为灰绿色,一段时间后有红褐色沉淀生成。①生成白色沉淀的离子方程式是
②产生红褐色沉淀:
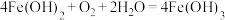 。若将其拆分为两部分反应,则有:还原反应:
。若将其拆分为两部分反应,则有:还原反应: 。氧化反应:
。氧化反应:(2)乙同学认为产生
 的原因可能是
的原因可能是 氧化所致.验证如下(溶液A:饱和
氧化所致.验证如下(溶液A:饱和 溶液
溶液 溶液;已排除空气的影响):
溶液;已排除空气的影响): | 序号 | 试剂 | 现象 |
Ⅰ | 氨水 | 生成沉淀,一段时间后,产生红褐色沉淀和灰黑色固体物质 | |
Ⅱ | 水 | 溶液无明显变化 |
 ,运用氧化还原反应规律分析产生
,运用氧化还原反应规律分析产生 的合理性:
的合理性:②检验:滤出Ⅰ中不溶物,用稀
 溶解,未检出
溶解,未检出 。分析原因:
。分析原因:i.Ⅰ中未生成
 。
。ⅱ.Ⅰ中生成了
 。由于
。由于 。
。(3)设计实验(Ⅲ)确认
 的作用(已排除空气的影响),装置示意图如下所示。
的作用(已排除空气的影响),装置示意图如下所示。
①图中溶液a是
 。
。②Ⅱ、Ⅲ中均含
 。Ⅲ中产生了
。Ⅲ中产生了 ,Ⅱ中未产生
,Ⅱ中未产生 ,试解释原因
,试解释原因
您最近一年使用:0次
解题方法
8 . SO2具有抗氧化、保鲜、防腐、脱色等功用,合理利用SO2可服务于人们更好的生活。回答下列问题:
(1)SO2用于海水提溴的流程图如下:

①溴元素在元素周期表中的位置为___________ 。
②吸收塔用二氧化硫和水吸收Br2的离子反应方程式为:___________ 。
③含Br2的海水经“空气吹出SO2吸收、通入氯气”后再蒸馏的目的是___________ 。
(2)一种综合处理SO2废气的工艺流程图如下:

①检验溶液B中是否含有Fe3+可选用的试剂是___________ 。
②Fe3+可将SO2氧化,反应的离子反应方程式为:___________ 。
③根据工艺流程分析可知 、O2、Fe3+氧化性由强到弱的顺序为:
、O2、Fe3+氧化性由强到弱的顺序为:___________ 。
(1)SO2用于海水提溴的流程图如下:

①溴元素在元素周期表中的位置为
②吸收塔用二氧化硫和水吸收Br2的离子反应方程式为:
③含Br2的海水经“空气吹出SO2吸收、通入氯气”后再蒸馏的目的是
(2)一种综合处理SO2废气的工艺流程图如下:

①检验溶液B中是否含有Fe3+可选用的试剂是
②Fe3+可将SO2氧化,反应的离子反应方程式为:
③根据工艺流程分析可知
 、O2、Fe3+氧化性由强到弱的顺序为:
、O2、Fe3+氧化性由强到弱的顺序为:
您最近一年使用:0次
名校
解题方法
9 . 为验证卤素单质Cl2、Br2、I2氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。资料:稀溴水的颜色是黄色,浓溴水的颜色为红棕色。
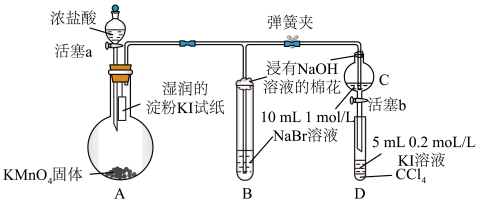
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体对应的化学方程式是___________ 。
(2)B中溶液发生反应的离子方程式是___________ 。
(3)浸有NaOH溶液的棉花的作用是___________ ,反应的离子方程式为:___________ 。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作是___________ ,现象是___________ 。
(5)某同学认为C中可能残余Cl2,会干扰对溴置换碘的实验,试设计简单的实验方案验证Cl2是否过量:___________

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体对应的化学方程式是
(2)B中溶液发生反应的离子方程式是
(3)浸有NaOH溶液的棉花的作用是
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作是
(5)某同学认为C中可能残余Cl2,会干扰对溴置换碘的实验,试设计简单的实验方案验证Cl2是否过量:
您最近一年使用:0次
解题方法
10 . 某实验小组学生为探究氧化性: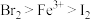 ,设计下列实验方案。
,设计下列实验方案。
【查阅资料】电极电势如下表:(已知:电极电势越高,氧化性越强)
回答下列问题:
(1)利用 和氯水,设计实验证明氧化性:
和氯水,设计实验证明氧化性: ,实验如图所示,实验过程中,能证明氧化性:
,实验如图所示,实验过程中,能证明氧化性: 的现象是
的现象是_____ ,有关反应的离子方程式为_____ 。

(2)利用 的
的 溶液和
溶液和 的
的 溶液,不用任何试剂证明氧化性:
溶液,不用任何试剂证明氧化性: ,
, 溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
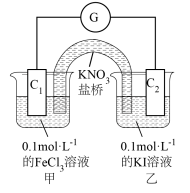
①通过外电路中电流方向:_____ (用 和
和 表示),可证明氧化性:
表示),可证明氧化性: 。
。
②也可通过甲池中颜色变化证明,甲池中颜色变化为_____ 。
(3)有同学认为还可以通过电解反应来证明氧化性: ,为此设计了如下实验:利用惰性电极电解
,为此设计了如下实验:利用惰性电极电解 的
的 溶液,探究外界条件对电极反应产物的影响,实验数据如下表所示:
溶液,探究外界条件对电极反应产物的影响,实验数据如下表所示:
①实验1中,阳极反应式是_____ ,阴极反应式为_____ 。
②实验1、3调节溶液的 宜选用
宜选用_____ (填“硝酸”或“硫酸”)。
③由实验1、2的现象可得出的结论为_____ ;由实验1、3可得出的结论为_____ 。
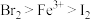 ,设计下列实验方案。
,设计下列实验方案。【查阅资料】电极电势如下表:(已知:电极电势越高,氧化性越强)
| 氧化还原电对(氧化型/还原型) | 电极反应式(氧化型 还原型) 还原型) | 电极电势 |
 / / | 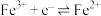 | 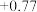 |
 / / |  | 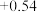 |
 / / |  | 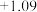 |
(1)利用
 和氯水,设计实验证明氧化性:
和氯水,设计实验证明氧化性: ,实验如图所示,实验过程中,能证明氧化性:
,实验如图所示,实验过程中,能证明氧化性: 的现象是
的现象是
(2)利用
 的
的 溶液和
溶液和 的
的 溶液,不用任何试剂证明氧化性:
溶液,不用任何试剂证明氧化性: ,
, 溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
①通过外电路中电流方向:
 和
和 表示),可证明氧化性:
表示),可证明氧化性: 。
。②也可通过甲池中颜色变化证明,甲池中颜色变化为
(3)有同学认为还可以通过电解反应来证明氧化性:
 ,为此设计了如下实验:利用惰性电极电解
,为此设计了如下实验:利用惰性电极电解 的
的 溶液,探究外界条件对电极反应产物的影响,实验数据如下表所示:
溶液,探究外界条件对电极反应产物的影响,实验数据如下表所示:| 实验 | 电压 |  | 阳极现象 | 阴极现象 |
| 实验1 | 1.5 | 5.5 | 滴加淀粉溶液显蓝色,滴加 溶液不显红色 溶液不显红色 | 无气泡,银白色金属析出 |
| 实验2 | 3.0 | 5.5 | 滴加淀粉溶液显蓝色,滴加 溶液显浅红色 溶液显浅红色 | 无气泡,银白色金属析出 |
| 实验3 | 1.5 |  | 滴加淀粉溶液显蓝色,滴加 溶液不显红色 溶液不显红色 | 较多气泡,极少量金属析出 |
②实验1、3调节溶液的
 宜选用
宜选用③由实验1、2的现象可得出的结论为
您最近一年使用:0次



