11-12高三上·山西·单元测试
名校
解题方法
1 . 向含有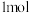
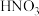 和
和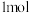
 的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有
的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有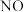 )。下列有关判断不正确的是
)。下列有关判断不正确的是
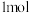
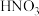 和
和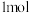
 的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有
的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有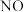 )。下列有关判断不正确的是
)。下列有关判断不正确的是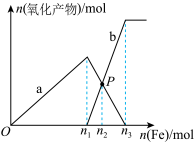
A.a表示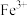 的关系曲线 的关系曲线 |
B.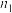 =0.75 =0.75 |
C.P点时,n(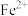 )=0.5625mol )=0.5625mol |
| D.向P点溶液中加入铜粉,最多可溶解14.4g |
您最近一年使用:0次
2024-01-10更新
|
792次组卷
|
16卷引用:2011-2012学年山西省高三上学期第二次阶段性测试化学试卷
(已下线)2011-2012学年山西省高三上学期第二次阶段性测试化学试卷2016届浙江省杭州高级中学高三上学期月考(三)化学试卷【全国百强校】安徽省合肥市第六中学2018-2019学年高一下学期开学考试化学试题(已下线)2019年8月11日《每日一题》2020年高考一轮复习—— 每周一测(已下线)专题3.3 铁及其重要化合物(练)——2020年高考化学一轮复习讲练测人教版2019必修第二册 第五章 本章复习提升湖南省长沙市第一中学2019-2020学年高一上学期第二次阶段性检测(月考)化学试题辽宁省沈阳市第四十中学2021-2022年高一下学期4月份线上教学效果检测化学试题河南省商丘市第一高级中学2021-2022学年高一下学期期中考试化学试题陕西省西安中学 2023 届高三上学期第二次质量检测化学试题西安市第八十三中学2022-2023学年高一下学期第一次月考化学试题辽宁省重点高中沈阳市郊联体2023-2024学年高一上学期期末考试化学试题新疆乌鲁木齐市新疆生产建设兵团第二中学2023-2024学年高一上学期期末考试化学试卷 (已下线)热点02 氮及其化合物浙江省杭州市源清中学2023-2024学年高一上学期期末考试化学试题黑龙江省双鸭山市第一中学2023-2024学年高一下学期4月月考化学试题
名校
解题方法
2 . 在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量之比为3:2:1,现加入适量铁粉,使溶液中三种离子物质的量浓度之比变为1:2:4,则参加反应的铁粉和原溶液中Fe3+的物质的量之比为
| A.2:1 | B.1:2 | C.1:3 | D.1:4 |
您最近一年使用:0次
2021-09-09更新
|
1677次组卷
|
28卷引用:人教版高中化学必修1第三章《金属及其化合物》测试卷2
人教版高中化学必修1第三章《金属及其化合物》测试卷2(已下线)第03章 铁 金属材料(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)人教版(2019)高一必修第一册 第三章素养检测(已下线)2010年甘肃省武威五中高二11月月考化学试卷2015届河北省邯郸市高三上学期1月教学质量检测化学试卷2014-2015江西省新余市高一上学期期末考试化学试卷2014-2015学年辽宁师大附中高二下学期期末考试化学试卷2015-2016学年陕西省长安区一中高一上期末化学试卷(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第3讲 铁及其化合物【押题专练】【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高一上学期12月月考化学试题安徽省阜阳市第三中学2018-2019学年高一上学期小期末考试(期末模拟)化学试题河北省大名县第一中学2020届高三9月月考化学试题河北省武安市第一中学2020届高三9月月考化学试题甘肃省兰州市第一中学2020届高三9月月考化学试题宁夏石嘴山市第三中学2019-2020学年高一上学期第二次(12月)月考化学试题安徽省安庆一中2018-2019学年高一上学期期末考试化学试题安徽省太和第一中学2019-2020学年高一上学期期末考试化学试题专题1.3 氧化还原反应(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升(已下线)3.1.2 铁的氢氧化物 铁盐和亚铁盐练习(1)——《高中新教材同步备课》(人教版 必修第一册)人教版(2019)高一必修第一册第三章 铁 金属材料 素养拓展区江西省鹰潭市第一中学2021届高三上学期期中考试化学试题重庆市三峡名校联盟2020-2021学年高一上学期12月联考化学试题四川省仁寿第一中学校南校区2020-2021学年高一下学期开学考试化学试题(已下线)8.1 铁及其化合物-2020-2021学年秋季班高二上学期化学教材知识点精讲练(沪科版)(已下线)3.1.2 不同价态铁元素之间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)黑龙江省七台河市勃利县高级中学2021-2022学年高三上学期期中考试化学试题广东省普宁市华侨中学2021—2022学年高一上学期第三次月考化学试题陕西省延安子长市中学2021-2022学年高三上学期期中考试化学试题
19-20高一上·辽宁大连·期中
名校
解题方法
3 . 为了食品安全,我国禁止在面粉生产中添加过氧化钙( )等食品添加剂。下列对于过氧化钙(
)等食品添加剂。下列对于过氧化钙( )的叙述错误的是
)的叙述错误的是
 )等食品添加剂。下列对于过氧化钙(
)等食品添加剂。下列对于过氧化钙( )的叙述错误的是
)的叙述错误的是A. 可以用作鱼池增氧剂 可以用作鱼池增氧剂 |
B. 中阴阳离子的个数比为1:1 中阴阳离子的个数比为1:1 |
C. 和水反应时,每产生1mol 和水反应时,每产生1mol 转移电子4mol 转移电子4mol |
D. 和 和 反应的化学方程式为: 反应的化学方程式为: |
您最近一年使用:0次
2021-01-02更新
|
1236次组卷
|
4卷引用:章末培优 第2章 海水中的重要元素——钠和氯-2021-2022学年高一化学课后培优练(人教版2019必修第一册)
(已下线)章末培优 第2章 海水中的重要元素——钠和氯-2021-2022学年高一化学课后培优练(人教版2019必修第一册)辽宁省大连市部分重点高中2019-2020学年高一上学期期中考试化学试题江西省赣州市2021-2022学年高一上学期期末考试化学试题【2022】【高一上】【学军紫金港】【期中考】【高中化学】【李雪收集】
20-21高一上·福建龙岩·阶段练习
名校
4 . 据所学知识完成以下题目:
(1)在下列反应中,HCl做还原剂的是_______ ,HCl做氧化剂的是_______ 。
①CaCO3+2HCl=CaCl2+CO2↑+H2O
②Fe+2HCl=FeCl2+H2↑
③PbO2+4HCl(浓) PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
④KClO3+6HCl(浓) KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
⑤CuO+2HCl=CuCl2+H2O
(2)在横线上补充所需的离子或分子,并配平方程式,。
①KMnO4+HCl=KCl+MnCl2+Cl2↑+H2O,_______ 。
②Mn2++ +H2O=MnO2↓+Cl2↑+___ ,
+H2O=MnO2↓+Cl2↑+___ ,_______ 。
(3)用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,_______ 。
(4)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C2O4+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是____ ;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂_____ mol,有_____ mol电子发生转移,相当于测出含钙元素的质量是_____ g。
(5)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:_____ 。
(1)在下列反应中,HCl做还原剂的是
①CaCO3+2HCl=CaCl2+CO2↑+H2O
②Fe+2HCl=FeCl2+H2↑
③PbO2+4HCl(浓)
 PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O④KClO3+6HCl(浓)
 KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O⑤CuO+2HCl=CuCl2+H2O
(2)在横线上补充所需的离子或分子,并配平方程式,。
①KMnO4+HCl=KCl+MnCl2+Cl2↑+H2O,
②Mn2++
 +H2O=MnO2↓+Cl2↑+___ ,
+H2O=MnO2↓+Cl2↑+___ ,(3)用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,
(4)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C2O4+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是
(5)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
您最近一年使用:0次
2020-12-24更新
|
1698次组卷
|
5卷引用:第一章《物质及其变化》能力提升单元检测-【帮课堂】2022-2023学年高一化学必修第一册精品讲义(人教版2019)
(已下线)第一章《物质及其变化》能力提升单元检测-【帮课堂】2022-2023学年高一化学必修第一册精品讲义(人教版2019)福建省连城县第一中学2020-2021学年高一上学期第二次月考化学试题(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)专题05 氧化还原反应(限时精练)-2022届高考化学一轮复习热点题型归纳与变式训练
5 . 镁、铝、铁合金投入300mL 溶液中,金属恰好溶解,分别转化成
溶液中,金属恰好溶解,分别转化成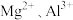 和
和 ;还原产物为NO,在标准状况下体积为6.72L。在反应后的溶液中加入300mL某浓度的NaOH溶液,金属阳离子恰好全部沉淀,干燥后测得质量为27.2g。下列有关推断正确的是
;还原产物为NO,在标准状况下体积为6.72L。在反应后的溶液中加入300mL某浓度的NaOH溶液,金属阳离子恰好全部沉淀,干燥后测得质量为27.2g。下列有关推断正确的是
 溶液中,金属恰好溶解,分别转化成
溶液中,金属恰好溶解,分别转化成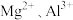 和
和 ;还原产物为NO,在标准状况下体积为6.72L。在反应后的溶液中加入300mL某浓度的NaOH溶液,金属阳离子恰好全部沉淀,干燥后测得质量为27.2g。下列有关推断正确的是
;还原产物为NO,在标准状况下体积为6.72L。在反应后的溶液中加入300mL某浓度的NaOH溶液,金属阳离子恰好全部沉淀,干燥后测得质量为27.2g。下列有关推断正确的是A.参加反应的 的物质的量为0.9mol 的物质的量为0.9mol | B.NaOH的物质的量浓度为6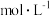 |
| C.参加反应的金属的质量为11.9g | D. 的物质的量浓度为3 的物质的量浓度为3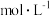 |
您最近一年使用:0次
2020-05-01更新
|
974次组卷
|
11卷引用:人教版高一化学必修1第四章《非金属及其化合物》测试卷
人教版高一化学必修1第四章《非金属及其化合物》测试卷吉林省吉林市长春汽车经济开发区第六中学2016-2017学年高一下学期期末考试化学试题云南省元江县一中2018-2019学年高一上学期12月考试化学试题浙江省东阳中学2019-2020学年高二上学期期中考试化学试题云南省镇康县第一中学2019-2020学年高一12月月考化学试题贵州省天柱县第二中学2019-2020学年高一上学期期末考试化学试题贵州省黔西南布依族苗族自治州望谟民族中学2019-2020学年高一上学期期末考试化学试题陕西省渭南韩城市2019-2020学年高二上学期竞赛考试化学试题河南省长葛市第一高级中学2020-2021学年高二上学期阶段性测试试卷化学试题上海市黄浦区大同中学2020-2021学年高二上学期期中考试化学试题湖南省长沙市第一中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
6 . 铜镁合金2.14 g完全溶于一定浓度的硝酸,硝酸被还原成NO2、NO、N2O三种气体且标准况下它们体积均为0.224 L。反应后的溶液中加入足量氢氧化钠溶液,生成的沉淀经过滤、洗涤、干燥后称量,质量为
| A.3.12 g | B.4.68 g | C.5.08 g | D.4.18 g |
您最近一年使用:0次
2020-03-17更新
|
827次组卷
|
16卷引用:山西省忻州市第一中学高一化学下学期(远程)目标检测(4)化学试题
山西省忻州市第一中学高一化学下学期(远程)目标检测(4)化学试题(已下线)湖北省黄冈市2009—2010学年度高三年级期末考试理科综合能力测试化学试题(已下线)2011届江西省重点高三第一次联考理综化学部分(已下线)2010—2011学年辽宁大连23中高二下学期期末考试化学试卷(已下线)2012届四川省绵阳南山中学高三九月诊断考试理综试卷(化学部分)2015-2016学年湖南省长沙一中等三校高一下期末化学试卷2016-2017学年安徽省六安一中高二上开学测化学试卷江西省奉新县第一中学2019届高三上学期第二次月考化学试题江西省安福中学2019-2020学年高一(普通班)下学期3月线上考试化学试题湖南省长沙市长郡中学2019-2020学年高一下学期期末考试化学试题(已下线)微专题02 以物质的量为中心的计算-备战2022年高考化学考点微专题黑龙江省大庆铁人中学2022届高三上学期第一次月考化学试题福建省武平县第一中学2021-2022学年高三上学期11月教学质量检测化学试题江西省萍乡市芦溪中学2021-2022学年高三上学期第一次段考化学(理)试题内蒙古霍林郭勒市第一中学2021-2022学年高一下学期第一次月考化学试题吉林省吉林市第一中学2021-2022学年高二6月月考(平行班)化学试题
解题方法
7 . 将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答下列问题:
(1)NO的体积为________ L,NO2的体积为________ L。
(2)参加反应的HNO3的物质的量是________ 。
(3)待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水________ g。
(5)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要通O2______ mol。
(1)NO的体积为
(2)参加反应的HNO3的物质的量是
(3)待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水
(5)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要通O2
您最近一年使用:0次
2020-02-06更新
|
341次组卷
|
2卷引用:鲁教版高中化学必修1第三章《自然界中的元素》测试卷1
名校
8 . 将3. 84 g铜粉与一定质量浓硝酸反应,当铜完全作用时,溶液中的NO3-减少0.1mol,则所消耗硝酸的物质的量是
| A.0.1 mol | B.0.11 mol | C.0.16 mol | D.0.22 mol |
您最近一年使用:0次
2020-01-13更新
|
629次组卷
|
4卷引用:专题7 本专题复习提升-高中化学必修第二册苏教版2019
名校
9 . 将2.56gCu和200mL某浓度的浓HNO3混合,随着反应的进行生成气体的颜色逐渐变浅,当Cu反应完全时,共收集到气体1.12L(标准状况)。
下列关于该反应的分析错误的是( )
下列关于该反应的分析错误的是( )
| A.该反应生成的NO2与NO的体积比为7 : 3 |
| B.该反应转移电子数为0.04NA |
| C.该反应消耗HNO3的物质的量为0.13mol |
| D.反应结束后所得溶液中(忽略反应前后溶液体积的变化)c(NO3-) = 0.4 mol·L-1 |
您最近一年使用:0次
2020-01-09更新
|
787次组卷
|
5卷引用:专题7 本专题复习提升-高中化学必修第二册苏教版2019
解题方法
10 . (1)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。完成下列填空:
①As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体. 若As2S3和SnCl2恰好完全反应,As2S3和SnCl2的物质的量之比为_______ .该反应的氧化剂是_____ ,反应产生的气体可用_______ 吸收.
②As2S3和HNO3有如下反应:__ As2S3+__ NO3-+__ ___ =__ H3AsO4+__ S+__ NO2↑+__ _____
A.将方程式补充完整并配平
B.若生成1 mol H3AsO4,则反应中转移电子的物质的量为________ .
(2)某温度下将Cl2通入KOH溶液中,反应后得到KCl,KClO和KClO3的混合溶液,经测定ClO-和 的物质的量浓度之比为7:1,则Cl2与KOH反应时,氧化剂和还原剂物质的量之比为
的物质的量浓度之比为7:1,则Cl2与KOH反应时,氧化剂和还原剂物质的量之比为___ .若5mol Cl2参加反应,转移电子数为______________ (用NA表示阿伏加 德罗常数)
(3)某一反应体系中有反应物和生成物共五种物质:S,H2S,HNO3,NO,H2O. 该反应的化学方程式为______________________ ;若反应过程中转移了0.3mol电子,则氧化产物的质量是______ g;
①As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体. 若As2S3和SnCl2恰好完全反应,As2S3和SnCl2的物质的量之比为
②As2S3和HNO3有如下反应:
A.将方程式补充完整并配平
B.若生成1 mol H3AsO4,则反应中转移电子的物质的量为
(2)某温度下将Cl2通入KOH溶液中,反应后得到KCl,KClO和KClO3的混合溶液,经测定ClO-和
 的物质的量浓度之比为7:1,则Cl2与KOH反应时,氧化剂和还原剂物质的量之比为
的物质的量浓度之比为7:1,则Cl2与KOH反应时,氧化剂和还原剂物质的量之比为(3)某一反应体系中有反应物和生成物共五种物质:S,H2S,HNO3,NO,H2O. 该反应的化学方程式为
您最近一年使用:0次



