名校
解题方法
1 . 常温下, 的电离平衡常数
的电离平衡常数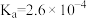 。亚硝酸钠
。亚硝酸钠 是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。
是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。
Ⅰ、亚硝酸钠有毒,不能随意丢弃,实验室一般将其与饱和氯化铵溶液共热使之转化成无毒无公害的物质,其产物之一为无色无味气体,
(1)则反应的化学方程式为_______ 。
Ⅱ、为了测定样品中亚硝酸钠的含量,称取 样品溶于水配成
样品溶于水配成 溶液,取
溶液,取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 的酸性
的酸性 溶液进行滴定,实验所得数据如下表。
溶液进行滴定,实验所得数据如下表。
(2)第一组实验数据出现较明显异常,造成异常的原因可能是_______(填字母序号)。
(3)  溶液应用
溶液应用_______ 滴定管盛装(填“酸式”或者“碱式”),滴定过程中,眼睛应注视_______ ;
(4)根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为_______ 。
 的电离平衡常数
的电离平衡常数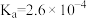 。亚硝酸钠
。亚硝酸钠 是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。
是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。Ⅰ、亚硝酸钠有毒,不能随意丢弃,实验室一般将其与饱和氯化铵溶液共热使之转化成无毒无公害的物质,其产物之一为无色无味气体,
(1)则反应的化学方程式为
Ⅱ、为了测定样品中亚硝酸钠的含量,称取
 样品溶于水配成
样品溶于水配成 溶液,取
溶液,取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 的酸性
的酸性 溶液进行滴定,实验所得数据如下表。
溶液进行滴定,实验所得数据如下表。| 滴定次数 | 1 | 2 | 3 | 4 |
 溶液体积/ 溶液体积/ | 20.60 | 20.02 | 20.00 | 19.98 |
| A.酸式滴定管用蒸馏水洗净后未用标准液润洗 |
| B.滴定前滴定管尖嘴中有气泡,滴定后滴定管尖嘴无气泡 |
C.判断终点时,滴入一滴酸性 溶液,锥形瓶内溶液呈浅红色,振荡后立即褪色 溶液,锥形瓶内溶液呈浅红色,振荡后立即褪色 |
| D.观察滴定终点时俯视读数 |
 溶液应用
溶液应用(4)根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为
您最近一年使用:0次
名校
2 . 亚硝酸钠( )是重要的防腐剂。某化学兴趣小组尝试制备亚硝酸钠,查阅资料:
)是重要的防腐剂。某化学兴趣小组尝试制备亚硝酸钠,查阅资料: 为弱酸,在酸性溶液中,
为弱酸,在酸性溶液中, 可将
可将 还原为
还原为 且无气体生成。
且无气体生成。
(一)亚硝酸钠固体含量的测定及性质验证
称取 固体样品(杂质不与酸性
固体样品(杂质不与酸性 溶液反应)4.000g溶于水配成250
溶液反应)4.000g溶于水配成250 溶液,取25.00
溶液,取25.00 溶液于锥形瓶中,用0.1000
溶液于锥形瓶中,用0.1000 酸性
酸性 溶液进行滴定,实验所得数据如下表所示:
溶液进行滴定,实验所得数据如下表所示:
(1)第一组实验数据出现异常,造成这种异常的原因可能是____ (填字母)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(2)酸性高锰酸钾滴定 的离子反应方程式
的离子反应方程式__________ 。
(3)滴定时将高锰酸钾标准溶液注入______ (填“酸”或“碱”)式滴定管中,该实验滴定终点的现象是_____ 。
(4)根据表中数据,计算所得固体中亚硝酸钠( )的质量分数
)的质量分数_______ 。
(5)亚硝酸钠易溶于水,将0.2 的亚硝酸钠溶液和0.1
的亚硝酸钠溶液和0.1 的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为
的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为________ 。
(二)反应废液的处理
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用 溶液调成中性,再用电化学降解法进行处理。25℃时,反应进行10min,溶液的
溶液调成中性,再用电化学降解法进行处理。25℃时,反应进行10min,溶液的 由7变为12.电化学降解
由7变为12.电化学降解 的原理如下图所示。
的原理如下图所示。
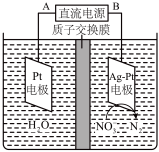
(6)电源正极为_____ (填A或B),阴极反应式为___________ 。
 )是重要的防腐剂。某化学兴趣小组尝试制备亚硝酸钠,查阅资料:
)是重要的防腐剂。某化学兴趣小组尝试制备亚硝酸钠,查阅资料: 为弱酸,在酸性溶液中,
为弱酸,在酸性溶液中, 可将
可将 还原为
还原为 且无气体生成。
且无气体生成。(一)亚硝酸钠固体含量的测定及性质验证
称取
 固体样品(杂质不与酸性
固体样品(杂质不与酸性 溶液反应)4.000g溶于水配成250
溶液反应)4.000g溶于水配成250 溶液,取25.00
溶液,取25.00 溶液于锥形瓶中,用0.1000
溶液于锥形瓶中,用0.1000 酸性
酸性 溶液进行滴定,实验所得数据如下表所示:
溶液进行滴定,实验所得数据如下表所示:| 滴定次数 | 1 | 2 | 3 | 4 |
 溶液体积/ 溶液体积/ | 20.60 | 20.02 | 20.00 | 19.98 |
(1)第一组实验数据出现异常,造成这种异常的原因可能是
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(2)酸性高锰酸钾滴定
 的离子反应方程式
的离子反应方程式(3)滴定时将高锰酸钾标准溶液注入
(4)根据表中数据,计算所得固体中亚硝酸钠(
 )的质量分数
)的质量分数(5)亚硝酸钠易溶于水,将0.2
 的亚硝酸钠溶液和0.1
的亚硝酸钠溶液和0.1 的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为
的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为(二)反应废液的处理
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用
 溶液调成中性,再用电化学降解法进行处理。25℃时,反应进行10min,溶液的
溶液调成中性,再用电化学降解法进行处理。25℃时,反应进行10min,溶液的 由7变为12.电化学降解
由7变为12.电化学降解 的原理如下图所示。
的原理如下图所示。
(6)电源正极为
您最近一年使用:0次
名校
解题方法
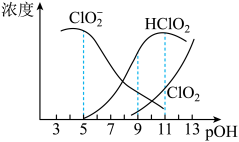
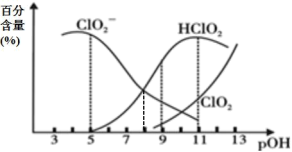
3 . 亚氯酸钠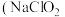 )在溶液中会生成
)在溶液中会生成 、
、 、
、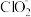 、
、 等,其中
等,其中 和
和 都是具有漂白作用。已知
都是具有漂白作用。已知 ,经测定
,经测定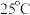 时各组分含量随
时各组分含量随 变化情况如图所示(
变化情况如图所示( 浓度没有画出),此温度下,下列分析正确的是
浓度没有画出),此温度下,下列分析正确的是
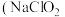 )在溶液中会生成
)在溶液中会生成 、
、 、
、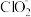 、
、 等,其中
等,其中 和
和 都是具有漂白作用。已知
都是具有漂白作用。已知 ,经测定
,经测定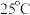 时各组分含量随
时各组分含量随 变化情况如图所示(
变化情况如图所示( 浓度没有画出),此温度下,下列分析正确的是
浓度没有画出),此温度下,下列分析正确的是
A. 的电离平衡常数的数值 的电离平衡常数的数值 |
B. 时, 时,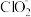 部分转化成 部分转化成 和 和 离子的方程式为: 离子的方程式为: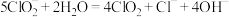 |
C. 时,溶液中含氯微粒的浓度大小为: 时,溶液中含氯微粒的浓度大小为: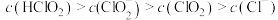 |
D.同浓度 溶液和 溶液和 溶液等体积混合,则混合溶液中有: 溶液等体积混合,则混合溶液中有: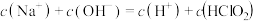 |
您最近一年使用:0次
2022-11-02更新
|
416次组卷
|
9卷引用:天津市耀华中学2022-2023学年高二上学期期中调研化学试题
天津市耀华中学2022-2023学年高二上学期期中调研化学试题四川省泸县第四中学2018-2019学年高二下学期下学期期中考试化学试题辽宁省大连市普兰店区第二中学2018届高三上学期期末考试化学试题四川省遂宁市2018届高三第一次诊断考试理综化学试题【全国百强校】四川省棠湖中学2019届高三二诊模拟理综-化学试题【全国百强校】四川省棠湖中学2019届高三下学期4月月考理科综合化学试题【懂做原理题】2020届高三化学选修4二轮专题练——电解质溶液中的曲线分析【精编23题】山东省济南大学城实验高中2021-2022学年高三3月阶段性调研化学试题河南省南阳市第一中学校2022-2023学年高三上学期12月月考化学试题
名校
4 . 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol⋅L-1HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为___ ;盛装标准盐酸的仪器名称为___ 。
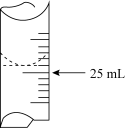
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为___ 。
(3)乙学生做了三组平行实验,数据记录如下:
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为___ (小数点后保留四位)。
(4)下列哪些操作会使测定结果偏高___ (填序号)。
(5)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。(H2C2O4,草酸,弱酸)
②可将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL1.0×10-4mol/L的KMnO4溶液。
Ⅰ.配平用酸性KMnO4溶液滴定H2C2O4的离子方程式___ 。
MnO +H2C2O4+H+=Mn2++CO2↑+H2O。
+H2C2O4+H+=Mn2++CO2↑+H2O。
Ⅱ.滴定前是否要滴加指示剂?___ ;(填“是”或“否”),判断滴定终点的方法是:___ 。
(1)滴定时,盛装待测NaOH溶液的仪器名称为
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为

(3)乙学生做了三组平行实验,数据记录如下:
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 0.22 | 26.31 |
(4)下列哪些操作会使测定结果偏高
| A.锥形瓶用蒸馏水洗净后再用待测液润洗 |
| B.酸式滴定管用蒸馏水洗净后再用标准液润洗 |
| C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失 |
| D.滴定前读数正确,滴定后俯视滴定管读数 |
①将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。(H2C2O4,草酸,弱酸)
②可将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL1.0×10-4mol/L的KMnO4溶液。
Ⅰ.配平用酸性KMnO4溶液滴定H2C2O4的离子方程式
MnO
 +H2C2O4+H+=Mn2++CO2↑+H2O。
+H2C2O4+H+=Mn2++CO2↑+H2O。Ⅱ.滴定前是否要滴加指示剂?
您最近一年使用:0次
名校
5 . 亚氯酸钠(NaClO2)在溶液中会生成ClO2、HClO2、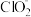 、Cl-等,其中HClO2和ClO2都具有漂白性。已知pOH=-lgc(OH-),经测定25℃时各组分百分含量随pOH变化情况如图所示(Cl-没有画出),则下列分析正确的是
、Cl-等,其中HClO2和ClO2都具有漂白性。已知pOH=-lgc(OH-),经测定25℃时各组分百分含量随pOH变化情况如图所示(Cl-没有画出),则下列分析正确的是
 、Cl-等,其中HClO2和ClO2都具有漂白性。已知pOH=-lgc(OH-),经测定25℃时各组分百分含量随pOH变化情况如图所示(Cl-没有画出),则下列分析正确的是
、Cl-等,其中HClO2和ClO2都具有漂白性。已知pOH=-lgc(OH-),经测定25℃时各组分百分含量随pOH变化情况如图所示(Cl-没有画出),则下列分析正确的是
A.HClO2的电离平衡常数的数值Ka=1 10-8 10-8 |
B.pOH=11时,ClO 部分转化成ClO2和Cl-离子的方程式为:5ClO 部分转化成ClO2和Cl-离子的方程式为:5ClO +2H2O=4ClO2+Cl-+4OH- +2H2O=4ClO2+Cl-+4OH- |
| C.ClO2与SO2混合后,气体漂白纸浆效果更好 |
| D.同浓度HClO2溶液和NaClO2溶液等体积混合(不考虑ClO2和Cl-),则混合溶液中有:c(Na+)+c(OH-)=c(H+)+c(HClO2) |
您最近一年使用:0次
2021-01-05更新
|
822次组卷
|
4卷引用:天津市第二中学2022-2023学年高二上学期12月学情调查化学试题



