解题方法
1 . 【化学---选修2:化学与技术】
MnO2和锌是制造干电池的主要原料。
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解。
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌。简化流程框图如下(中间产物的固体部分已经略去):
软锰矿、闪锌矿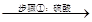 滤液A
滤液A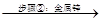 Zn2+、Mn2+、Fe2+、Al3+
Zn2+、Mn2+、Fe2+、Al3+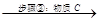
ZnSO4、MnSO4溶液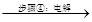 Zn+MnO2+产品D
Zn+MnO2+产品D
已知各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:__________________________、_____________________________。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为___________(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是___
____________________,另外一种固体物质可为___________。
(4)步骤④中电解过程中MnO2在______极析出,该电极上发生的反应方程式为________________。产品D的化学式为_________________,该物质对整个生产的意义是___________________________。
MnO2和锌是制造干电池的主要原料。
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解。
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌。简化流程框图如下(中间产物的固体部分已经略去):
软锰矿、闪锌矿
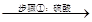 滤液A
滤液A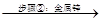 Zn2+、Mn2+、Fe2+、Al3+
Zn2+、Mn2+、Fe2+、Al3+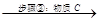
ZnSO4、MnSO4溶液
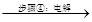 Zn+MnO2+产品D
Zn+MnO2+产品D已知各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:__________________________、_____________________________。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为___________(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是___
____________________,另外一种固体物质可为___________。
(4)步骤④中电解过程中MnO2在______极析出,该电极上发生的反应方程式为________________。产品D的化学式为_________________,该物质对整个生产的意义是___________________________。
您最近一年使用:0次
名校
解题方法
2 . 二氧化硒(Se)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1。写出Se和浓HNO3的反应方程式_______________________________________ 。
(2)已知:Se+2H2SO4(浓) 2SO2↑+SeO2+2H2O
2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O Se+2SO42-+4H+
Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_________________________ 。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3 Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3
Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3 Na2S4O6+2NaI
Na2S4O6+2NaI
实验中,准确称量SeO2样品0.1500g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为__________ 。
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1。写出Se和浓HNO3的反应方程式
(2)已知:Se+2H2SO4(浓)
 2SO2↑+SeO2+2H2O
2SO2↑+SeO2+2H2O2SO2+SeO2+2H2O
 Se+2SO42-+4H+
Se+2SO42-+4H+SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3
 Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3
Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3 Na2S4O6+2NaI
Na2S4O6+2NaI实验中,准确称量SeO2样品0.1500g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为
您最近一年使用:0次



