解题方法
1 . 亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂。
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原NaClO3,可较安全地生成ClO2,反应的离子方程式为_______ 。
(2)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法做如下检测(已知ClO2存在于pH为4~6的溶液中,ClO 存在于中性溶液中):
存在于中性溶液中):
①取0.50 L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:_______ 。
②已知:2Na2S2O3+I2=Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4 mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00 mL。该水样中ClO2的浓度是_______ mg·L-1。
(3)某学习小组设计如下装置制取亚氯酸钠(NaClO2)。
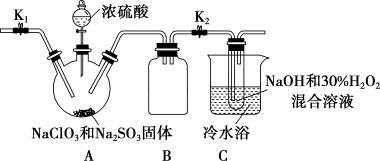
①装置A中产生的ClO2气体,在装置C中反应生成NaClO2,写出生成NaClO2的化学方程式:_______ 。
②将NaClO2溶液在一定条件下处理即可得到NaClO2晶体。装置B的作用是_______ 。
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原NaClO3,可较安全地生成ClO2,反应的离子方程式为
(2)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法做如下检测(已知ClO2存在于pH为4~6的溶液中,ClO
 存在于中性溶液中):
存在于中性溶液中):①取0.50 L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:
②已知:2Na2S2O3+I2=Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4 mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00 mL。该水样中ClO2的浓度是
(3)某学习小组设计如下装置制取亚氯酸钠(NaClO2)。

①装置A中产生的ClO2气体,在装置C中反应生成NaClO2,写出生成NaClO2的化学方程式:
②将NaClO2溶液在一定条件下处理即可得到NaClO2晶体。装置B的作用是
您最近一年使用:0次
2 .  、
、 、NO是有害气体,有多种方法处理有害气体的工艺。
、NO是有害气体,有多种方法处理有害气体的工艺。
Ⅰ.一种脱除 回收硫碘工艺的两个阶段主要反应分别如下:
回收硫碘工艺的两个阶段主要反应分别如下:
第一阶段:
第二阶段:
(1)该工艺需控制第一阶段与第二阶段参加反应的 的物质的量之比
的物质的量之比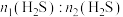 约为1:2.若过大,会导致
约为1:2.若过大,会导致_______ 。
(2) 溶液脱除空气中
溶液脱除空气中 并再生的原理如图所示。
并再生的原理如图所示。 溶液脱除空气中
溶液脱除空气中 的总反应化学方程式为
的总反应化学方程式为_______ 。

Ⅱ.有氧条件下,NO在催化剂作用下可被 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示。
作用下的脱硝反应机理如图所示。
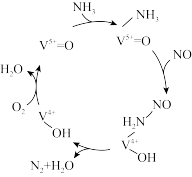
(3)根据如图机理,等物质的量的NO、 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是_______ 。
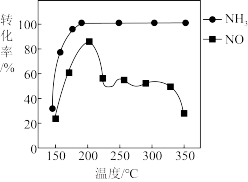
(4)按上述图中 、NO和
、NO和 的比例进行催化脱硝反应。相同反应时间,
的比例进行催化脱硝反应。相同反应时间, 和NO的转化率与温度的关系如图所示,200℃后,NO转化率急剧下降的原因是
和NO的转化率与温度的关系如图所示,200℃后,NO转化率急剧下降的原因是_______ 。
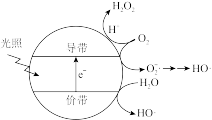
(5)羟基自由基(HO·)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成HO·;光照时,价带失去电子产生有强氧化性的空穴,价带上 直接转化为HO·;描述产生HO·的另一种过程:
直接转化为HO·;描述产生HO·的另一种过程:_______ 。
 、
、 、NO是有害气体,有多种方法处理有害气体的工艺。
、NO是有害气体,有多种方法处理有害气体的工艺。Ⅰ.一种脱除
 回收硫碘工艺的两个阶段主要反应分别如下:
回收硫碘工艺的两个阶段主要反应分别如下:第一阶段:

第二阶段:

(1)该工艺需控制第一阶段与第二阶段参加反应的
 的物质的量之比
的物质的量之比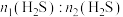 约为1:2.若过大,会导致
约为1:2.若过大,会导致(2)
 溶液脱除空气中
溶液脱除空气中 并再生的原理如图所示。
并再生的原理如图所示。 溶液脱除空气中
溶液脱除空气中 的总反应化学方程式为
的总反应化学方程式为
Ⅱ.有氧条件下,NO在催化剂作用下可被
 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示。
作用下的脱硝反应机理如图所示。
(3)根据如图机理,等物质的量的NO、
 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是(4)按上述图中
 、NO和
、NO和 的比例进行催化脱硝反应。相同反应时间,
的比例进行催化脱硝反应。相同反应时间, 和NO的转化率与温度的关系如图所示,200℃后,NO转化率急剧下降的原因是
和NO的转化率与温度的关系如图所示,200℃后,NO转化率急剧下降的原因是
(5)羟基自由基(HO·)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成HO·;光照时,价带失去电子产生有强氧化性的空穴,价带上
 直接转化为HO·;描述产生HO·的另一种过程:
直接转化为HO·;描述产生HO·的另一种过程:
您最近一年使用:0次
2022-05-28更新
|
709次组卷
|
5卷引用:湖南省2022-2023学年第十五届中学生数理化生综合实践活动高一化学应用知识展示A卷
湖南省2022-2023学年第十五届中学生数理化生综合实践活动高一化学应用知识展示A卷江苏省徐州市沛县2021-2022学年高一下学期第二次学情调研化学试题(已下线)期末模拟预测卷B-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)(已下线)第八章 化学与可持续发展(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第八章 化学与可持续发展【单元测试B卷】
3 . 制备高铁酸钾[K2FeO4]并用其除去土壤和废水中的有机砷(HAPA)与无机砷[+3价砷表示As(Ⅲ)]的流程如图所示:
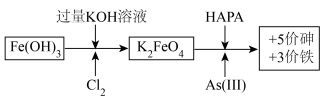
已知:酸性越强,K2FeO4越容易发生反应生成O2。
回答下列问题:
(1)生成K2FeO4的化学方程式为___ 。
(2)K2FeO4去除砷污染时作__ (填“氧化剂”或“还原剂”)。若污染物中的砷全部以Na3AsO3计,则去除全部污染时Na3AsO3与K2FeO4的物质的量之比为__ 。
(3)氢离子浓度、高铁酸钾的用量对HAPA和As(Ⅲ)去除效果的影响如图所示。
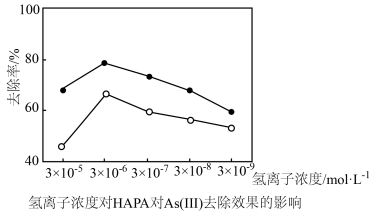
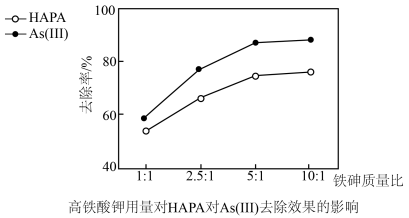
①氢离子浓度为3×10-5mol•L-1时去除率低,原因是(用离子方程式表示)__ 。
②最佳铁砷质量比为___ ,理由是__ 。

已知:酸性越强,K2FeO4越容易发生反应生成O2。
回答下列问题:
(1)生成K2FeO4的化学方程式为
(2)K2FeO4去除砷污染时作
(3)氢离子浓度、高铁酸钾的用量对HAPA和As(Ⅲ)去除效果的影响如图所示。


①氢离子浓度为3×10-5mol•L-1时去除率低,原因是(用离子方程式表示)
②最佳铁砷质量比为
您最近一年使用:0次
2021-01-28更新
|
716次组卷
|
4卷引用:山东省高密市第一中学2023-2024学年高一上学期1月冬学竞赛化学试题
山东省高密市第一中学2023-2024学年高一上学期1月冬学竞赛化学试题山东省潍坊市2020-2021学年高一上学期期末统考化学试题(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练



