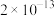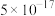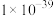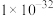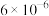1 . Ⅰ.高铁酸钾(K2FeO4) 是一种高效、无毒的强氧化剂,常温下为紫色固体,微溶于浓KOH溶液,能溶于水,且能与水反应放出氧气,并生成Fe(OH)3胶体。稳定性随pH的下降而减弱,酸性条件下易分解。
(1)下列有关铁及其化合物的性质与用途具有对应关系的是___________
Ⅱ.K2FeO4的净水原理如图所示:
(2)下列说法错误的是___________
(3)写出K2FeO4与水反应的化学方程式___________ 。
Ⅲ.已知可用Cl2与Fe(NO3)3制备K2FeO4(含副产品KCl、KNO3),查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:
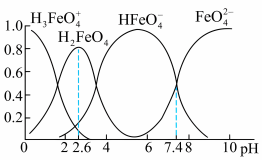
(4)①为获得尽可能纯净的高铁酸盐,pH应控制在___________ 。
②写出在此条件下,反应的离子方程式:___________ ;每生成39.6g K2FeO4,转移的电子数目为___________ ;
(5)已知溶液的酸碱性及离子浓度会对反应试剂的氧化性、还原性产生影响。
某实验小组研究不同反应试剂对K2FeO4产率的影响,对比实验如下:
注:上述实验中,溶液总体积、FeCl3和Fe(NO3)3的物质的量、Cl2的通入量均相同。
①由实验I、II的现象可知,Fe3+的还原性随溶液碱性的增强而___________ (填“增强”、“减弱”或“不变”);
②实验II中K2FeO4的产率比实验III低,试解释其可能的原因:___________ ;
③向实验II所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅,试解释其可能的原因:___________ 。
(6)实验室测定含少量杂质的K2FeO4样品的纯度:称取0.1500g K2FeO4样品溶于碱性KI溶液中,调节pH至弱酸性使混合液充分反应。用0.1000 mol·L−1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00 mL。滴定时,发生反应的离子方程式:FeO + 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O
+ 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O = S4O
= S4O + 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
+ 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:___________ (写出计算过程)。
(1)下列有关铁及其化合物的性质与用途具有对应关系的是___________
| A.铁粉具有还原性,可防止食物氧化变质 | B.高铁酸钾能溶于水,可作氧化剂 |
| C.氢氧化铁胶体具有碱性,可用于净水 | D.纯铁无杂质,可用作建筑材料 |
Ⅱ.K2FeO4的净水原理如图所示:

(2)下列说法错误的是___________
| A.K2FeO4中铁元素显+6价 |
| B.过程①中K2FeO4被细菌还原 |
| C.过程②中的Fe(OH)3胶体粒子带正电荷 |
| D.过程③中聚沉是由于胶体发生了渗析 |
(3)写出K2FeO4与水反应的化学方程式
Ⅲ.已知可用Cl2与Fe(NO3)3制备K2FeO4(含副产品KCl、KNO3),查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:

(4)①为获得尽可能纯净的高铁酸盐,pH应控制在
②写出在此条件下,反应的离子方程式:
(5)已知溶液的酸碱性及离子浓度会对反应试剂的氧化性、还原性产生影响。
某实验小组研究不同反应试剂对K2FeO4产率的影响,对比实验如下:
| 实验编号 | 反应试剂 | 实验现象 |
| Ⅰ | Cl2、FeCl3和少量KOH | 无明显现象 |
| Ⅱ | Cl2、FeCl3和过量KOH | 得到紫色溶液,无紫色固体 |
| Ⅲ | Cl2、Fe(NO3)3和过量KOH | 得到紫色溶液(颜色比Ⅱ深),有紫色固体 |
①由实验I、II的现象可知,Fe3+的还原性随溶液碱性的增强而
②实验II中K2FeO4的产率比实验III低,试解释其可能的原因:
③向实验II所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅,试解释其可能的原因:
(6)实验室测定含少量杂质的K2FeO4样品的纯度:称取0.1500g K2FeO4样品溶于碱性KI溶液中,调节pH至弱酸性使混合液充分反应。用0.1000 mol·L−1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00 mL。滴定时,发生反应的离子方程式:FeO
 + 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O
+ 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O = S4O
= S4O + 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
+ 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
您最近一年使用:0次
解题方法
2 . 电解金属锰阳极渣(主要成分MnO2,杂质为PbCO3、Fe2O3、CuO)和黄铁矿(FeS2)为原料可制备Mn3O4,其流程如图所示:
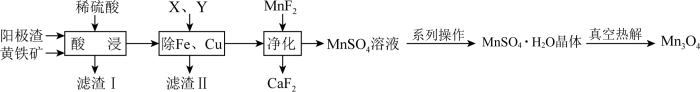
已知:部分阳离子以氢氧化物形式完全沉淀时的pH如下:Fe3+ 3.7,Fe2+ 9.7,Cu2+ 7.4,Mn2+ 9.8
回答下列问题:
(1)“酸浸”过程中,滤渣Ⅰ的主要成分为S、______ (填化学式)。
(2)“酸浸”过程中Fe2+、Fe3+的质量浓度、Mn浸出率与时间的关系如图1所示。
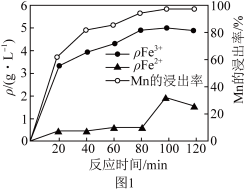
20~80min,浸出Mn元素的主要离子方程式为______ 。80~100min时,Fe2+浓度上升的原因可能是______ 。
(3)“除Fe、Cu”过程中依次加入的试剂X、Y为______ (填序号)。
A.NH3•H2O、H2O2 B.H2O2、CaCO3 C.SO2、MnCO3
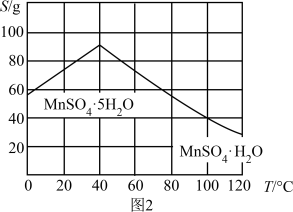
(4)硫酸锰晶体的溶解度曲线如图2,由MnSO4溶液获得MnSO4•H2O晶体的系列操作为______ 、洗涤、干燥。
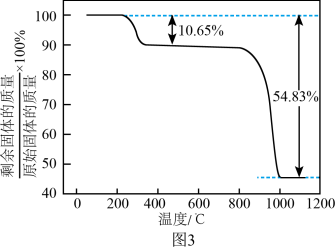
(5)“真空热解”过程中,测得固体的质量随温度变化如图3所示。需控制的温度为______ 。
(6)由MnSO4溶液制取Mn3O4的另一种方案是:向MnSO4溶液中加入氨水,产生Mn(OH)2沉淀和少量Mn2(OH)2SO4,滤出,洗净,加水打成浆,浆液边加热边持续通空气,制得Mn3O4。沉淀加热通空气过程中,7小时之前,溶液的pH=6,7小时之后迅速下降,原因是______ 。

已知:部分阳离子以氢氧化物形式完全沉淀时的pH如下:Fe3+ 3.7,Fe2+ 9.7,Cu2+ 7.4,Mn2+ 9.8
回答下列问题:
(1)“酸浸”过程中,滤渣Ⅰ的主要成分为S、
(2)“酸浸”过程中Fe2+、Fe3+的质量浓度、Mn浸出率与时间的关系如图1所示。

20~80min,浸出Mn元素的主要离子方程式为
(3)“除Fe、Cu”过程中依次加入的试剂X、Y为
A.NH3•H2O、H2O2 B.H2O2、CaCO3 C.SO2、MnCO3
(4)硫酸锰晶体的溶解度曲线如图2,由MnSO4溶液获得MnSO4•H2O晶体的系列操作为

(5)“真空热解”过程中,测得固体的质量随温度变化如图3所示。需控制的温度为

(6)由MnSO4溶液制取Mn3O4的另一种方案是:向MnSO4溶液中加入氨水,产生Mn(OH)2沉淀和少量Mn2(OH)2SO4,滤出,洗净,加水打成浆,浆液边加热边持续通空气,制得Mn3O4。沉淀加热通空气过程中,7小时之前,溶液的pH=6,7小时之后迅速下降,原因是
您最近一年使用:0次
2023-04-27更新
|
856次组卷
|
2卷引用:山东省泰安市2023届高三下学期二模考试化学试题
解题方法
3 . 锰酸锂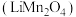 是一种锂电池的正极材料。工业上以方锰矿(主要成分为
是一种锂电池的正极材料。工业上以方锰矿(主要成分为 ,还含有少量的
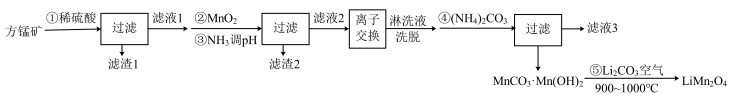
,还含有少量的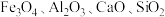 )为原料制备锰酸锂的流程如下:
)为原料制备锰酸锂的流程如下:
已知:I. 时,相关物质的
时,相关物质的 如下表:
如下表:
II. 时,
时, 电离常数
电离常数
III.离子浓度低于 时即为沉淀完全
时即为沉淀完全
回答下列问题:
(1)写出步骤①溶于稀硫酸时杂质 反应的离子方程式
反应的离子方程式___________ 。
(2)滤渣1的成分是_____ (填化学式);步骤②加入 的目的是
的目的是____ 。
(3)步骤③加入 目的是除去杂质离子,若溶液中
目的是除去杂质离子,若溶液中 浓度为
浓度为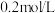 ,要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控
,要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控 的范围应该为
的范围应该为_______ 。反应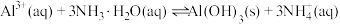 的平衡常数
的平衡常数
________ 。
(4)“离子交换”步骤和“洗脱”过程是利用反应: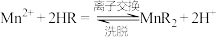 (
( 是氢型交换树脂)的平衡移动将
是氢型交换树脂)的平衡移动将 进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用
进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用_____ 。
(5)步骤④反应未见气体生成,则该反应留存在滤液3中的产物有___________ (填化学式)。
(6)步骤⑤反应的化学方程式为___________ 。
 是一种锂电池的正极材料。工业上以方锰矿(主要成分为
是一种锂电池的正极材料。工业上以方锰矿(主要成分为 ,还含有少量的
,还含有少量的 )为原料制备锰酸锂的流程如下:
)为原料制备锰酸锂的流程如下:
已知:I.
 时,相关物质的
时,相关物质的 如下表:
如下表:物质 |
|
|
|
|
|
|
|
|
|
|
|
 时,
时, 电离常数
电离常数
III.离子浓度低于
 时即为沉淀完全
时即为沉淀完全回答下列问题:
(1)写出步骤①溶于稀硫酸时杂质
 反应的离子方程式
反应的离子方程式(2)滤渣1的成分是
 的目的是
的目的是(3)步骤③加入
 目的是除去杂质离子,若溶液中
目的是除去杂质离子,若溶液中 浓度为
浓度为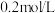 ,要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控
,要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控 的范围应该为
的范围应该为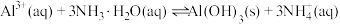 的平衡常数
的平衡常数
(4)“离子交换”步骤和“洗脱”过程是利用反应:
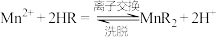 (
( 是氢型交换树脂)的平衡移动将
是氢型交换树脂)的平衡移动将 进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用
进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用(5)步骤④反应未见气体生成,则该反应留存在滤液3中的产物有
(6)步骤⑤反应的化学方程式为
您最近一年使用:0次
2023-01-13更新
|
1133次组卷
|
2卷引用:四川省绵阳市2023届高三第二次诊断性考试理科综合化学试题
名校
解题方法
4 . 含有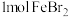 的溶液中,通入
的溶液中,通入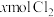 ,反应的离子方程式表示错误的是
,反应的离子方程式表示错误的是
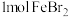 的溶液中,通入
的溶液中,通入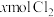 ,反应的离子方程式表示错误的是
,反应的离子方程式表示错误的是A.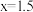 , ,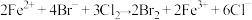 |
B.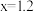 , ,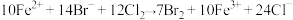 |
C. , ,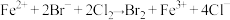 |
D. , ,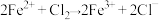 |
您最近一年使用:0次
2021-04-08更新
|
648次组卷
|
4卷引用:上海市金山区2021届高三二模化学试题
上海市金山区2021届高三二模化学试题(已下线)三轮冲刺卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)宁夏石嘴山市第三中学2021-2022学年高三上学期期中考试化学(理)试题陕西省西安市铁一中学2023-2024学年高一上学期第二次月考化学试题
名校
5 . 某离子反应涉及到 H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法不正确 的是
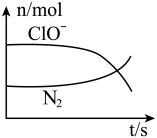

| A.该反应中Cl-为还原产物 |
| B.氧化剂与还原剂物质的量比为3:2 |
| C.消耗1 mol还原剂,转移6 mol电子 |
| D.氧化性:ClO-比 N2强 |
您最近一年使用:0次
2019-07-02更新
|
970次组卷
|
11卷引用:辽宁省沈阳市东北育才学校2020届高三上学期第一次模拟考试化学试题
辽宁省沈阳市东北育才学校2020届高三上学期第一次模拟考试化学试题福建省莆田第六中学2018-2019学年高一(实验班)下学期期中考试化学试题福建省莆田第六中学2018-2019学年高一下学期期中考试化学试题(已下线)2019年10月6日《每日一题》必修1 —— 每周一测甘肃省兰州第一中学2019-2020学年高一上学期期中考试化学试题上海市格致中学2020届高三上学期开学考试化学试题鲁科版(2019)高一必修第一册第二章B 素养拓展区 过素养 学科素养拓展训练高一必修第一册(苏教2019版)专题3 B 素养拓展区 过素养 学科素养拓展训练甘肃省嘉峪关市第一中学2021届高三上学期一模考试化学试卷湖北省十堰市第二中学2021-2022学年高一上学期12月考试化学试题福建省宁德博雅培文学校2022-2023学年高一上学期线上期末考试化学试题
名校
6 . 《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴趣。“修旧如旧”是文物保护的主旨。
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有Cu和_______ 。
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈和有害锈,结构如图所示:
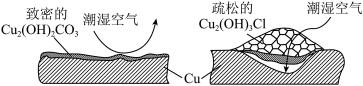
Cu2(OH)2CO3和Cu2(OH)3Cl分别属于无害锈和有害锈,请解释原因_____________ 。
(3)文献显示有害锈的形成过程中会产生CuCl(白色不溶于水的固体),请结合下图回答:
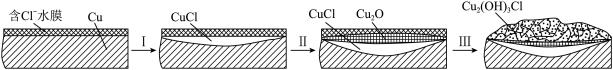
① 过程Ⅰ的正极反应物是___________ 。
② 过程Ⅰ负极的电极反应式是_____________ 。
(4)青铜器的修复有以下三种方法:
ⅰ.柠檬酸浸法:将腐蚀文物直接放在2%-3%的柠檬酸溶液中浸泡除锈;
ⅱ.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)2CO3;
ⅲ.BTA保护法:
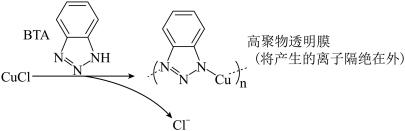
请回答下列问题:
①写出碳酸钠法的离子方程式___________________ 。
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有___________ 。
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl-,能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有Cu和
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈和有害锈,结构如图所示:

Cu2(OH)2CO3和Cu2(OH)3Cl分别属于无害锈和有害锈,请解释原因
(3)文献显示有害锈的形成过程中会产生CuCl(白色不溶于水的固体),请结合下图回答:

① 过程Ⅰ的正极反应物是
② 过程Ⅰ负极的电极反应式是
(4)青铜器的修复有以下三种方法:
ⅰ.柠檬酸浸法:将腐蚀文物直接放在2%-3%的柠檬酸溶液中浸泡除锈;
ⅱ.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)2CO3;
ⅲ.BTA保护法:

请回答下列问题:
①写出碳酸钠法的离子方程式
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl-,能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
您最近一年使用:0次
2019-06-11更新
|
1879次组卷
|
7卷引用:中国人民大学附属中学2019届高三考前热身练习化学试题
真题
名校
7 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________ 、_______________ 。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________ 。
②将下列实验操作步骤正确排序___________________ (填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________ (列式表示)。若实验时按a、d次序操作,则使x__________ (填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
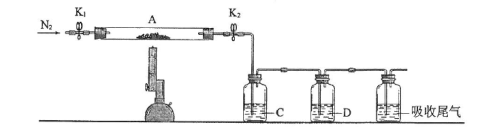
①C、D中的溶液依次为_________ (填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________ 。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________ 。
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是
②将下列实验操作步骤正确排序
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式
您最近一年使用:0次
2017-08-08更新
|
9166次组卷
|
30卷引用:河南省郑州市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题
河南省郑州市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题贵州省贵阳市第一中学2020届高三教学质量监测理科综合化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)安徽省六安市第一中学2017-2018学年高二上学期开学考试化学试题四川省双流中学2017-2018学年高二上学期开学考试化学试题江西省上高二中2018届高三上学期第三次月考化学试题(已下线)《考前20天终极攻略》-5月27日 综合实验设计、探究和评价(已下线)解密18 物质的制备、实验方案的设计与评价——备战2018年高考化学之高频考点解密百所名校联考-金属及其化合物吉林省延边市第二中学2020届高三入学考试化学试题安徽省黄山市屯溪第一中学2019-2020学年高二上学期入学摸底考试化学试题2020届高考化学二轮复习大题精准训练——定量分析化学实验中物质含量的测定2020届高考化学二轮复习大题精准训练——化学实验方案的设计及评价河北省衡水中学2020届高三四月份质量监测理综化学试题湖南省长沙市长郡中学2020届高三4月份教学质量监测理综化学试题(已下线)广东省深圳中学2020届高三3月份教学质量监测卷理综化学试题河北省石家庄市第二中学2020届高中毕业班二月份网络教学质量监测卷理科综合化学部分2020届湖南省长沙市礼雅中学高中毕业班四月份网络教学质量监测卷理科综合化学部分湖南省长沙市雅礼中学2020届高三5月高考化学模拟试卷(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精讲)——2021年高考化学一轮复习讲练测山东济南市历城第二中学2020-2021学年高二上学期开学考试化学试题高一必修第一册(鲁科2019)第3章 第2节 硫的转化 高考帮福建省福州市第二中学2021届高三上学期第一次月考化学试题(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第一节 硫及其化合物云南省保山第九中学2021届高三上学期开学考试化学试题云南省玉溪师范学院附属中学2021-2022学年高三 上学期期末考试化学试题(已下线)【教材实验热点】04 Fe(OH)2与Fe(OH)3胶体的制备云南省普洱市第一中学2021-2022学年高三下学期3月份考试理综化学试题(已下线)专题26 定量测定类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型31 Fe2+、Fe3+的检验与性质探究
解题方法
8 . 用11.92gNaClO配成100mL溶液,向其中加入0.01mol Na2Sx恰好完全反应,生成Na2SO4和NaCl。
(1)NaClO溶液的物质的量浓度_________ mol·L-1。
(2)化学式Na2Sx中的X=____________ 。
(1)NaClO溶液的物质的量浓度
(2)化学式Na2Sx中的X=
您最近一年使用:0次
2017-04-03更新
|
1559次组卷
|
7卷引用:2017届浙江省绍兴市高三3月教学质量调测考试化学试卷2
名校
9 . 为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
(1)固体I中主要成分为__________ ,捕获剂所捕获的气体主要是_________ 。
(2)处理含NH4+废水时,发生反应的离子方程式为___________ 。
(3)若X为适量空气,严格控制空气用量的原因是____________ 。
(4)工业废气中的SO2、NO还可采用NaClO2溶液作为吸收剂进行净化,在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表:
①写出NaClO2溶液脱硝过程中主要反应的离子方程式_________________ 。增加压强,NO的转化率__________ (填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐__________ (填“增大”、“不变”或“减小”)。
③如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______________ 。
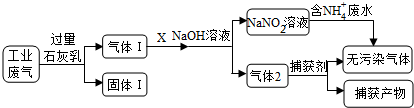
(1)固体I中主要成分为
(2)处理含NH4+废水时,发生反应的离子方程式为
(3)若X为适量空气,严格控制空气用量的原因是
(4)工业废气中的SO2、NO还可采用NaClO2溶液作为吸收剂进行净化,在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式
②随着吸收反应的进行,吸收剂溶液的pH逐渐
③如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是
您最近一年使用:0次
2017-03-19更新
|
483次组卷
|
2卷引用:2017届吉林省长白山市高三第二次模拟考试理综化学试卷