名校
解题方法
1 . 氧化铝陶瓷常用于厚膜集成电路,制备氧化铝陶瓷的合成路线如图所示,回答下列问题。
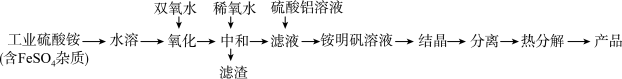
(1)“氧化”步骤发生的离子方程式为:___ ,使用双氧水作氧化剂优点为___ :
(2)“热分解”得到的产物除了氧化铝外,还有NH3、N2、SO2、SO3、H2O生成,则氧化产物和还原产物的物质的量之比为___ 。
(3)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,“热分解”步骤中,其各温度段内受热“失重计算值”(失重计算值%=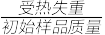 ×100%)如表所示:
×100%)如表所示:
通过上述数据经粗略计算可判断,在温度区间___ 铵明矾基本上失去了全部结晶水。
(4)“结晶”步骤中常采用的操作是___ 。
(5)合成过程中常使用过量的工业硫酸铵,可利用硫酸铵溶液水解显酸性抑制硫酸铝水解,另外的一个重要作用是___ 。
(6)通常认为金属离子浓度等于1×10-5mol/L即可认为沉淀完全,试计算常温下“中和”步骤中需要调节溶液pH=___ (保留一位小数,已知:Ksp[Fe(OH)3]=8.0×10-38,lg5=0.7)。

(1)“氧化”步骤发生的离子方程式为:
(2)“热分解”得到的产物除了氧化铝外,还有NH3、N2、SO2、SO3、H2O生成,则氧化产物和还原产物的物质的量之比为
(3)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,“热分解”步骤中,其各温度段内受热“失重计算值”(失重计算值%=
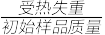 ×100%)如表所示:
×100%)如表所示:| 温度区间(℃) | 18→190 | 190→430 | 430→505 | 505→900 |
| 失重计算值(%) | 39.20 | 7.80 | 13.00 | 26.00 |
(4)“结晶”步骤中常采用的操作是
(5)合成过程中常使用过量的工业硫酸铵,可利用硫酸铵溶液水解显酸性抑制硫酸铝水解,另外的一个重要作用是
(6)通常认为金属离子浓度等于1×10-5mol/L即可认为沉淀完全,试计算常温下“中和”步骤中需要调节溶液pH=
您最近一年使用:0次
2020-04-04更新
|
354次组卷
|
4卷引用:陕西省榆林市 2020届高考3月线上模拟考试化学试题
陕西省榆林市 2020届高考3月线上模拟考试化学试题安徽省六安市第一中学2020届高三下学期第九次模拟考试理综化学试题(已下线)考点14 铝及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点14 铝及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)
2 .  (钒酸铋)是一种黄色颜料。某小组以辉铋矿(含77.1%
(钒酸铋)是一种黄色颜料。某小组以辉铋矿(含77.1% 、19.5%Fe和3.4%
、19.5%Fe和3.4% )为原料制备钒酸铋,并回收
)为原料制备钒酸铋,并回收 制备食品抗氧化剂
制备食品抗氧化剂 的流程如下:
的流程如下: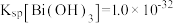 ,
,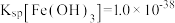 ;当金属离子浓度
;当金属离子浓度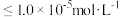 时,认为该离子已沉淀完全。请回答下列问题:
时,认为该离子已沉淀完全。请回答下列问题:
(1)“焙烧”中采用高压空气的目的是_______ , 转化成
转化成 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(2)浸渣的主要成分是_______ (填化学式)。
(3)“酸浸”得到的浸液中 ,则“除铁”调节pH的范围为
,则“除铁”调节pH的范围为_______ 。
(4)“合成”过程中将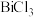 溶液和
溶液和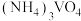 溶液混合容易形成
溶液混合容易形成 胶体,导致过滤困难。为防止生成胶体可采用的措施为
胶体,导致过滤困难。为防止生成胶体可采用的措施为_______ (答一条)。
(5)向饱和碳酸钠溶液中通入过量 可制得
可制得 ,发生反应的化学方程式为
,发生反应的化学方程式为_______ 。 易变质生成
易变质生成 ,设计简单实验证明产品是否变质:
,设计简单实验证明产品是否变质:_______ 。(已知: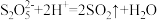 )
)
(6)某工厂用20吨该辉铋矿,最终得到18.468吨 ,则该过程中Bi的损耗率为
,则该过程中Bi的损耗率为______ %。
 (钒酸铋)是一种黄色颜料。某小组以辉铋矿(含77.1%
(钒酸铋)是一种黄色颜料。某小组以辉铋矿(含77.1% 、19.5%Fe和3.4%
、19.5%Fe和3.4% )为原料制备钒酸铋,并回收
)为原料制备钒酸铋,并回收 制备食品抗氧化剂
制备食品抗氧化剂 的流程如下:
的流程如下:
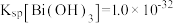 ,
,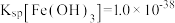 ;当金属离子浓度
;当金属离子浓度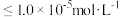 时,认为该离子已沉淀完全。请回答下列问题:
时,认为该离子已沉淀完全。请回答下列问题:(1)“焙烧”中采用高压空气的目的是
 转化成
转化成 发生反应的化学方程式为
发生反应的化学方程式为(2)浸渣的主要成分是
(3)“酸浸”得到的浸液中
 ,则“除铁”调节pH的范围为
,则“除铁”调节pH的范围为(4)“合成”过程中将
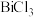 溶液和
溶液和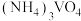 溶液混合容易形成
溶液混合容易形成 胶体,导致过滤困难。为防止生成胶体可采用的措施为
胶体,导致过滤困难。为防止生成胶体可采用的措施为(5)向饱和碳酸钠溶液中通入过量
 可制得
可制得 ,发生反应的化学方程式为
,发生反应的化学方程式为 易变质生成
易变质生成 ,设计简单实验证明产品是否变质:
,设计简单实验证明产品是否变质: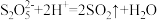 )
)(6)某工厂用20吨该辉铋矿,最终得到18.468吨
 ,则该过程中Bi的损耗率为
,则该过程中Bi的损耗率为
您最近一年使用:0次
2024·陕西榆林·三模
名校
3 .  (三氯化六氨合钴,
(三氯化六氨合钴,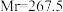 )是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备
)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备 。
。
已知:①在 时,
时, 恰好完全沉淀为
恰好完全沉淀为 ;
;
②不同温度下 在水中的溶解度如图所示;
在水中的溶解度如图所示; 易潮解,Co(Ⅲ)的氧化性强于
易潮解,Co(Ⅲ)的氧化性强于 。
。
制备步骤如下:
Ⅰ. 的制备:用金属钴与氯气反应制备
的制备:用金属钴与氯气反应制备 ,实验中利用如图装置(连接处橡胶管省略)进行制备。
,实验中利用如图装置(连接处橡胶管省略)进行制备。 锥形瓶内加入
锥形瓶内加入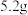 研细的
研细的 、
、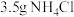 和
和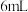 水,加热溶解后加入
水,加热溶解后加入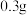 活性炭作催化剂。
活性炭作催化剂。
Ⅲ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下并缓慢加入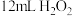 溶液。
溶液。
Ⅳ.在60℃下反应一段时间后,经过___________、过滤、洗涤、干燥等操作,得到橙黄色的 晶体
晶体 。
。
请回答下列问题:
(1)仪器a的名称为___________ 。
(2)用图中的装置组合制备 ,仪器的连接顺序为
,仪器的连接顺序为___________ 。装置B的作用是___________ 。
(3)制备三氯化六氨合钴的反应方程式为___________ 。
(4)在制备 时,加入浓氨水前,需在步骤Ⅱ中加入
时,加入浓氨水前,需在步骤Ⅱ中加入 ,请结合平衡移动原理解释原因
,请结合平衡移动原理解释原因___________ 。
(5)步骤Ⅲ中在加入 溶液时,控制温度在10℃以下缓慢加入的目的是
溶液时,控制温度在10℃以下缓慢加入的目的是___________ 。
(6)在步骤Ⅳ中过滤、洗涤、干燥之前的操作为___________ 、___________ 。
(7)制得 产品的产率为
产品的产率为___________ %(精确到0.1%)。
 (三氯化六氨合钴,
(三氯化六氨合钴,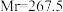 )是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备
)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备 。
。已知:①在
 时,
时, 恰好完全沉淀为
恰好完全沉淀为 ;
;②不同温度下
 在水中的溶解度如图所示;
在水中的溶解度如图所示;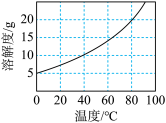
 易潮解,Co(Ⅲ)的氧化性强于
易潮解,Co(Ⅲ)的氧化性强于 。
。制备步骤如下:
Ⅰ.
 的制备:用金属钴与氯气反应制备
的制备:用金属钴与氯气反应制备 ,实验中利用如图装置(连接处橡胶管省略)进行制备。
,实验中利用如图装置(连接处橡胶管省略)进行制备。
 锥形瓶内加入
锥形瓶内加入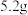 研细的
研细的 、
、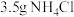 和
和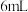 水,加热溶解后加入
水,加热溶解后加入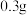 活性炭作催化剂。
活性炭作催化剂。Ⅲ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下并缓慢加入
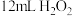 溶液。
溶液。Ⅳ.在60℃下反应一段时间后,经过___________、过滤、洗涤、干燥等操作,得到橙黄色的
 晶体
晶体 。
。请回答下列问题:
(1)仪器a的名称为
(2)用图中的装置组合制备
 ,仪器的连接顺序为
,仪器的连接顺序为(3)制备三氯化六氨合钴的反应方程式为
(4)在制备
 时,加入浓氨水前,需在步骤Ⅱ中加入
时,加入浓氨水前,需在步骤Ⅱ中加入 ,请结合平衡移动原理解释原因
,请结合平衡移动原理解释原因(5)步骤Ⅲ中在加入
 溶液时,控制温度在10℃以下缓慢加入的目的是
溶液时,控制温度在10℃以下缓慢加入的目的是(6)在步骤Ⅳ中过滤、洗涤、干燥之前的操作为
(7)制得
 产品的产率为
产品的产率为
您最近一年使用:0次
名校
解题方法
4 . 铈的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳酸铈(主要含CeFCO3)为原料制备CeO2的工艺流程如下:

已知:①CeO2具有较强的氧化性,难溶于一般的酸或碱。
②F-能和很多金属离子形成较为稳定的配合物,如Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF ;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
③Ce4+能被萃取剂TBP萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_______ 。
(2)“氧化焙烧”后的固体产物中含有CeO2和CeF4,CeO2和CeF4的物质的量之比为3:1,“酸浸”时发生反应的离子方程式为_______ 。传统工艺中用盐酸替代硫酸,其缺点为_______ 。
(3)TBP是一种有机萃取剂,“萃取”时存在反应CeF3++TBP CeTBP4++F-,氟洗液中添加Al3+的作用是
CeTBP4++F-,氟洗液中添加Al3+的作用是_______ 。
(4)“反萃取”步骤中发生反应的离子方程式为_______ 。
(5)已知CeO2(1-x)中的Ce为+3、+4价且x>0,现取CeO2(1-x)固体0.875g,加入足量硫酸和3.058gFeSO4·7H2O(M=278g·mol-1)充分溶解,使Ce4+全部被还原成Ce3+,再用0.1000mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00mL标准溶液。(已知氧化性:Ce4+>KMnO4)
①固体中+4价Ce的质量分数为_______ 。
②若加入的FeSO4·7H2O部分变质,会导致测定的x值_______ (填“偏高”“偏低”或“不变”)。

已知:①CeO2具有较强的氧化性,难溶于一般的酸或碱。
②F-能和很多金属离子形成较为稳定的配合物,如Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF
 ;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。③Ce4+能被萃取剂TBP萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是
(2)“氧化焙烧”后的固体产物中含有CeO2和CeF4,CeO2和CeF4的物质的量之比为3:1,“酸浸”时发生反应的离子方程式为
(3)TBP是一种有机萃取剂,“萃取”时存在反应CeF3++TBP
 CeTBP4++F-,氟洗液中添加Al3+的作用是
CeTBP4++F-,氟洗液中添加Al3+的作用是(4)“反萃取”步骤中发生反应的离子方程式为
(5)已知CeO2(1-x)中的Ce为+3、+4价且x>0,现取CeO2(1-x)固体0.875g,加入足量硫酸和3.058gFeSO4·7H2O(M=278g·mol-1)充分溶解,使Ce4+全部被还原成Ce3+,再用0.1000mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00mL标准溶液。(已知氧化性:Ce4+>KMnO4)
①固体中+4价Ce的质量分数为
②若加入的FeSO4·7H2O部分变质,会导致测定的x值
您最近一年使用:0次
名校
解题方法
5 . 研究小组以 (绿色固体)、
(绿色固体)、 、THF(四氯呋喃,液体)等物质为原料制备固体配合物
、THF(四氯呋喃,液体)等物质为原料制备固体配合物 ,该配合物可作为有机反应的催化剂
,该配合物可作为有机反应的催化剂
(1)无水 (紫色固体,易升华)的制备装置如图所示(夹持装置略)。
(紫色固体,易升华)的制备装置如图所示(夹持装置略)。

①仪器a的名称为________ 。
②本实验持续通入 的目的有赶走体系中原有的空气、
的目的有赶走体系中原有的空气、________ 。
③反应管的温度升到660℃时发生反应,生成 和
和 (光气),其化学方程式为
(光气),其化学方程式为________ 。 有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是
有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是________ (填化学式)。
④反应管右端有15cm在加热炉外,其作用是________________ 。
(2) 的合成装置如图所示(搅拌和夹持装置咯)
的合成装置如图所示(搅拌和夹持装置咯)

将制备的无水 和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF。制备反应的原理为
和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF。制备反应的原理为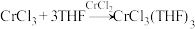 。
。
实验时烧瓶中THF受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与滤纸套筒内的物质接触。当液面达到虹吸管3顶端时,经虹吸管3返回双颈烧瓶.从而实现了THF与 的连续反应及产物的连续萃取。
的连续反应及产物的连续萃取。
①锌粉的作用是________________ (用化学方程式表示)。
② 和
和 在THF的溶解性分别为
在THF的溶解性分别为________ 、________ (填“溶”或“不溶”)。
③合成反应完成后,取下双颈烧瓶,蒸发THF得到固体产品6.7410g。则该实验的产率为________ %。[已知: 的摩尔质量为152g/mol;
的摩尔质量为152g/mol; 的摩尔质量为374.5g/mol]
的摩尔质量为374.5g/mol]
 (绿色固体)、
(绿色固体)、 、THF(四氯呋喃,液体)等物质为原料制备固体配合物
、THF(四氯呋喃,液体)等物质为原料制备固体配合物 ,该配合物可作为有机反应的催化剂
,该配合物可作为有机反应的催化剂(1)无水
 (紫色固体,易升华)的制备装置如图所示(夹持装置略)。
(紫色固体,易升华)的制备装置如图所示(夹持装置略)。
①仪器a的名称为
②本实验持续通入
 的目的有赶走体系中原有的空气、
的目的有赶走体系中原有的空气、③反应管的温度升到660℃时发生反应,生成
 和
和 (光气),其化学方程式为
(光气),其化学方程式为 有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是
有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是④反应管右端有15cm在加热炉外,其作用是
(2)
 的合成装置如图所示(搅拌和夹持装置咯)
的合成装置如图所示(搅拌和夹持装置咯)
将制备的无水
 和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF。制备反应的原理为
和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF。制备反应的原理为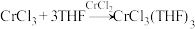 。
。实验时烧瓶中THF受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与滤纸套筒内的物质接触。当液面达到虹吸管3顶端时,经虹吸管3返回双颈烧瓶.从而实现了THF与
 的连续反应及产物的连续萃取。
的连续反应及产物的连续萃取。①锌粉的作用是
②
 和
和 在THF的溶解性分别为
在THF的溶解性分别为③合成反应完成后,取下双颈烧瓶,蒸发THF得到固体产品6.7410g。则该实验的产率为
 的摩尔质量为152g/mol;
的摩尔质量为152g/mol; 的摩尔质量为374.5g/mol]
的摩尔质量为374.5g/mol]
您最近一年使用:0次
2023-03-14更新
|
695次组卷
|
4卷引用:2024届陕西省西安中学高三下学期三模理综试题-高中化学
名校
解题方法
6 . 三盐基硫酸铅(3PbO·PbSO4·H2O)简称三盐,白色或微黄色粉末,稍带甜味、有毒。200℃以上开始失去结晶水,不溶于水及有机溶剂。可用作聚氯乙烯的热稳定剂。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。
已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。
请回答下列问题:
(1)步骤①转化的目的是_________ ,滤液1中的溶质为Na2CO3和______ (填化学式)。
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是____________________ 。(任写一条)。其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为____________ 。
(3)滤液2中可循环利用的溶质为__________ (填化学式)。若步骤④沉铅后的滤液中c(Pb2+)=1.82×l0-5mol ·L-1,则此时c(SO )
)________ mol·L-1。
(4)步骤⑥合成三盐的化学方程式为_________ 。若得到纯净干燥的三盐49.5t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为__________ 。简述步骤⑦洗涤沉淀的方法_______________________ 。
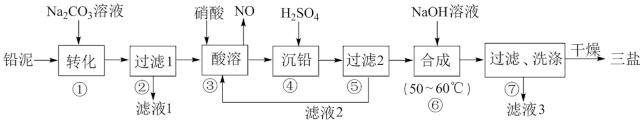
已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。
请回答下列问题:
(1)步骤①转化的目的是
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是
(3)滤液2中可循环利用的溶质为
 )
)(4)步骤⑥合成三盐的化学方程式为
您最近一年使用:0次
2017-04-25更新
|
231次组卷
|
2卷引用:陕西省咸阳市2017届高三模拟考试(三)理综化学试题



