解题方法
1 . Fe/Fe3O4复合物是一种高密度磁记录材料,磁记录材料有记录和存储信息的功能。制备该材料的一种流程如下:
Ⅰ、相关反应原理:
①Fe2++2OH-=Fe(OH)2
②3Fe(OH)2=Fe+2Fe(OH)3
③Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O
Ⅱ、25℃时Fe(OH)2的Ksp=8.0×10-16
1.用FeCl2溶液和KOH溶液制备Fe/Fe3O4反应的离子方程式为_____ 。该“反应”中通入氩气的原因_____ 。
2.取少量反应后溶液于试管中,选择试剂_____,可证明FeCl2溶液已反应完全。
3.已知参加反应的FeCl2溶液浓度为lmol·L−1。由题给信息分析,25℃时,当pH<2时,Fe/Fe3O4产率极低的原因_____ 。
下图1为回流时间与Fe/Fe3O4产率的关系图,图2为回流1h所得产品的X射线衍射图。_____ 。
通过Fe3O4和FeO的热化学循环可以利用太阳能,其转化关系如图所示。
6.从绿色化学角度评价该循环过程(说一点)。_____

Ⅰ、相关反应原理:
①Fe2++2OH-=Fe(OH)2
②3Fe(OH)2=Fe+2Fe(OH)3
③Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O
Ⅱ、25℃时Fe(OH)2的Ksp=8.0×10-16
1.用FeCl2溶液和KOH溶液制备Fe/Fe3O4反应的离子方程式为
2.取少量反应后溶液于试管中,选择试剂_____,可证明FeCl2溶液已反应完全。
| A.SO2 | B.铁粉 |
| C.KSCN溶液 | D.KSCN溶液新制氯水 |
下图1为回流时间与Fe/Fe3O4产率的关系图,图2为回流1h所得产品的X射线衍射图。

通过Fe3O4和FeO的热化学循环可以利用太阳能,其转化关系如图所示。
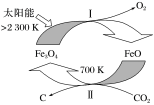
| A.反应物 | B.中间产物 | C.催化剂 | D.产物 |
您最近一年使用:0次
解题方法
2 . 氮及其化合物在生产、生活中广泛应用。
Ⅰ.氮元素化合价-物质类别关系图如图所示。

(1)图中A可以是__________ (写化学式)。写出一个能够生成B的化学方程式__________ 。
(2)实验室中,检验溶液中是否含有 的操作方法是
的操作方法是__________ 。
(3)水体中硝酸盐含量过高对环境不利,通过电催化法可以将水体中的硝酸盐进行合理转化。写出在中性介质中硝酸盐转化为氮气的阴极电极反应式__________ 。
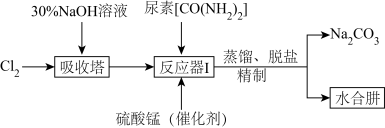
Ⅱ.下图为实验室模拟尿素法制备水合肼( )的流程图:
)的流程图:
已知:① 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 。
。
②一定条件下,碱性NaClO溶液与尿素溶液反应生成 。
。
回答下列问题:
(4)“吸收塔”内发生反应的离子方程式为__________ 。
(5)写出“反应器Ⅰ”中生成水合肼反应的化学方程式为__________ 。
(6)“反应器Ⅰ”要控制NaClO溶液的用量,其主要目的是__________ 。
Ⅰ.氮元素化合价-物质类别关系图如图所示。

(1)图中A可以是
(2)实验室中,检验溶液中是否含有
 的操作方法是
的操作方法是(3)水体中硝酸盐含量过高对环境不利,通过电催化法可以将水体中的硝酸盐进行合理转化。写出在中性介质中硝酸盐转化为氮气的阴极电极反应式
Ⅱ.下图为实验室模拟尿素法制备水合肼(
 )的流程图:
)的流程图:
已知:①
 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 。
。②一定条件下,碱性NaClO溶液与尿素溶液反应生成
 。
。回答下列问题:
(4)“吸收塔”内发生反应的离子方程式为
(5)写出“反应器Ⅰ”中生成水合肼反应的化学方程式为
(6)“反应器Ⅰ”要控制NaClO溶液的用量,其主要目的是
您最近一年使用:0次
名校
解题方法
3 . 某同学在实验室欲配制物质的量浓度均为1.0mol·L-1的NaOH溶液、稀硫酸各450mL。提供的试剂是:NaOH固体、18.4mol·L-1的浓硫酸(密度为1.84g·cm-3)和蒸馏水。
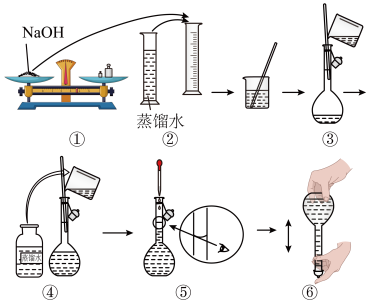
(1)请你观察图示判断其中不正确的操作有_______ 。(填序号)
(2)应用托盘天平称量NaOH_______ g,应用量筒量取浓硫酸_______ mL。
(3)在配制上述溶液实验中,下列操作引起结果偏低的有_______ 。
A.该学生在量取浓硫酸时,仰视刻度线
B.溶解硫酸后没有冷却至室温就立即完成后面的配制操作
C.在烧杯中溶解搅拌时,溅出少量溶液
D.没有用蒸馏水洗涤烧杯2~3次,并将洗涤液移入容量瓶中
E.将量筒洗涤2~3次,并全部转移至容量瓶中
F.容量瓶中原来存有少量蒸馏水
G.胶头滴管加水定容时俯视刻度线
(4)若用0.01000mol·L-1K2Cr2O7(酸性)溶液滴定20.00mL未知浓度的含Fe2+的溶液,恰好完全反应时消10.00mLK2Cr2O7溶液,写出该反应的离子反应方程式_______ ,待测液中Fe2+的浓度是_______ g/L(保留4位有效数字)。
(1)请你观察图示判断其中不正确的操作有

(2)应用托盘天平称量NaOH
(3)在配制上述溶液实验中,下列操作引起结果偏低的有
A.该学生在量取浓硫酸时,仰视刻度线
B.溶解硫酸后没有冷却至室温就立即完成后面的配制操作
C.在烧杯中溶解搅拌时,溅出少量溶液
D.没有用蒸馏水洗涤烧杯2~3次,并将洗涤液移入容量瓶中
E.将量筒洗涤2~3次,并全部转移至容量瓶中
F.容量瓶中原来存有少量蒸馏水
G.胶头滴管加水定容时俯视刻度线
(4)若用0.01000mol·L-1K2Cr2O7(酸性)溶液滴定20.00mL未知浓度的含Fe2+的溶液,恰好完全反应时消10.00mLK2Cr2O7溶液,写出该反应的离子反应方程式
您最近一年使用:0次
2022-08-30更新
|
326次组卷
|
2卷引用:宁夏回族自治区银川一中2022-2023学年高三上学期第一次月考理科综合化学试题
4 . 磷化铝(AlP)和磷化氢(PH3)都是粮食储备常用的高效熏蒸杀虫剂。
(1)磷元素在元素周期表中的位置:_____ 。AlP遇水蒸气会发生反应放出PH3气体,该反应的另一种产物的化学式为_____ 。
(2)工业制备PH3的流程如图所示。

①次磷酸属于_____ 元酸。
②次磷酸分解反应Ⅲ的化学方程式为:_____ 。
③若起始时有1molP4参加反应,则整个工业流程中共生成_____ molPH3。(不考虑产物的损失)
(1)磷元素在元素周期表中的位置:
(2)工业制备PH3的流程如图所示。

①次磷酸属于
②次磷酸分解反应Ⅲ的化学方程式为:
③若起始时有1molP4参加反应,则整个工业流程中共生成
您最近一年使用:0次
名校
5 . FeCl3为黑棕色固体,无水氯化铁在300℃以上升华,遇潮湿空气极易潮解。
(1)甲组同学拟用下列装置制取纯净干燥的氯气。
①装置B的作用是_________
②装置A中发生反应时消耗的氧化剂和还原剂的物质的量之比为__________
(2)乙组同学选用甲组实验中的装置ABC和下列装置制取FeCl3

①乙组同学的实验装置中,依次连接的合理顺序为:a→_____ →_____ →_____ →_____ →_____ →_____
②连好装置,检查装置的气密性,先打开装置A中___________ (填仪器的名称)的活塞,直到______ 再点燃装置F处的酒精灯,目的是_______
③装置D的作用有_______
(3)实验结束后,取少量F中的固体加水溶解,欲对所得产物FeCl3中是否含有FeCl2进行检测,所需试剂是_______
a.KSCN b.H2O2 c.K3[Fe(CN)6] d. .K4[Fe(CN)6]
经检测发现溶液中含有Fe2+,丙同学认为所得产物FeCl3中一定含有FeCl2,丁同学认为不一定,理由是_____
(1)甲组同学拟用下列装置制取纯净干燥的氯气。
①装置B的作用是
②装置A中发生反应时消耗的氧化剂和还原剂的物质的量之比为
(2)乙组同学选用甲组实验中的装置ABC和下列装置制取FeCl3

①乙组同学的实验装置中,依次连接的合理顺序为:a→
②连好装置,检查装置的气密性,先打开装置A中
③装置D的作用有
(3)实验结束后,取少量F中的固体加水溶解,欲对所得产物FeCl3中是否含有FeCl2进行检测,所需试剂是
a.KSCN b.H2O2 c.K3[Fe(CN)6] d. .K4[Fe(CN)6]
经检测发现溶液中含有Fe2+,丙同学认为所得产物FeCl3中一定含有FeCl2,丁同学认为不一定,理由是
您最近一年使用:0次
解题方法
6 . A、B、C、D、E五种短周期元素的原子序数逐渐增大。A是原子半径最小的元素,B可形成多种同素异形体,其中一种的硬度是自然界中最大的。D元素原子的最外层电子数是次外层电子数的3倍。E元素的M层电子数等于A和B的质子数之和。
(1)写出元素D在元素周期表中的位置:________________________ 。
(2)B、C、D三种元素的最简单氢化物的稳定性由强到弱的顺序是________________ (填化学式)。
(3)A、B、C、D几种元素之间可以形成多种10电子微粒,写出上述10电子微粒中离子之间发生反应的一个离子方程式:________________________________ 。
(4)ED2是一种具有强氧化性的新型消毒剂,一定条件下4mol ED2与5 mol C2A4恰好完全反应,请写出反应的化学方程式:_________________________________ ;若反应消耗1 mol C2A4,则转移电子的物质的量为______________ 。
(1)写出元素D在元素周期表中的位置:
(2)B、C、D三种元素的最简单氢化物的稳定性由强到弱的顺序是
(3)A、B、C、D几种元素之间可以形成多种10电子微粒,写出上述10电子微粒中离子之间发生反应的一个离子方程式:
(4)ED2是一种具有强氧化性的新型消毒剂,一定条件下4mol ED2与5 mol C2A4恰好完全反应,请写出反应的化学方程式:
您最近一年使用:0次



