名校
解题方法
1 . 钨在自然界的储量只有620万吨,江西独占有520万吨。江西每年产生大量的钨冶炼渣(主要含SiO2、MnO2、Al2O3、CaO、MgO、FeO、Fe2O3以及少量重金属氧化物等),以钨冶炼渣为原料,提炼制备电池级硫酸锰的工艺流程如下: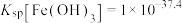 ,
,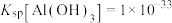 。
。
(1)“酸浸”时,为提高锰的浸出率,可采取的措施是_______ (写一种即可),滤渣1的主要成分为SiO2、_______ (填化学式)。
(2)酸浸后所得浸出液中金属阳离子包括Mn2+,写出生成Mn2+的离子方程式_______ 。
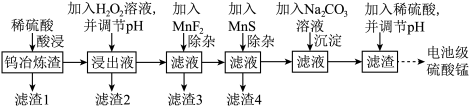
(3)若要使 和
和 沉淀完全,则需调节溶液的pH最小值为
沉淀完全,则需调节溶液的pH最小值为_______ 。
(4)滤渣3的主要成分是CaF2和_______ 。
(5)加MnS的目的是_______ 。
(6)如图为MnSO4溶解度曲线。从MnSO4溶液中提取MnSO4晶体的操作为_______ , _______ ,洗涤,干燥,碾磨,即得到了电池级硫酸锰。
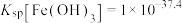 ,
,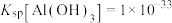 。
。(1)“酸浸”时,为提高锰的浸出率,可采取的措施是
(2)酸浸后所得浸出液中金属阳离子包括Mn2+,写出生成Mn2+的离子方程式
(3)若要使
 和
和 沉淀完全,则需调节溶液的pH最小值为
沉淀完全,则需调节溶液的pH最小值为(4)滤渣3的主要成分是CaF2和
(5)加MnS的目的是
(6)如图为MnSO4溶解度曲线。从MnSO4溶液中提取MnSO4晶体的操作为

您最近一年使用:0次
解题方法
2 .  的转化是资源利用和环境保护的重要研究课题。某实验小组在实验室模拟脱除
的转化是资源利用和环境保护的重要研究课题。某实验小组在实验室模拟脱除 并获得硫黄的装置如下(夹持装置略)。已知:
并获得硫黄的装置如下(夹持装置略)。已知: (黑色),
(黑色),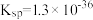
(1)装置A中发生的化学反应方程式是_______ 。
(2)加入药品前,检验装置气密性,方法是_______ 。
(3)装置B的作用是_______ 。
(4)实验Ⅲ中生成黑色沉淀的离子方程式是_______ 。
(5)对于实验Ⅱ的沉淀比实验Ⅰ少的现象,某同学通过分析并得出结论如下:
① 气体持续通入
气体持续通入 溶液中,发生
溶液中,发生 及电离
及电离_______ 。
②完善下列离子方程式:_______ 。
_______ _______
_______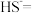 _______
_______ _______
_______ _______。
_______。
结论:实验Ⅱ的pH比实验Ⅰ的小, 增大,不利于
增大,不利于 的溶解和电离,产生沉淀较实验Ⅰ少。
的溶解和电离,产生沉淀较实验Ⅰ少。
(6)对比实验Ⅳ和Ⅰ,实验Ⅳ沉淀比实验Ⅰ多的原因是_______ 。
(7)实验Ⅰ充分反应后,测 浓度:滤出沉淀,取滤液,除去杂质,加入适量稀硫酸,用浓度为
浓度:滤出沉淀,取滤液,除去杂质,加入适量稀硫酸,用浓度为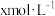 的
的 标准溶液滴定到终点。滴定时发生的离子反应:
标准溶液滴定到终点。滴定时发生的离子反应: ,计算滤液中
,计算滤液中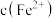 还需要的实验数据:
还需要的实验数据:___ 。
 的转化是资源利用和环境保护的重要研究课题。某实验小组在实验室模拟脱除
的转化是资源利用和环境保护的重要研究课题。某实验小组在实验室模拟脱除 并获得硫黄的装置如下(夹持装置略)。已知:
并获得硫黄的装置如下(夹持装置略)。已知: (黑色),
(黑色),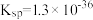
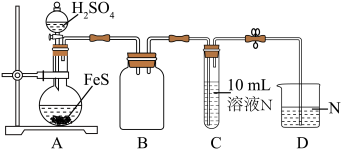
| 序号 | 溶液N | C中实验现象 |
| Ⅰ | 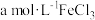 溶液( 溶液( ) ) | 溶液颜色变浅,有乳白色沉淀生成 |
| Ⅱ | 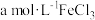 溶液(含少量稀 溶液(含少量稀 , ,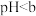 ) ) | 溶液颜色变浅,有乳白色沉淀生成,沉淀比实验Ⅰ少 |
| Ⅲ | 一定浓度的 溶液 溶液 | 溶液颜色变浅,有黑色沉淀生成 |
| Ⅳ | 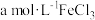 (含有一定浓度的 (含有一定浓度的 溶液, 溶液,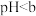 ) ) | 溶液颜色变浅,先有黑色沉淀生成,一段时间后转化为乳白色,沉淀比实验Ⅰ多 |
(1)装置A中发生的化学反应方程式是
(2)加入药品前,检验装置气密性,方法是
(3)装置B的作用是
(4)实验Ⅲ中生成黑色沉淀的离子方程式是
(5)对于实验Ⅱ的沉淀比实验Ⅰ少的现象,某同学通过分析并得出结论如下:
①
 气体持续通入
气体持续通入 溶液中,发生
溶液中,发生 及电离
及电离②完善下列离子方程式:
_______
 _______
_______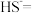 _______
_______ _______
_______ _______。
_______。结论:实验Ⅱ的pH比实验Ⅰ的小,
 增大,不利于
增大,不利于 的溶解和电离,产生沉淀较实验Ⅰ少。
的溶解和电离,产生沉淀较实验Ⅰ少。(6)对比实验Ⅳ和Ⅰ,实验Ⅳ沉淀比实验Ⅰ多的原因是
(7)实验Ⅰ充分反应后,测
 浓度:滤出沉淀,取滤液,除去杂质,加入适量稀硫酸,用浓度为
浓度:滤出沉淀,取滤液,除去杂质,加入适量稀硫酸,用浓度为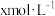 的
的 标准溶液滴定到终点。滴定时发生的离子反应:
标准溶液滴定到终点。滴定时发生的离子反应: ,计算滤液中
,计算滤液中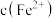 还需要的实验数据:
还需要的实验数据:
您最近一年使用:0次
名校
解题方法
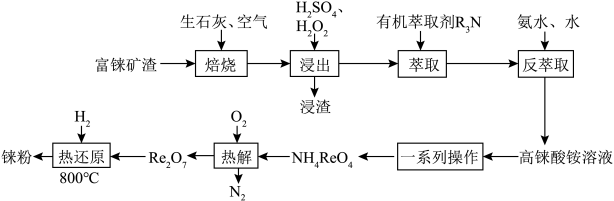
3 . 铼是一种稀有贵重金属,广泛用于制造飞机、卫星和火箭的外壳等。工业上一种利用富铼矿渣(主要成分ReS2)提取铼的工艺流程如图所示:
②Re2O7是酸性氧化物,HReO4的性质与HClO4的性质相似;高铼酸铵( )微溶于冷水,易溶于热水;
)微溶于冷水,易溶于热水;
③室温下, 。
。
回答下列问题:
(1)Re2O7与水反应的离子方程式为___________ ;室温下,加入氨水后,测得溶液pH约为11,则溶液中
___________ (填“>”“<”或“=”)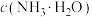 。
。
(2)“焙烧”时,空气从焙烧炉底部通入,粉碎后的矿渣从顶部加入,目的是___________ 。
(3)写出“热解”时发生反应的主要化学方程式:___________ 。
(4)测得制得的铼粉(含少量Re2O7)中Re与O的原子个数比为1∶0.35,则该产品的纯度为___________ %(保留三位有效数字)。
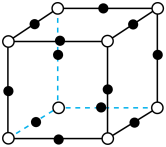
(5)已知ReO3的立方晶胞结构如图所示,则Re在晶胞中的位置为___________ ;晶体中一个Re周围与其最近的O的个数为___________ 。
②Re2O7是酸性氧化物,HReO4的性质与HClO4的性质相似;高铼酸铵(
 )微溶于冷水,易溶于热水;
)微溶于冷水,易溶于热水;③室温下,
 。
。回答下列问题:
(1)Re2O7与水反应的离子方程式为

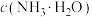 。
。(2)“焙烧”时,空气从焙烧炉底部通入,粉碎后的矿渣从顶部加入,目的是
(3)写出“热解”时发生反应的主要化学方程式:
(4)测得制得的铼粉(含少量Re2O7)中Re与O的原子个数比为1∶0.35,则该产品的纯度为
(5)已知ReO3的立方晶胞结构如图所示,则Re在晶胞中的位置为
您最近一年使用:0次
4 . 锰酸锂( )是新一代锂离子电池的正极材料,一种综合回收废弃锰酸锂电池中的有价成分的流程如图所示:
)是新一代锂离子电池的正极材料,一种综合回收废弃锰酸锂电池中的有价成分的流程如图所示:___________ ,铜元素在周期表中属于___________ 区。
②“酸浸”时加入一定量的 和
和 溶液,若将硫酸改为盐酸,有何缺点
溶液,若将硫酸改为盐酸,有何缺点___________ 。
③硫酸和双氧水用量对锰酸锂浸出率的影响如图所示,该过程合适的反应条件为___________ ,当未加入 时,浸出率较小,且产生了
时,浸出率较小,且产生了 沉淀,该反应的化学方程式为
沉淀,该反应的化学方程式为___________ 。___________ 。
(3)电解精炼过程中,粗铜中的铁、锌等元素进入到电解质溶液中,为了保证精铜的纯度,工业上必须定期给硫酸铜溶液除杂(假设主要含 、
、 、
、 ),除杂过程中需要向溶液中加入
),除杂过程中需要向溶液中加入 溶液,该操作的目的是
溶液,该操作的目的是___________ ;当 恰好沉淀完全时,溶液pH=
恰好沉淀完全时,溶液pH=___________ (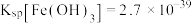 ,
,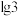 约为0.5.结果保留两位有效数字)。
约为0.5.结果保留两位有效数字)。
 )是新一代锂离子电池的正极材料,一种综合回收废弃锰酸锂电池中的有价成分的流程如图所示:
)是新一代锂离子电池的正极材料,一种综合回收废弃锰酸锂电池中的有价成分的流程如图所示:
②“酸浸”时加入一定量的
 和
和 溶液,若将硫酸改为盐酸,有何缺点
溶液,若将硫酸改为盐酸,有何缺点③硫酸和双氧水用量对锰酸锂浸出率的影响如图所示,该过程合适的反应条件为
 时,浸出率较小,且产生了
时,浸出率较小,且产生了 沉淀,该反应的化学方程式为
沉淀,该反应的化学方程式为
(3)电解精炼过程中,粗铜中的铁、锌等元素进入到电解质溶液中,为了保证精铜的纯度,工业上必须定期给硫酸铜溶液除杂(假设主要含
 、
、 、
、 ),除杂过程中需要向溶液中加入
),除杂过程中需要向溶液中加入 溶液,该操作的目的是
溶液,该操作的目的是 恰好沉淀完全时,溶液pH=
恰好沉淀完全时,溶液pH=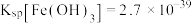 ,
,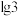 约为0.5.结果保留两位有效数字)。
约为0.5.结果保留两位有效数字)。
您最近一年使用:0次
解题方法
5 . 某小组以粗铍(含少量的 、
、 、
、 、
、 、
、 等)为原料制备、提纯
等)为原料制备、提纯  ,并测定产品中
,并测定产品中 的含量。
的含量。
Ⅰ.按如图所示装置(夹持装置略)制
已知:①乙醚沸点为34.5℃;BeCl2溶于乙醚,不溶于苯,易发生水解; 溶于乙醚和苯;
溶于乙醚和苯; 、
、 不溶于乙醚和苯。
不溶于乙醚和苯。
②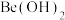 与
与  的化学性质相似。
的化学性质相似。 ,仪器
,仪器 的名称为
的名称为___________ ;装置D的作用是___________ 。
(2)C中发生的主要反应的化学方程式为___________ 。
(3)因反应放热使乙醚挥发,需控制冷凝回流速度1~2滴/秒。若发现回流速度过快,需进行的操作是___________ 。
(4)上述实验装置的缺点是___________ 。
Ⅱ. 提纯
反应后,装置 中
中 的乙醚溶液经过滤、蒸馏出乙醚得固体,用苯溶解固体,充分搅拌后过滤、洗涤、干燥得
的乙醚溶液经过滤、蒸馏出乙醚得固体,用苯溶解固体,充分搅拌后过滤、洗涤、干燥得 产品。
产品。
(5)用苯溶解固体,充分搅拌后过滤,目的是___________ 。
Ⅲ.测定产品中 的含量
的含量
取 产品溶于盐酸配成
产品溶于盐酸配成 溶液;取
溶液;取 溶液,加入
溶液,加入 掩蔽杂质离子,调节,过滤、洗涤,得
掩蔽杂质离子,调节,过滤、洗涤,得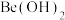 固体,加入
固体,加入 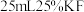 溶液溶解固体,滴加酚酞作指示剂,用
溶液溶解固体,滴加酚酞作指示剂,用 盐酸溶液滴定其中的
盐酸溶液滴定其中的 ,消耗盐酸
,消耗盐酸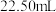 。(已知:
。(已知: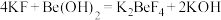 ;滴定过程中
;滴定过程中 、
、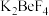 不与盐酸反应)
不与盐酸反应)
(6)调节溶液 时要控制
时要控制 不能过大,其原因为
不能过大,其原因为___________ 。
(7) 的纯度为
的纯度为___________ 。
(8)某同学认为该计算结果不可靠,理由是___________ 。
 、
、 、
、 、
、 、
、 等)为原料制备、提纯
等)为原料制备、提纯  ,并测定产品中
,并测定产品中 的含量。
的含量。Ⅰ.按如图所示装置(夹持装置略)制

已知:①乙醚沸点为34.5℃;BeCl2溶于乙醚,不溶于苯,易发生水解;
 溶于乙醚和苯;
溶于乙醚和苯; 、
、 不溶于乙醚和苯。
不溶于乙醚和苯。②
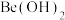 与
与  的化学性质相似。
的化学性质相似。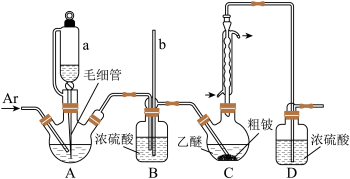
 ,仪器
,仪器 的名称为
的名称为(2)C中发生的主要反应的化学方程式为
(3)因反应放热使乙醚挥发,需控制冷凝回流速度1~2滴/秒。若发现回流速度过快,需进行的操作是
(4)上述实验装置的缺点是
Ⅱ. 提纯

反应后,装置
 中
中 的乙醚溶液经过滤、蒸馏出乙醚得固体,用苯溶解固体,充分搅拌后过滤、洗涤、干燥得
的乙醚溶液经过滤、蒸馏出乙醚得固体,用苯溶解固体,充分搅拌后过滤、洗涤、干燥得 产品。
产品。(5)用苯溶解固体,充分搅拌后过滤,目的是
Ⅲ.测定产品中
 的含量
的含量取
 产品溶于盐酸配成
产品溶于盐酸配成 溶液;取
溶液;取 溶液,加入
溶液,加入 掩蔽杂质离子,调节,过滤、洗涤,得
掩蔽杂质离子,调节,过滤、洗涤,得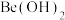 固体,加入
固体,加入 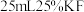 溶液溶解固体,滴加酚酞作指示剂,用
溶液溶解固体,滴加酚酞作指示剂,用 盐酸溶液滴定其中的
盐酸溶液滴定其中的 ,消耗盐酸
,消耗盐酸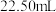 。(已知:
。(已知: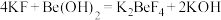 ;滴定过程中
;滴定过程中 、
、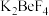 不与盐酸反应)
不与盐酸反应)(6)调节溶液
 时要控制
时要控制 不能过大,其原因为
不能过大,其原因为(7)
 的纯度为
的纯度为(8)某同学认为该计算结果不可靠,理由是
您最近一年使用:0次
名校
6 . 金属钴常见化合价有 、
、 等,对应的化合物性质也各有差异。
等,对应的化合物性质也各有差异。
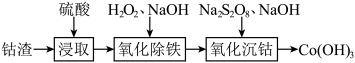
(1)利用钴渣(主要含金属钴,还含有铜、铁等金属)可富集钴,流程如下:_____________ ;“氧化除铁”的化学反应方程式为______________ ;在碱性环境下氧化性
_______  。(填“>”或“<”或“=”)。
。(填“>”或“<”或“=”)。
② 的结构如图所示,用“□”标识出
的结构如图所示,用“□”标识出 中体现强氧化性的基团:
中体现强氧化性的基团:__________ 。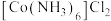 }溶液可用于脱除烟气中的NO,用活性炭作催化剂、水作还原剂可实现
}溶液可用于脱除烟气中的NO,用活性炭作催化剂、水作还原剂可实现 的再生,维持溶液脱除NO的能力,可能机理如图所示。
的再生,维持溶液脱除NO的能力,可能机理如图所示。 时带负电荷,pH越高,表面所带负电荷越多:
时带负电荷,pH越高,表面所带负电荷越多: 时带正电荷,pH越低,表面所带正电荷越多。
时带正电荷,pH越低,表面所带正电荷越多。
①由步骤(ⅱ)可知活性炭表面有大量的__________ (填“酸性”或“碱性”)基团。
②写出步骤(ⅲ)的离子反应方程式:__________ 。
③一定温度下,pH对再生反应的影响如题图所示。pH在3.5到6.5之间,反应相同时间, 的转化率随温度的升高而增大,可能的原因是
的转化率随温度的升高而增大,可能的原因是__________ 。
 、
、 等,对应的化合物性质也各有差异。
等,对应的化合物性质也各有差异。(1)利用钴渣(主要含金属钴,还含有铜、铁等金属)可富集钴,流程如下:

 。(填“>”或“<”或“=”)。
。(填“>”或“<”或“=”)。②
 的结构如图所示,用“□”标识出
的结构如图所示,用“□”标识出 中体现强氧化性的基团:
中体现强氧化性的基团:
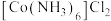 }溶液可用于脱除烟气中的NO,用活性炭作催化剂、水作还原剂可实现
}溶液可用于脱除烟气中的NO,用活性炭作催化剂、水作还原剂可实现 的再生,维持溶液脱除NO的能力,可能机理如图所示。
的再生,维持溶液脱除NO的能力,可能机理如图所示。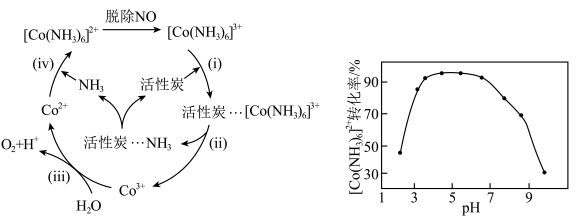
 时带负电荷,pH越高,表面所带负电荷越多:
时带负电荷,pH越高,表面所带负电荷越多: 时带正电荷,pH越低,表面所带正电荷越多。
时带正电荷,pH越低,表面所带正电荷越多。①由步骤(ⅱ)可知活性炭表面有大量的
②写出步骤(ⅲ)的离子反应方程式:
③一定温度下,pH对再生反应的影响如题图所示。pH在3.5到6.5之间,反应相同时间,
 的转化率随温度的升高而增大,可能的原因是
的转化率随温度的升高而增大,可能的原因是
您最近一年使用:0次
名校
7 . 氮化铍可用于新型的耐火陶瓷材料和反应堆材料,可由铍粉和干燥氮气在无氧气氛中于700~1400℃的温度下加热制得。以绿柱石(主要组成是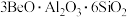 ,还含有少量铁元素)为原料生产氮化铍的工艺流程如图所示。
,还含有少量铁元素)为原料生产氮化铍的工艺流程如图所示。 如表所示。
如表所示。
回答下列问题:
(1)“酸浸”时绿柱石要进行粉碎,其目的是_______ 。
(2)“转化”时加入 的目的是
的目的是_______ (用离子方程式表示)。
(3)“调 ”时加入适量
”时加入适量 细粉除去
细粉除去 和
和 ,调节溶液
,调节溶液 的范围是
的范围是_______ ,其中沉淀 的离子方程式为
的离子方程式为_______ ,“滤渣2”的主要成分是_______ (填化学式)。
(4)“沉铍”时所加试剂 是
是_______ (填“氨水”或“ 溶液”)。
溶液”)。
(5)生成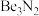 的化学方程式为
的化学方程式为_______ 。
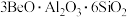 ,还含有少量铁元素)为原料生产氮化铍的工艺流程如图所示。
,还含有少量铁元素)为原料生产氮化铍的工艺流程如图所示。
 如表所示。
如表所示。| 金属离子 |  |  |  |  |  |
| 开始沉淀pH | 6.3 | 1.8 | 3.1 | 5.6 | 12.4 |
| 沉淀完全pH | 8.3 | 3.2 | 4.8 | 8.5 | 13.8 |
(1)“酸浸”时绿柱石要进行粉碎,其目的是
(2)“转化”时加入
 的目的是
的目的是(3)“调
 ”时加入适量
”时加入适量 细粉除去
细粉除去 和
和 ,调节溶液
,调节溶液 的范围是
的范围是 的离子方程式为
的离子方程式为(4)“沉铍”时所加试剂
 是
是 溶液”)。
溶液”)。(5)生成
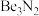 的化学方程式为
的化学方程式为
您最近一年使用:0次
2024-05-16更新
|
29次组卷
|
2卷引用:重庆市荣昌永荣中学校2024届高三下学期模拟预测化学试题2
8 . 已知:2H++2 (黄色)
(黄色) H2O+
H2O+ (橙色)。铬酸铅(PbCrO4,M=323g/mol)是一种黄色颜料,多用于油画及防锈涂料中。实验室中制备铬酸铅的步骤如下:
(橙色)。铬酸铅(PbCrO4,M=323g/mol)是一种黄色颜料,多用于油画及防锈涂料中。实验室中制备铬酸铅的步骤如下:
Ⅰ.将2.4gCr(NO3)3·9H2O(M=400g/mol)溶解,逐滴加入6mol/LNaOH溶液,至产生的沉淀变为亮绿色的NaCrO2溶液。
Ⅱ.加入15%H2O2溶液,小火加热,溶液由亮绿色变为黄色。
Ⅲ.继续煮沸溶液15min,除尽剩余的H2O2,再滴加6mol/L醋酸溶液,调溶液呈弱酸性,溶液由黄色变为橙色,再滴加8滴醋酸溶液。
Ⅳ.将溶液加热近沸,滴加足量0.5mol/LPb(NO3)2溶液,继续煮沸5min。冷却后抽滤、热水洗涤、烘干称重,得黄色沉淀1.26g。
回答下列有关问题:
(1)结合步骤Ⅰ中相关信息判断Cr(OH)3是否属于两性氢氧化物?_______ 。实验中需先配制6mol/LNaOH溶液,配制过程中的部分操作如图所示,仪器X的名称为_______ ,图中操作不规范之处为_______ 。_______ 性。
(3)步骤Ⅲ中,煮沸除尽剩余H2O2的目的是:防止在得到橙色溶液时_______ 。
(4)步骤Ⅲ在加入Pb(NO3)2溶液前需加醋酸溶液调节溶液呈酸性,其目的是_______ ,否则制得的PbCrO4不纯。从平衡角度解释不宜调节酸性过强的原因是_______ 。
(5)由步骤Ⅳ中数据计算本实验的产率为_______ %(保留一位小数)。
 (黄色)
(黄色) H2O+
H2O+ (橙色)。铬酸铅(PbCrO4,M=323g/mol)是一种黄色颜料,多用于油画及防锈涂料中。实验室中制备铬酸铅的步骤如下:
(橙色)。铬酸铅(PbCrO4,M=323g/mol)是一种黄色颜料,多用于油画及防锈涂料中。实验室中制备铬酸铅的步骤如下:Ⅰ.将2.4gCr(NO3)3·9H2O(M=400g/mol)溶解,逐滴加入6mol/LNaOH溶液,至产生的沉淀变为亮绿色的NaCrO2溶液。
Ⅱ.加入15%H2O2溶液,小火加热,溶液由亮绿色变为黄色。
Ⅲ.继续煮沸溶液15min,除尽剩余的H2O2,再滴加6mol/L醋酸溶液,调溶液呈弱酸性,溶液由黄色变为橙色,再滴加8滴醋酸溶液。
Ⅳ.将溶液加热近沸,滴加足量0.5mol/LPb(NO3)2溶液,继续煮沸5min。冷却后抽滤、热水洗涤、烘干称重,得黄色沉淀1.26g。
回答下列有关问题:
(1)结合步骤Ⅰ中相关信息判断Cr(OH)3是否属于两性氢氧化物?

(3)步骤Ⅲ中,煮沸除尽剩余H2O2的目的是:防止在得到橙色溶液时
(4)步骤Ⅲ在加入Pb(NO3)2溶液前需加醋酸溶液调节溶液呈酸性,其目的是
(5)由步骤Ⅳ中数据计算本实验的产率为
您最近一年使用:0次
名校
解题方法
9 . 纳米级 广泛用于化妆品和功能纤维领域。实验室利用普通
广泛用于化妆品和功能纤维领域。实验室利用普通 制备纳米
制备纳米 并测定其组成(夹持装置略去)。
并测定其组成(夹持装置略去)。
已知:① 可发生反应
可发生反应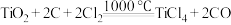 。
。
② 易挥发,沸点136.4℃,极易与水反应,与
易挥发,沸点136.4℃,极易与水反应,与 气体不反应。
气体不反应。
③ 在盐酸中的存在形式为
在盐酸中的存在形式为 ,可吸收
,可吸收 生成黑色颗粒
生成黑色颗粒 。
。
Ⅰ.制备
 时进行操作:(i)组装仪器,检验装置气密性;(ii)添加药品;(iii)
时进行操作:(i)组装仪器,检验装置气密性;(ii)添加药品;(iii)_____ ,_____ ,接通冷凝装置,开始实验。
(2)F中试剂为_______ ,发生反应的离子方程式为_______ 。
(3)该实验设计存在的缺陷是_______ 。
Ⅱ.制备
以 为载体,用
为载体,用 和水蒸气反应得到
和水蒸气反应得到 ,再控制温度生成纳米
,再控制温度生成纳米 。
。
Ⅲ.测定纳米 的组成
的组成
步骤i:取纳米 样品4.54g,用足量稀硫酸溶解得到
样品4.54g,用足量稀硫酸溶解得到 溶液,再用Al将
溶液,再用Al将 全部还原为
全部还原为 ,过滤、洗涤,将滤液和洗涤液注入500mL容量瓶,定容得到待测液。
,过滤、洗涤,将滤液和洗涤液注入500mL容量瓶,定容得到待测液。
步骤ii:取待测液25.00mL,用如图装置进行电位滴定。用 标准
标准 溶液滴定,将
溶液滴定,将 氧化为
氧化为 ,指示电极的电位随
,指示电极的电位随 浓度变化而变化,通过测量指示电极的电位变化确定滴定终点。
浓度变化而变化,通过测量指示电极的电位变化确定滴定终点。 表示指示电极的电位,
表示指示电极的电位, 表示标准溶液的体积,
表示标准溶液的体积, 表示指示电极的电位改变量,
表示指示电极的电位改变量,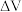 表示标准溶液体积的增量,下列所示滴定终点附近的图像正确的有
表示标准溶液体积的增量,下列所示滴定终点附近的图像正确的有_______ (填字母)。_______ (填化学式),若测定过程中加入Al不足,则导致
_______ (填“偏大”“偏小”或“无影响”)。
 广泛用于化妆品和功能纤维领域。实验室利用普通
广泛用于化妆品和功能纤维领域。实验室利用普通 制备纳米
制备纳米 并测定其组成(夹持装置略去)。
并测定其组成(夹持装置略去)。已知:①
 可发生反应
可发生反应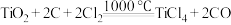 。
。②
 易挥发,沸点136.4℃,极易与水反应,与
易挥发,沸点136.4℃,极易与水反应,与 气体不反应。
气体不反应。③
 在盐酸中的存在形式为
在盐酸中的存在形式为 ,可吸收
,可吸收 生成黑色颗粒
生成黑色颗粒 。
。Ⅰ.制备


 时进行操作:(i)组装仪器,检验装置气密性;(ii)添加药品;(iii)
时进行操作:(i)组装仪器,检验装置气密性;(ii)添加药品;(iii)(2)F中试剂为
(3)该实验设计存在的缺陷是
Ⅱ.制备

以
 为载体,用
为载体,用 和水蒸气反应得到
和水蒸气反应得到 ,再控制温度生成纳米
,再控制温度生成纳米 。
。Ⅲ.测定纳米
 的组成
的组成步骤i:取纳米
 样品4.54g,用足量稀硫酸溶解得到
样品4.54g,用足量稀硫酸溶解得到 溶液,再用Al将
溶液,再用Al将 全部还原为
全部还原为 ,过滤、洗涤,将滤液和洗涤液注入500mL容量瓶,定容得到待测液。
,过滤、洗涤,将滤液和洗涤液注入500mL容量瓶,定容得到待测液。步骤ii:取待测液25.00mL,用如图装置进行电位滴定。用
 标准
标准 溶液滴定,将
溶液滴定,将 氧化为
氧化为 ,指示电极的电位随
,指示电极的电位随 浓度变化而变化,通过测量指示电极的电位变化确定滴定终点。
浓度变化而变化,通过测量指示电极的电位变化确定滴定终点。
 表示指示电极的电位,
表示指示电极的电位, 表示标准溶液的体积,
表示标准溶液的体积, 表示指示电极的电位改变量,
表示指示电极的电位改变量,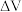 表示标准溶液体积的增量,下列所示滴定终点附近的图像正确的有
表示标准溶液体积的增量,下列所示滴定终点附近的图像正确的有

您最近一年使用:0次
2024-05-14更新
|
102次组卷
|
2卷引用:山东省滨州市2024届高三下学期二模化学试题
名校
解题方法
10 . 过硫酸铵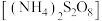 也称过二硫酸铵,常用作食品保存剂、氧化剂以及高分子聚合物的引发剂,见光易分解,易溶于水,微溶于乙醇。用30%双氧水、浓硫酸和氨气加热至
也称过二硫酸铵,常用作食品保存剂、氧化剂以及高分子聚合物的引发剂,见光易分解,易溶于水,微溶于乙醇。用30%双氧水、浓硫酸和氨气加热至 制备过硫酸铵的装置如图所示。
制备过硫酸铵的装置如图所示。
(1)每个过硫酸铵(S元素的化合价为+6价)中含有过氧键个数为___________ 。
(2)仪器的连接顺序为
___________ (用小写字母连接)。
(3)盛放浓硫酸的仪器名称为___________ 。装置A中 的作用是
的作用是___________ 。过硫酸铵保存在棕色试剂瓶中的原因是___________ 。
(4)A中制取过硫酸铵的反应的化学方程式为___________ 。充分反应后,将A中混合液经一系列操作得到晶体,然后用无水乙醇洗涤。选择用无水乙醇洗涤的目的是___________ 。
(5)过硫酸铵可用于测定锰钢中 元素的含量:取
元素的含量:取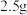 锰钢样品,加入过量浓硝酸,在加热条件下将
锰钢样品,加入过量浓硝酸,在加热条件下将 溶出形成
溶出形成 ,再用
,再用 过硫酸铵溶液恰好将溶出的
过硫酸铵溶液恰好将溶出的 全部转化为
全部转化为 ,通过检测
,通过检测 的浓度得出样品中
的浓度得出样品中 元素的质量分数为54%,则
元素的质量分数为54%,则
___________ (保留两位小数)。
(6)根据本实验可得出, 的氧化性从大到小的顺序为
的氧化性从大到小的顺序为___________ 。
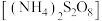 也称过二硫酸铵,常用作食品保存剂、氧化剂以及高分子聚合物的引发剂,见光易分解,易溶于水,微溶于乙醇。用30%双氧水、浓硫酸和氨气加热至
也称过二硫酸铵,常用作食品保存剂、氧化剂以及高分子聚合物的引发剂,见光易分解,易溶于水,微溶于乙醇。用30%双氧水、浓硫酸和氨气加热至 制备过硫酸铵的装置如图所示。
制备过硫酸铵的装置如图所示。
(1)每个过硫酸铵(S元素的化合价为+6价)中含有过氧键个数为
(2)仪器的连接顺序为

(3)盛放浓硫酸的仪器名称为
 的作用是
的作用是(4)A中制取过硫酸铵的反应的化学方程式为
(5)过硫酸铵可用于测定锰钢中
 元素的含量:取
元素的含量:取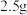 锰钢样品,加入过量浓硝酸,在加热条件下将
锰钢样品,加入过量浓硝酸,在加热条件下将 溶出形成
溶出形成 ,再用
,再用 过硫酸铵溶液恰好将溶出的
过硫酸铵溶液恰好将溶出的 全部转化为
全部转化为 ,通过检测
,通过检测 的浓度得出样品中
的浓度得出样品中 元素的质量分数为54%,则
元素的质量分数为54%,则
(6)根据本实验可得出,
 的氧化性从大到小的顺序为
的氧化性从大到小的顺序为
您最近一年使用:0次



