名校
解题方法
1 . “以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠
,得到亚硫酸钠 粗品。其流程如下:
粗品。其流程如下: 的溶解,可采取的措施是
的溶解,可采取的措施是___________ (写出一种即可)。
(2)上述流程中,加入NaOH后,发生反应的化学方程式为___________ 。
(3)亚硫酸钠粗品中含有少量 ,原因是
,原因是___________ 。
 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠
,得到亚硫酸钠 粗品。其流程如下:
粗品。其流程如下:
 的溶解,可采取的措施是
的溶解,可采取的措施是(2)上述流程中,加入NaOH后,发生反应的化学方程式为
(3)亚硫酸钠粗品中含有少量
 ,原因是
,原因是
您最近一年使用:0次
解题方法
2 . 绿水青山就是金山银山,工业废水废渣均需进行处理。皮革工业含铬污泥处理的一种工艺流程如下图。
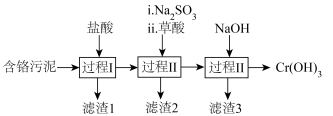
已知:草酸( )是二元弱酸。
)是二元弱酸。
(1)过程I、II、III用到的物质分离方法是___________ 。
(2)过程I的作用是从含铬污泥中浸出 、
、 等离子,为加快浸出速率,可以采取的措施是
等离子,为加快浸出速率,可以采取的措施是___________ 。(写出1种即可)
(3)过程II中,滤渣2的成分是 ,推测加入
,推测加入 的作用是
的作用是___________ 。
(4)过程III中, 转化成
转化成 沉淀的离子方程式是
沉淀的离子方程式是___________ 。

已知:草酸(
 )是二元弱酸。
)是二元弱酸。(1)过程I、II、III用到的物质分离方法是
(2)过程I的作用是从含铬污泥中浸出
 、
、 等离子,为加快浸出速率,可以采取的措施是
等离子,为加快浸出速率,可以采取的措施是(3)过程II中,滤渣2的成分是
 ,推测加入
,推测加入 的作用是
的作用是(4)过程III中,
 转化成
转化成 沉淀的离子方程式是
沉淀的离子方程式是
您最近一年使用:0次
名校
解题方法
3 . 以 粗液(含少量
粗液(含少量 、
、 )为原料制备
)为原料制备 溶液。
溶液。
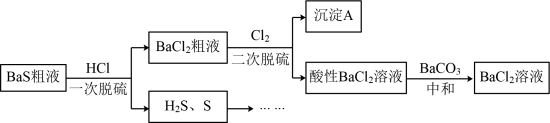
已知: 易溶于水。
易溶于水。
(1)一次脱硫
①反应体现出酸性关系:
___________  (填“
(填“ ”或“
”或“ ”)。
”)。
②产生S的离子方程式是___________ 。
(2)经一次脱硫后, 粗液依然含有少量
粗液依然含有少量 、
、 等含硫微粒,需要二次脱硫。经检验沉淀A只含一种物质。下列有关“二次脱硫”和“中和”过程的说法正确的是
等含硫微粒,需要二次脱硫。经检验沉淀A只含一种物质。下列有关“二次脱硫”和“中和”过程的说法正确的是___________ 。
a.二次脱硫所得沉淀A是 。
。
b.二次脱硫时,由于 、
、 消耗,溶液的酸性有所减弱。
消耗,溶液的酸性有所减弱。
c.中和时,过量的 可过滤除去。
可过滤除去。
(3)二次脱硫
通入 需适量,避免造成资源浪费。因此,需测量
需适量,避免造成资源浪费。因此,需测量 粗液中
粗液中 、
、 等的含量,方法如下:
等的含量,方法如下:
Ⅰ.取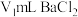 粗液,沉淀
粗液,沉淀 。过波,滤液备用;
。过波,滤液备用;
Ⅱ.取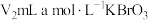 标准溶液,加过量
标准溶液,加过量 ,加
,加 酸化,溶液呈棕黄色;
酸化,溶液呈棕黄色;
Ⅲ.向Ⅱ所得溶液中加入滤液,得到黄色澄清溶液:
Ⅳ.向Ⅲ中黄色澄清溶液加入过量KI;
V.向Ⅳ所得溶液中加入几滴淀粉液,滴加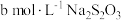 标准溶液,恰好完全反应时,消耗
标准溶液,恰好完全反应时,消耗 溶液
溶液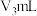 。
。
已知: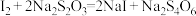 ;
; 与
与 均无色
均无色
①Ⅱ中加入 的质量
的质量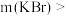
___________ g。
②Ⅲ中发生的离子反应有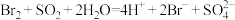 、
、___________
③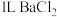 溶液二次脱硫,需通入
溶液二次脱硫,需通入
___________  。
。
 粗液(含少量
粗液(含少量 、
、 )为原料制备
)为原料制备 溶液。
溶液。
已知:
 易溶于水。
易溶于水。(1)一次脱硫
①反应体现出酸性关系:

 (填“
(填“ ”或“
”或“ ”)。
”)。②产生S的离子方程式是
(2)经一次脱硫后,
 粗液依然含有少量
粗液依然含有少量 、
、 等含硫微粒,需要二次脱硫。经检验沉淀A只含一种物质。下列有关“二次脱硫”和“中和”过程的说法正确的是
等含硫微粒,需要二次脱硫。经检验沉淀A只含一种物质。下列有关“二次脱硫”和“中和”过程的说法正确的是a.二次脱硫所得沉淀A是
 。
。b.二次脱硫时,由于
 、
、 消耗,溶液的酸性有所减弱。
消耗,溶液的酸性有所减弱。c.中和时,过量的
 可过滤除去。
可过滤除去。(3)二次脱硫
通入
 需适量,避免造成资源浪费。因此,需测量
需适量,避免造成资源浪费。因此,需测量 粗液中
粗液中 、
、 等的含量,方法如下:
等的含量,方法如下:Ⅰ.取
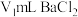 粗液,沉淀
粗液,沉淀 。过波,滤液备用;
。过波,滤液备用;Ⅱ.取
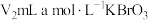 标准溶液,加过量
标准溶液,加过量 ,加
,加 酸化,溶液呈棕黄色;
酸化,溶液呈棕黄色;Ⅲ.向Ⅱ所得溶液中加入滤液,得到黄色澄清溶液:
Ⅳ.向Ⅲ中黄色澄清溶液加入过量KI;
V.向Ⅳ所得溶液中加入几滴淀粉液,滴加
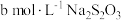 标准溶液,恰好完全反应时,消耗
标准溶液,恰好完全反应时,消耗 溶液
溶液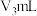 。
。已知:
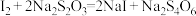 ;
; 与
与 均无色
均无色①Ⅱ中加入
 的质量
的质量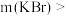
②Ⅲ中发生的离子反应有
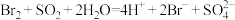 、
、③
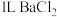 溶液二次脱硫,需通入
溶液二次脱硫,需通入
 。
。
您最近一年使用:0次
名校
4 . 硫化氢的转化是资源利用和环境保护的重要研究课题,脱除H2S有多种方法。
(1)沉淀法。
将H2S气体通入ZnSO4溶液,只产生少量白色ZnS沉淀,反应不完全。如果在ZnSO4溶液中先加入CH3COONa,再通入H2S气体,则可得大量ZnS沉淀。含CH3COONa的ZnSO4溶液吸收H2S的离子反应方程式是___________ 。
(2)沉淀氧化法。
在含H2S的废气中混入O2形成混合气体,并将混合气体通入酸性的FeCl3和CuCl2的混合溶液中。反应过程如图所示:
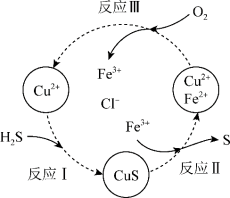
a.反应Ⅱ的离子方程式是___________ 。
b.资料1:Cu2+在反应Ⅲ中起催化作用:
i.Cu2+ + Fe2+ = Cu+ + Fe3+
ii.___________ (将反应ii补充完整)
c.在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有___________ 。
d.该过程的总反应方程式是___________ 。
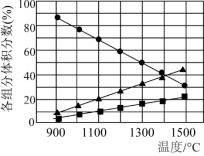
(3)H2S在高温下分解生成硫蒸汽和H2。
已知:硫蒸气为Sx(不同温度下x可能为2,4,6或8),若反应在不同温度下充分进行后,混合气体中各组分的体积分数如图所示。则H2S在此温度范围内分解的化学方程式为___________ 。
(1)沉淀法。
将H2S气体通入ZnSO4溶液,只产生少量白色ZnS沉淀,反应不完全。如果在ZnSO4溶液中先加入CH3COONa,再通入H2S气体,则可得大量ZnS沉淀。含CH3COONa的ZnSO4溶液吸收H2S的离子反应方程式是
(2)沉淀氧化法。
在含H2S的废气中混入O2形成混合气体,并将混合气体通入酸性的FeCl3和CuCl2的混合溶液中。反应过程如图所示:

a.反应Ⅱ的离子方程式是
b.资料1:Cu2+在反应Ⅲ中起催化作用:
i.Cu2+ + Fe2+ = Cu+ + Fe3+
ii.
c.在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有
d.该过程的总反应方程式是
(3)H2S在高温下分解生成硫蒸汽和H2。
已知:硫蒸气为Sx(不同温度下x可能为2,4,6或8),若反应在不同温度下充分进行后,混合气体中各组分的体积分数如图所示。则H2S在此温度范围内分解的化学方程式为

您最近一年使用:0次
名校
解题方法
5 . 《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也令人体会到化学方法在文物保护中的巨大作用。某博物馆修复出土铁器的过程如下。
(1)检测锈蚀产物
铁器在具有 、
、___________ 等环境中容易被腐蚀。
(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。
Ⅰ. 转化为
转化为 。
。
Ⅱ. 在自然环境中形成
在自然环境中形成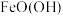 ,该物质中铁元素的化合价为
,该物质中铁元素的化合价为___________ 。
Ⅲ.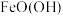 和
和 反应形成致密的
反应形成致密的 保护层,
保护层, 的作用是
的作用是___________ 。
a.氧化剂b.还原剂c.既不是氧化剂也不是还原剂
Ⅳ. 保护层被氧化为
保护层被氧化为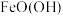 ,如此往复腐蚀。
,如此往复腐蚀。
 (将反应方程式配平)
(将反应方程式配平)___________ 。
(3)研究发现, 对铁的腐蚀会造成严重影响,化学修复;脱氧、还原,形成
对铁的腐蚀会造成严重影响,化学修复;脱氧、还原,形成 保护层,方法如下:将铁路浸没在盛有
保护层,方法如下:将铁路浸没在盛有 、
、 溶液的容器中,缓慢加热至60~90℃,一段时间,取出器物,用
溶液的容器中,缓慢加热至60~90℃,一段时间,取出器物,用 溶液洗涤至无
溶液洗涤至无 。
。
①脱氧反应: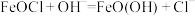 。离子反应的本质是离子浓度的减小,则:溶解度
。离子反应的本质是离子浓度的减小,则:溶解度
___________ (填>、<或=) 。
。
② 还原
还原 形成
形成 的离子方程式是
的离子方程式是___________
(1)检测锈蚀产物
| 主要成分的化学式 | |||
 | 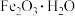 | 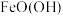 |  |
铁器在具有
 、
、(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。
Ⅰ.
 转化为
转化为 。
。Ⅱ.
 在自然环境中形成
在自然环境中形成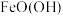 ,该物质中铁元素的化合价为
,该物质中铁元素的化合价为Ⅲ.
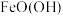 和
和 反应形成致密的
反应形成致密的 保护层,
保护层, 的作用是
的作用是a.氧化剂b.还原剂c.既不是氧化剂也不是还原剂
Ⅳ.
 保护层被氧化为
保护层被氧化为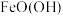 ,如此往复腐蚀。
,如此往复腐蚀。 (将反应方程式配平)
(将反应方程式配平)(3)研究发现,
 对铁的腐蚀会造成严重影响,化学修复;脱氧、还原,形成
对铁的腐蚀会造成严重影响,化学修复;脱氧、还原,形成 保护层,方法如下:将铁路浸没在盛有
保护层,方法如下:将铁路浸没在盛有 、
、 溶液的容器中,缓慢加热至60~90℃,一段时间,取出器物,用
溶液的容器中,缓慢加热至60~90℃,一段时间,取出器物,用 溶液洗涤至无
溶液洗涤至无 。
。①脱氧反应:
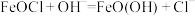 。离子反应的本质是离子浓度的减小,则:溶解度
。离子反应的本质是离子浓度的减小,则:溶解度
 。
。②
 还原
还原 形成
形成 的离子方程式是
的离子方程式是
您最近一年使用:0次
名校
解题方法
6 . 物质的大小会对其性质有极大影响。
(1)纳米金:具有高电子密度、介电特性和催化作用。纳米金的制法:将0.01%的 溶液煮沸,迅速加入1%的柠檬酸钠(
溶液煮沸,迅速加入1%的柠檬酸钠( )溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。
)溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。
资料: 的溶液呈黄色,其酸性比柠檬酸强。
的溶液呈黄色,其酸性比柠檬酸强。
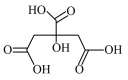
①在制备过程中,存在如下反应,已知产物 是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出
是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出 的结构简式)
的结构简式) _______ 。
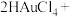 □
□ →□_______+□_______(
→□_______+□_______( )+□
)+□ +□HCl
+□HCl
②柠檬酸钠的作用是_______ ,如果一段时间后的液体仍为黄色,则可以_______ (填操作)来检验是否生成纳米金。
(2)微米水:可以高效诱导分子的还原反应,且不需要任何的外加还原剂或外加电荷。科学家使用上述方法制取纳米金时,引入了不加柠檬酸的对照组。令人惊奇的是对照组也发生了反应,他经过猜想与论证,最终将目光锁定在水身上,用如下装置(如图1所示)进行验证。

①使用丙酮酸( )来验证,通过检验由丙酮酸生成的产物
)来验证,通过检验由丙酮酸生成的产物_______ ,证明猜想成立。
②发现随着丙酮酸浓度的增加,还原效率会迅速降低,图2与图3中丙酮酸浓度均为10mol/L。

还原效率会随着雾化气体压强的增大而增大的原因是_______ 。
③为探究还原反应的具体过程,继续设计实验:向水中加入一种指示剂R,这种指示剂正常状态下不显色,R在遇到一定浓度的 与还原剂后会显示红色荧光,过程可以表示为:R(无色)
与还原剂后会显示红色荧光,过程可以表示为:R(无色) (红色荧光)。加入R后观测到的现象如图4所示。
(红色荧光)。加入R后观测到的现象如图4所示。

结合图4和上述实验,你可以得出什么推论?_______ 。
(3)综合上述内容,你对物质有了哪些更深入的认识?_______ 。
(1)纳米金:具有高电子密度、介电特性和催化作用。纳米金的制法:将0.01%的
 溶液煮沸,迅速加入1%的柠檬酸钠(
溶液煮沸,迅速加入1%的柠檬酸钠( )溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。
)溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。| 纳米金颗粒大小(nm) | 颜色 |
| 2~5 | 黄 |
| 10~20 | 红 |
| 30~80 | 紫 |
 的溶液呈黄色,其酸性比柠檬酸强。
的溶液呈黄色,其酸性比柠檬酸强。①在制备过程中,存在如下反应,已知产物
 是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出
是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出 的结构简式)
的结构简式) 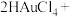 □
□ →□_______+□_______(
→□_______+□_______( )+□
)+□ +□HCl
+□HCl②柠檬酸钠的作用是
(2)微米水:可以高效诱导分子的还原反应,且不需要任何的外加还原剂或外加电荷。科学家使用上述方法制取纳米金时,引入了不加柠檬酸的对照组。令人惊奇的是对照组也发生了反应,他经过猜想与论证,最终将目光锁定在水身上,用如下装置(如图1所示)进行验证。

①使用丙酮酸(
 )来验证,通过检验由丙酮酸生成的产物
)来验证,通过检验由丙酮酸生成的产物②发现随着丙酮酸浓度的增加,还原效率会迅速降低,图2与图3中丙酮酸浓度均为10mol/L。

还原效率会随着雾化气体压强的增大而增大的原因是
③为探究还原反应的具体过程,继续设计实验:向水中加入一种指示剂R,这种指示剂正常状态下不显色,R在遇到一定浓度的
 与还原剂后会显示红色荧光,过程可以表示为:R(无色)
与还原剂后会显示红色荧光,过程可以表示为:R(无色) (红色荧光)。加入R后观测到的现象如图4所示。
(红色荧光)。加入R后观测到的现象如图4所示。
结合图4和上述实验,你可以得出什么推论?
(3)综合上述内容,你对物质有了哪些更深入的认识?
您最近一年使用:0次
2022-05-31更新
|
261次组卷
|
2卷引用:北京市东城区第五中学2022届高三三模化学试题
名校
7 . 液相催化还原法去除水体中 是一项很有前景的技术。某科研小组研究该方法中使用的固体催化剂
是一项很有前景的技术。某科研小组研究该方法中使用的固体催化剂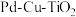 的制备和性能,结果如下。
的制备和性能,结果如下。
Ⅰ.制备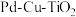 的反应过程如下图所示,光照使
的反应过程如下图所示,光照使 发生电荷分离,电子随机扩散到颗粒表面,将
发生电荷分离,电子随机扩散到颗粒表面,将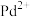 转化为
转化为 沉积到颗粒上。再用类似方法在
沉积到颗粒上。再用类似方法在 上沉积
上沉积 ,得到在
,得到在 纳米颗粒表面紧密接触的
纳米颗粒表面紧密接触的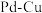 纳米簇。
纳米簇。

(1)该过程中,乙醇发生_______ (填“氧化”或“还原”)反应。
(2)结合图示说明②中 仅沉积在
仅沉积在 上的原因
上的原因_______ 。
Ⅱ.液相催化还原机理如图a所示。其他条件相同,不同 时,反应1小时后
时,反应1小时后 转化率和不同还原产物中在总的比例如图b所示。
转化率和不同还原产物中在总的比例如图b所示。

(3)液相催化还原法中所用的还原剂是_______ 。
(4)为了避免对水体的二次污染, 的理想还原产物是
的理想还原产物是_______ 。
(5)研究表明, 在
在 表面竞争吸附,会降低
表面竞争吸附,会降低 吸附
吸附 的能力,但对
的能力,但对 吸附H的能力影响不大。
吸附H的能力影响不大。
①结合还原机理和催化剂结构分析,反应中 的移动方向是
的移动方向是_______ 。
②随 减小,还原产物中
减小,还原产物中 增大,结合离子方程式解释原因:
增大,结合离子方程式解释原因:_______ 。
(6)控制溶液 可在一定时间内将
可在一定时间内将 尽可能多地转化为
尽可能多地转化为 ,具体方法是
,具体方法是_______ 。
 是一项很有前景的技术。某科研小组研究该方法中使用的固体催化剂
是一项很有前景的技术。某科研小组研究该方法中使用的固体催化剂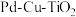 的制备和性能,结果如下。
的制备和性能,结果如下。Ⅰ.制备
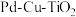 的反应过程如下图所示,光照使
的反应过程如下图所示,光照使 发生电荷分离,电子随机扩散到颗粒表面,将
发生电荷分离,电子随机扩散到颗粒表面,将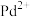 转化为
转化为 沉积到颗粒上。再用类似方法在
沉积到颗粒上。再用类似方法在 上沉积
上沉积 ,得到在
,得到在 纳米颗粒表面紧密接触的
纳米颗粒表面紧密接触的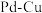 纳米簇。
纳米簇。
(1)该过程中,乙醇发生
(2)结合图示说明②中
 仅沉积在
仅沉积在 上的原因
上的原因Ⅱ.液相催化还原机理如图a所示。其他条件相同,不同
 时,反应1小时后
时,反应1小时后 转化率和不同还原产物中在总的比例如图b所示。
转化率和不同还原产物中在总的比例如图b所示。
(3)液相催化还原法中所用的还原剂是
(4)为了避免对水体的二次污染,
 的理想还原产物是
的理想还原产物是(5)研究表明,
 在
在 表面竞争吸附,会降低
表面竞争吸附,会降低 吸附
吸附 的能力,但对
的能力,但对 吸附H的能力影响不大。
吸附H的能力影响不大。①结合还原机理和催化剂结构分析,反应中
 的移动方向是
的移动方向是②随
 减小,还原产物中
减小,还原产物中 增大,结合离子方程式解释原因:
增大,结合离子方程式解释原因:(6)控制溶液
 可在一定时间内将
可在一定时间内将 尽可能多地转化为
尽可能多地转化为 ,具体方法是
,具体方法是
您最近一年使用:0次
2022-03-20更新
|
407次组卷
|
3卷引用:北京市第二中学2021-2022学年高三12月月考化学试题
解题方法
8 . 某小组同学欲探究H2O2的性质,过程如下:
【预测】
聚焦H2O2中的O作为核心元素,因此预测H2O2既具有氧化性,也具有还原性。
【实验和观察】
小组同学分别选用酸性KMnO4溶液、酸性KI溶液与5% H2O2溶液反应以验证预测。
实验①
实验②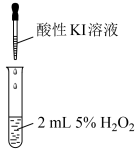
(1)实验①利用了酸性高锰酸钾的___________ (填“氧化性”或“还原性”),该实验中,证明酸性KMnO4溶液与H2O2溶液反应的现象除了溶液颜色变浅或褪色外,还有___________ 。
(2)实验②是为了验证H2O2的___________ (填“氧化性”或“还原性”),在反应后的溶液中加入淀粉溶液,可观察到溶液变蓝,写出该反应的离子方程式:___________ 。
【解释和结论】
(3)以上实验可得出的结论是___________ 。
【预测】
聚焦H2O2中的O作为核心元素,因此预测H2O2既具有氧化性,也具有还原性。
【实验和观察】
小组同学分别选用酸性KMnO4溶液、酸性KI溶液与5% H2O2溶液反应以验证预测。
实验①

实验②

(1)实验①利用了酸性高锰酸钾的
(2)实验②是为了验证H2O2的
【解释和结论】
(3)以上实验可得出的结论是
您最近一年使用:0次
2021-11-08更新
|
181次组卷
|
2卷引用:北京市怀柔区2021-2022学年高一下学期期末化学试题
名校
解题方法
9 . 为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某小组同学进行实验如下:已知: (橙色)+ H2O⇌
(橙色)+ H2O⇌ (黄色)+ 2H+
(黄色)+ 2H+
(1)配制溶液
①用化学用语表示饱和Na2SO3溶液pH约为9的原因:__ 。
(2)进行实验iii和iv:
②用离子方程式解释iii中现象:__ 。
(3)继续进行实验v:
③实验vi的目的是__ 。
④用化学平衡移动原理解释v中现象:__ 。
⑤根据实验iii~v,可推测:Na2SO3溶液和铬(VI)盐溶液的反应与溶液酸碱性有关,__ 。
⑥向实验v所得黄色溶液中滴加__ ,产生的现象证实了上述推测。
(4)继续探究溶液酸性增强对铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。

a.K闭合时,电压为a。
b.向U形管左侧溶液中滴加3滴浓硫酸后,电压增大了b。
⑦上述实验说明:__ 。
⑧有同学认为:随溶液酸性增强,溶液中O2的氧化性增强也会使电压增大。利用如图装置选择合适试剂进行实验,结果表明O2的存在不影响上述结论。该实验方案是__ ,测得电压增大了d(d < b)。
 (橙色)+ H2O⇌
(橙色)+ H2O⇌ (黄色)+ 2H+
(黄色)+ 2H+(1)配制溶液
| 序号 | 操作 | 现象 |
| i | 配制饱和Na2SO3溶液,测溶液的pH | pH约为9 |
| ii | 配制0.05 mol·L−1的K2Cr2O7溶液,把溶液平均分成两份,向两份溶液中分别滴加浓硫酸和浓KOH溶液,得到pH=2的溶液A和pH=8的溶液B | pH=2的溶液A呈橙色;pH=8的溶液B呈黄色 |
①用化学用语表示饱和Na2SO3溶液pH约为9的原因:
(2)进行实验iii和iv:
| 序号 | 操作 | 现象 |
| iii | 向2 mL溶液A中滴加3滴饱和Na2SO3溶液 | 溶液变绿色(含Cr3+) |
| iv | 向2 mL溶液B中滴加3滴饱和Na2SO3溶液 | 溶液没有明显变化 |
②用离子方程式解释iii中现象:
(3)继续进行实验v:
| 序号 | 操作 | 现象 |
| v | 向2 mL饱和Na2SO3溶液中滴加3滴溶液A | 溶液变黄色 |
| vi | 向2 mL蒸馏水中滴加3滴溶液A | 溶液变浅橙色 |
③实验vi的目的是
④用化学平衡移动原理解释v中现象:
⑤根据实验iii~v,可推测:Na2SO3溶液和铬(VI)盐溶液的反应与溶液酸碱性有关,
⑥向实验v所得黄色溶液中滴加
(4)继续探究溶液酸性增强对铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。

a.K闭合时,电压为a。
b.向U形管左侧溶液中滴加3滴浓硫酸后,电压增大了b。
⑦上述实验说明:
⑧有同学认为:随溶液酸性增强,溶液中O2的氧化性增强也会使电压增大。利用如图装置选择合适试剂进行实验,结果表明O2的存在不影响上述结论。该实验方案是
您最近一年使用:0次
10 . 某小组同学探究Cu和H2O2的反应。
【猜想预测】
猜想1:Cu与H2O2不发生反应;
猜想2:Cu与H2O2可能发生氧化还原反应,H2O2作氧化剂。
【实验探究】
实验ⅰ:向装有0.5 g Cu的烧杯中加入20 mL 30% H2O2溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)通过该实验证明了猜想2成立,写出该反应的化学方程式:________ 。
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:Cu2++ 4NH3⇌[ Cu(NH3)4]2+,[ Cu(NH3)4]2+为深蓝色;Cu(OH)2可溶于氨水形成深蓝色溶液。
(2)实验ⅱ中:溶液变蓝的原因是________ (用化学用语解释);经检验产生的气体为氧气,产生氧气的原因是________ 。
(3)对比实验ⅰ和ⅲ,为探究氨水对Cu的还原性或H2O2氧化性的影响,该同学利用如图装置继续实验。
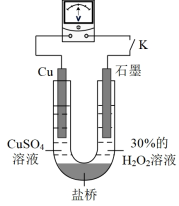
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U形管右侧溶液中滴加氨水后,电压不变。
c.继续向U形管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论:_________ 。利用该方法也可证明酸性增强可提高H2O2的氧化性,导致Cu溶解速率加快。
(4)对比实验ⅱ和ⅲ,实验ⅲ中产生氧气速率明显更快,可能的原因是_______ 。
(5)实验ⅲ有少量蓝色不溶物,小组同学加入少量NH4Cl可使其溶解,结合文字和化学用语解释不溶物溶解的原因:________ 。
(6)基于以上实验,影响Cu与H2O2反应速率的因素有________ 。
【猜想预测】
猜想1:Cu与H2O2不发生反应;
猜想2:Cu与H2O2可能发生氧化还原反应,H2O2作氧化剂。
【实验探究】
实验ⅰ:向装有0.5 g Cu的烧杯中加入20 mL 30% H2O2溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)通过该实验证明了猜想2成立,写出该反应的化学方程式:
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:Cu2++ 4NH3⇌[ Cu(NH3)4]2+,[ Cu(NH3)4]2+为深蓝色;Cu(OH)2可溶于氨水形成深蓝色溶液。
| 装置 | 序号 | 试剂a | 现象 |
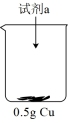 | ⅱ | 20 mL 30% H2O2与4 mL 5 mol/L H2SO4混合液 | Cu表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 |
| ⅲ | 20 mL 30% H2O2与4 mL5 mol/L氨水混合液 | 溶液立即变为深蓝色,产生大量气泡,Cu表面有少量蓝色不溶物 |
(2)实验ⅱ中:溶液变蓝的原因是
(3)对比实验ⅰ和ⅲ,为探究氨水对Cu的还原性或H2O2氧化性的影响,该同学利用如图装置继续实验。

已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U形管右侧溶液中滴加氨水后,电压不变。
c.继续向U形管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论:
(4)对比实验ⅱ和ⅲ,实验ⅲ中产生氧气速率明显更快,可能的原因是
(5)实验ⅲ有少量蓝色不溶物,小组同学加入少量NH4Cl可使其溶解,结合文字和化学用语解释不溶物溶解的原因:
(6)基于以上实验,影响Cu与H2O2反应速率的因素有
您最近一年使用:0次
2020-06-06更新
|
339次组卷
|
3卷引用:北京市丰台区2020届高三下学期高三综合练习(二)化学试题



