1 . 在处理NO废气的过程中,催化剂 会逐渐失活变为
会逐渐失活变为 。
。
某小组为解决这一问题,实验研究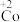 和
和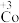 之间的相互转化。
之间的相互转化。
资料:i.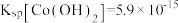 ;
;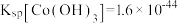 。
。
ii.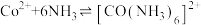
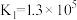 ;
;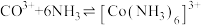
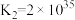 。
。
iii. 和
和 在酸性条件下均能生成
在酸性条件下均能生成 。
。
(1)探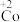 的还原性
的还原性
实验I 粉红色的 溶液或
溶液或 溶液在空气中久置,无明显变化。
溶液在空气中久置,无明显变化。
实验Ⅱ 向 溶液中滴入2滴酸性
溶液中滴入2滴酸性 溶液,无明显变化。
溶液,无明显变化。
实验Ⅲ 按如图装置进行实验,观察到电压表指针偏转。 可以被酸性
可以被酸性 溶液氧化。乙同学补充实验IV,
溶液氧化。乙同学补充实验IV,_______ (补全实验操作及现象),否定了该观点。
②探究碱性条件下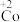 的还原性,进行实验。
的还原性,进行实验。_______ 。
③根据氧化还原反应规律解释还原性 :
: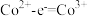 在碱性条件下,
在碱性条件下, 与
与 、
、 反应,使
反应,使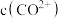 和
和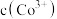 均降低,但
均降低,但_______ 降低的程度更大,还原剂的还原性增强。
(2)探究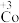 的氧化性
的氧化性
①根据实验Ⅲ和IV推测氧化性: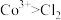 ,设计实验证明:向V中得到的棕褐色沉淀中,
,设计实验证明:向V中得到的棕褐色沉淀中,_______ (补全实验操作及现象),反应方程式为_______ 。
②向V中得到的棕褐色沉淀中,滴加 溶液,加入催化剂,产生无色气泡,该气体是
溶液,加入催化剂,产生无色气泡,该气体是_______ 。
(3)催化剂 的失活与再生
的失活与再生
①结合数据解释 能被氧化为
能被氧化为 而失活的原因:
而失活的原因:_______ 。
②根据以上实验,设计物质转化流程图 实现 的再生:
的再生:_______ 。示例:
 会逐渐失活变为
会逐渐失活变为 。
。某小组为解决这一问题,实验研究
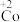 和
和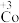 之间的相互转化。
之间的相互转化。资料:i.
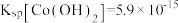 ;
;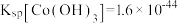 。
。ii.
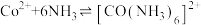
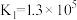 ;
;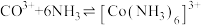
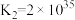 。
。iii.
 和
和 在酸性条件下均能生成
在酸性条件下均能生成 。
。(1)探
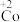 的还原性
的还原性实验I 粉红色的
 溶液或
溶液或 溶液在空气中久置,无明显变化。
溶液在空气中久置,无明显变化。实验Ⅱ 向
 溶液中滴入2滴酸性
溶液中滴入2滴酸性 溶液,无明显变化。
溶液,无明显变化。实验Ⅲ 按如图装置进行实验,观察到电压表指针偏转。
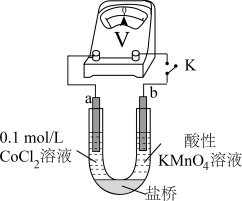
 可以被酸性
可以被酸性 溶液氧化。乙同学补充实验IV,
溶液氧化。乙同学补充实验IV,②探究碱性条件下
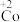 的还原性,进行实验。
的还原性,进行实验。实验V: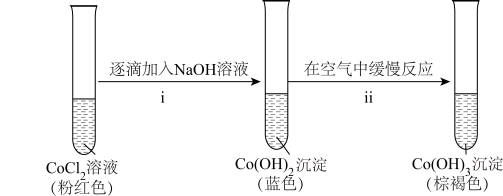
③根据氧化还原反应规律解释还原性
 :
: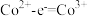 在碱性条件下,
在碱性条件下, 与
与 、
、 反应,使
反应,使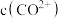 和
和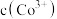 均降低,但
均降低,但(2)探究
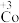 的氧化性
的氧化性①根据实验Ⅲ和IV推测氧化性:
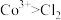 ,设计实验证明:向V中得到的棕褐色沉淀中,
,设计实验证明:向V中得到的棕褐色沉淀中,②向V中得到的棕褐色沉淀中,滴加
 溶液,加入催化剂,产生无色气泡,该气体是
溶液,加入催化剂,产生无色气泡,该气体是(3)催化剂
 的失活与再生
的失活与再生①结合数据解释
 能被氧化为
能被氧化为 而失活的原因:
而失活的原因:②根据以上实验,设计物质转化
 的再生:
的再生:
您最近一年使用:0次
解题方法
2 . 下列过程与氧化还原反应有关的是
A.用 去除废水中的 去除废水中的 | B.用 净水 净水 |
C.用 对自来水消毒 对自来水消毒 | D.由海水制取蒸馏水 |
您最近一年使用:0次
3 . 稍过量零价铁与亚硫酸钠体系能有效降解废水中有机污染物活性红。
已知:
ⅰ.体系中产生的 、
、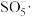 和
和 可将活性红氧化,其中
可将活性红氧化,其中 具有强氧化性
具有强氧化性
ⅱ.

ⅲ. 开始沉淀时pH=6.3,完全沉淀时pH=8.3
开始沉淀时pH=6.3,完全沉淀时pH=8.3
 开始沉淀时pH=1.5,完全沉淀时pH=2.8
开始沉淀时pH=1.5,完全沉淀时pH=2.8 体系中各含硫粒子的物质的量分数与pH的关系
体系中各含硫粒子的物质的量分数与pH的关系
下列说法不正确 的是
已知:
ⅰ.体系中产生的
 、
、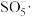 和
和 可将活性红氧化,其中
可将活性红氧化,其中 具有强氧化性
具有强氧化性ⅱ.


ⅲ.
 开始沉淀时pH=6.3,完全沉淀时pH=8.3
开始沉淀时pH=6.3,完全沉淀时pH=8.3 开始沉淀时pH=1.5,完全沉淀时pH=2.8
开始沉淀时pH=1.5,完全沉淀时pH=2.8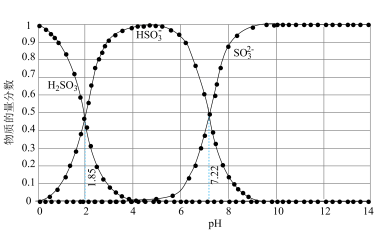
 体系中各含硫粒子的物质的量分数与pH的关系
体系中各含硫粒子的物质的量分数与pH的关系 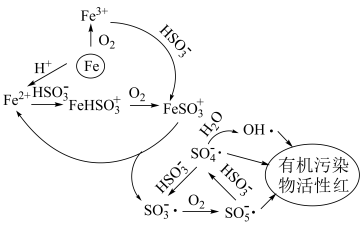
下列说法
A.由图1,25℃时 的 的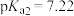 |
| B.pH=4时较pH=8时具有更好的降解效果 |
C.反应一段时间后零价铁表面产生 ,投入 ,投入 可消除 可消除 |
| D.用等物质的量的硫酸亚铁代替零价铁可提高有机物的降解率 |
您最近一年使用:0次
4 . 某小组同学探究硫代硫酸钠(Na2S2O3)溶液与某些常见金属离子的反应。
已知:i.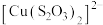 (淡绿色)、
(淡绿色)、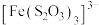 (紫黑色)、
(紫黑色)、 (无色)
(无色)
ii. 在酸性溶液中转化为
在酸性溶液中转化为 、S和SO2。
、S和SO2。
iii.BaS4O6可溶于水、BaS2O3微溶于水。
(1)将S粉加入沸腾的Na2SO3溶液中可制得Na2S2O3,离子方程式是___________ 。
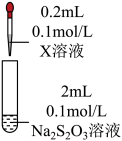
(2)研究 Na2S2O3与某些常见金属离子的反应,进行如下实验。
①取I中的浊液,离心分离,经检验,沉淀是Cu2S和S的混合物,清液中存在 。
。
i.补全I中生成黑色沉淀的总反应的离子方程式:___________
 □___________
□___________ □___________
□___________ □___________
□___________ □___________+
□___________+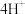
ii.查阅资料可知,常温时,生成黑色沉淀反应的平衡常数很大,但仍需水浴加热至50℃以上才出现沉淀,原因是___________ 。
②Ⅱ中, 被Fe3+氧化的主要产物是
被Fe3+氧化的主要产物是 ,还有很少量的
,还有很少量的 。取Ⅱ中的无色溶液进行如下实验证实了此结论。
。取Ⅱ中的无色溶液进行如下实验证实了此结论。
i.仅由溶液1中加入足量的盐酸后得到沉淀2,不能说明Ⅱ中生成了 ,理由是
,理由是___________ 。
ii.补全实验方案证实上述结论:将沉淀1洗净,___________ 。
③向Ⅲ的无色溶液中继续加入0.5mL 0.1mol·L-1AgNO3溶液,产生白色沉淀Ag2S2O3。静置,得到黑色沉淀Ag2S,同时生成强酸。生成Ag2S的化学方程式是___________ 。
(3)软硬酸碱原理认为,Ⅲ中, Ag+为软酸, 为软碱, S2-是比
为软碱, S2-是比 更软的碱,可解释
更软的碱,可解释 与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,___________ 是更软的酸。
已知:i.
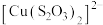 (淡绿色)、
(淡绿色)、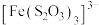 (紫黑色)、
(紫黑色)、 (无色)
(无色)ii.
 在酸性溶液中转化为
在酸性溶液中转化为 、S和SO2。
、S和SO2。iii.BaS4O6可溶于水、BaS2O3微溶于水。
(1)将S粉加入沸腾的Na2SO3溶液中可制得Na2S2O3,离子方程式是
(2)研究 Na2S2O3与某些常见金属离子的反应,进行如下实验。
| 序号 | X溶液 | 现象 |
| I | CuCl2溶液 | 溶液变为淡绿色,水浴加热至50℃以上,逐渐析出黑色沉淀 | |
| Ⅱ | FeCl3溶液 | 溶液变为紫黑色,片刻后溶液变为无色 | |
| Ⅲ | AgNO3溶液 | 逐滴加入AgNO3溶液,生成白色沉淀,振荡后沉淀溶解,得无色溶液 |
 。
。i.补全I中生成黑色沉淀的总反应的离子方程式:
 □___________
□___________ □___________
□___________ □___________
□___________ □___________+
□___________+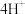
ii.查阅资料可知,常温时,生成黑色沉淀反应的平衡常数很大,但仍需水浴加热至50℃以上才出现沉淀,原因是
②Ⅱ中,
 被Fe3+氧化的主要产物是
被Fe3+氧化的主要产物是 ,还有很少量的
,还有很少量的 。取Ⅱ中的无色溶液进行如下实验证实了此结论。
。取Ⅱ中的无色溶液进行如下实验证实了此结论。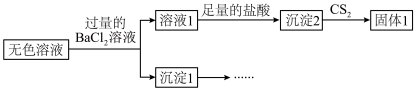
i.仅由溶液1中加入足量的盐酸后得到沉淀2,不能说明Ⅱ中生成了
 ,理由是
,理由是ii.补全实验方案证实上述结论:将沉淀1洗净,
③向Ⅲ的无色溶液中继续加入0.5mL 0.1mol·L-1AgNO3溶液,产生白色沉淀Ag2S2O3。静置,得到黑色沉淀Ag2S,同时生成强酸。生成Ag2S的化学方程式是
(3)软硬酸碱原理认为,Ⅲ中, Ag+为软酸,
 为软碱, S2-是比
为软碱, S2-是比 更软的碱,可解释
更软的碱,可解释 与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
您最近一年使用:0次
5 . 研究 溶液的制备、性质和应用。
溶液的制备、性质和应用。
①向 溶液中逐滴加入氨水,得到
溶液中逐滴加入氨水,得到 溶液。
溶液。
②分别将等浓度的 溶液、
溶液、 溶液放置于空气中,一段时间后,加入浓盐酸,前者无明显现象,后者产生使淀粉
溶液放置于空气中,一段时间后,加入浓盐酸,前者无明显现象,后者产生使淀粉 溶液变蓝的气体。
溶液变蓝的气体。
③ 溶液可处理含
溶液可处理含 的废气,反应过程如下。
的废气,反应过程如下。
 溶液的制备、性质和应用。
溶液的制备、性质和应用。①向
 溶液中逐滴加入氨水,得到
溶液中逐滴加入氨水,得到 溶液。
溶液。②分别将等浓度的
 溶液、
溶液、 溶液放置于空气中,一段时间后,加入浓盐酸,前者无明显现象,后者产生使淀粉
溶液放置于空气中,一段时间后,加入浓盐酸,前者无明显现象,后者产生使淀粉 溶液变蓝的气体。
溶液变蓝的气体。③
 溶液可处理含
溶液可处理含 的废气,反应过程如下。
的废气,反应过程如下。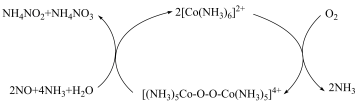
A.①中,为避免 溶液与氨水生成 溶液与氨水生成 沉淀,可先加入适量的 沉淀,可先加入适量的 溶液 溶液 |
B.②中, 溶液中的 溶液中的 浓度比 浓度比 溶液中的高, 溶液中的高, 的还原性比 的还原性比 的强 的强 |
C.③中, 转化为 转化为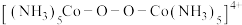 , , 元素的化合价不变 元素的化合价不变 |
D.③中,降低 可显著提高 可显著提高 的脱除率 的脱除率 |
您最近一年使用:0次
名校
6 . 实验小组探究溶液酸碱性对锰化合物和Na2S2O3氧化还原反应的影响。
资料:i. MnO 呈绿色,MnO2为棕黑色沉淀,Mn2+几乎无色。
呈绿色,MnO2为棕黑色沉淀,Mn2+几乎无色。
ii. MnO 在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为MnO
在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为MnO 和MnO2。
和MnO2。
iii. BaS2O3为微溶物。
(1)用离子方程式解释实验I中出现乳白色浑浊的原因___________ 。
(2)已知,实验I、Ⅱ、Ⅲ中S2O 均被氧化为SO
均被氧化为SO 。针对实验I、Ⅱ、Ⅲ进行分析:
。针对实验I、Ⅱ、Ⅲ进行分析:
① 能得出“pH对KMnO4还原产物有影响”的证据是___________ 。
② 实验Ⅱ所得溶液中SO 的检验方法为
的检验方法为___________ 。
(3)针对实验Ⅲ、Ⅳ进行分析:
① 实验Ⅲ中“溶液变为绿色”相应反应的离子方程式为___________ 。
② 实验Ⅳ中“静置5 min,有棕黑色沉淀生成”的可能原因(写出2点):___________
(4)针对实验Ⅲ、Ⅳ继续探究:
① 实验V:向实验Ⅲ的试管中继续滴加足量H2SO4,振荡,溶液立即变为紫红色,产生棕黑色沉淀。
② 实验Ⅵ:向实验Ⅳ的试管中继续滴加足量H2SO4,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失。静置一段时间后,出现乳白色浑浊。
对比实验V、Ⅵ,结合方程式分析实验VI滴加H2SO4后溶液未见紫红色的可能原因___________ 。
(5)综合上述实验,在下图中用连线的方式补充完善实验I~Ⅵ已证实的锰化合物转化关系___________ 。
资料:i. MnO
 呈绿色,MnO2为棕黑色沉淀,Mn2+几乎无色。
呈绿色,MnO2为棕黑色沉淀,Mn2+几乎无色。ii. MnO
 在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为MnO
在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为MnO 和MnO2。
和MnO2。iii. BaS2O3为微溶物。
| 实验 | 序号 | 试剂 | 现象 |
|
| I | a:10滴3 mol·L−1 H2SO4 溶液 b:20滴 0.002mol·L−1 Na2S2O3溶液 | 溶液紫色变浅至接近无色,静置一段时间后出现乳白色浑浊。 |
| Ⅱ | a:10滴蒸馏水 b:20滴 0.002mol·L−1 Na2S2O3溶液 | 紫色溶液逐渐褪色,产生棕黑色沉淀。 | |
| Ⅲ | a:10滴6 mol·L−1 NaOH 溶液 b:2滴0.002mol·L−1 Na2S2O3溶液和18滴蒸馏水 | 溶液变为绿色,无沉淀生成;静置5 min,未见明显变化。 | |
| Ⅳ | a:10滴6mol·L−1 NaOH 溶液 b:20滴 0.002mol·L−1 Na2S2O3溶液 | 溶液变为绿色,无沉淀生成;静置5 min,绿色变浅,有棕黑色沉淀生成。 |
(1)用离子方程式解释实验I中出现乳白色浑浊的原因
(2)已知,实验I、Ⅱ、Ⅲ中S2O
 均被氧化为SO
均被氧化为SO 。针对实验I、Ⅱ、Ⅲ进行分析:
。针对实验I、Ⅱ、Ⅲ进行分析:① 能得出“pH对KMnO4还原产物有影响”的证据是
② 实验Ⅱ所得溶液中SO
 的检验方法为
的检验方法为(3)针对实验Ⅲ、Ⅳ进行分析:
① 实验Ⅲ中“溶液变为绿色”相应反应的离子方程式为
② 实验Ⅳ中“静置5 min,有棕黑色沉淀生成”的可能原因(写出2点):
(4)针对实验Ⅲ、Ⅳ继续探究:
① 实验V:向实验Ⅲ的试管中继续滴加足量H2SO4,振荡,溶液立即变为紫红色,产生棕黑色沉淀。
② 实验Ⅵ:向实验Ⅳ的试管中继续滴加足量H2SO4,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失。静置一段时间后,出现乳白色浑浊。
对比实验V、Ⅵ,结合方程式分析实验VI滴加H2SO4后溶液未见紫红色的可能原因
(5)综合上述实验,在下图中用连线的方式补充完善实验I~Ⅵ已证实的锰化合物转化关系

您最近一年使用:0次
7 . 某实验小组探究KMnO4溶液与NH3以及铵盐溶液的反应。
已知: 的氧化性随溶液酸性增强而增强;MnO2为棕黑色,Mn2+接近无色。
的氧化性随溶液酸性增强而增强;MnO2为棕黑色,Mn2+接近无色。
下列说法不正确 的是
已知:
 的氧化性随溶液酸性增强而增强;MnO2为棕黑色,Mn2+接近无色。
的氧化性随溶液酸性增强而增强;MnO2为棕黑色,Mn2+接近无色。| 实验 | 序号 | 试剂a | 实验现象 |
| Ⅰ | 8mol·L-1氨水(pH≈13) | 紫色变浅,底部有棕黑色沉淀 |
| Ⅱ | 0.1mol·L-1NaOH溶液 | 无明显变化 | |
| Ⅲ | 4mol·L-1(NH4)2SO4溶液(pH≈6) | 紫色略变浅,底部有少量棕黑色沉淀 | |
| Ⅳ | 硫酸酸化的4mol·L-1(NH4)2SO4溶液(pH≈1) | 紫色变浅 | |
| Ⅴ | 硫酸酸化的4mol·L-1NH4Cl溶液(pH≈1) | 紫色褪去 |
A.由Ⅱ可知,pH=13时,OH-不能还原 |
B.由Ⅰ、Ⅱ、Ⅲ可知,与 相比,NH3更易还原 相比,NH3更易还原 |
C.由Ⅲ、Ⅳ可探究溶液pH对 与 与 反应的影响 反应的影响 |
D.由Ⅳ、Ⅴ可知, 浓度降低,其还原性增强 浓度降低,其还原性增强 |
您最近一年使用:0次
2024-04-13更新
|
367次组卷
|
3卷引用:2023-2024学年海淀区第二学期期中考试高三化学试卷
名校
解题方法
8 . 下列反应的离子方程式书写正确的是
A. 溶液与醋酸溶液反应: 溶液与醋酸溶液反应: |
B. 溶液与 溶液与 溶液反应: 溶液反应: |
C.电解饱和食盐水: |
D.向 溶液中通入过量的 溶液中通入过量的 : : |
您最近一年使用:0次
2024-04-10更新
|
1182次组卷
|
5卷引用:北京市西城区2024届高三统一测试(一模)化学试题
北京市西城区2024届高三统一测试(一模)化学试题(已下线)化学(北京卷03)-2024年高考押题预测卷(已下线)题型4 离子反应 氧化还原反应(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)压轴题01?离子方程式与离子共存的判断(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)湖南省雅礼教育集团2023-2024学年高二下学期期中考试化学试题
名校
解题方法
9 . 溴及其化合物广泛应用于医药、农药和阻燃剂等生产中。一种利用空气吹出法从海水中提取溴的工艺流程如下。
浓缩海水 酸化海水
酸化海水 含溴空气
含溴空气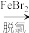
 含溴溶液
含溴溶液 产品溴
产品溴
已知:i.与Na2CO3反应时,Br2转化为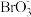 和Br-。
和Br-。
ii.HBrO3为强酸。
下列说法不正确的是
浓缩海水
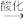 酸化海水
酸化海水 含溴空气
含溴空气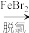
 含溴溶液
含溴溶液 产品溴
产品溴已知:i.与Na2CO3反应时,Br2转化为
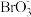 和Br-。
和Br-。ii.HBrO3为强酸。
下列说法不正确的是
| A.酸化海水通入Cl2提取溴的反应:Cl2+2Br-=2Cl-+Br2 |
B.脱氯过程脱除1molCl2可能消耗 molFeBr2 molFeBr2 |
C.用Na2CO3溶液吸收足量Br2蒸气后,所得产物中的含碳粒子主要是 |
| D.H2SO4酸化后重新得到Br2的反应中氧化剂和还原剂的物质的量比为1:5 |
您最近一年使用:0次
名校
10 . 某兴趣小组探究高锰酸钾和氨水的反应,实验如下:
注:实验中c(KMnO4) = 0.01 mol·L-1。
下列说法不正确 的是
| 序号 | 试剂 | 实验现象 |
| ① | 2 mL KMnO4溶液 + 1 mL 10 mol·L-1氨水+0.5 mL蒸馏水 | 溶液完全褪色所需时间:③<②<①。实验均产生棕褐色固体(经检验为MnO2),都伴有少量气泡产生(经检验为N2)。 |
| ② | 2 mL KMnO4溶液 + 1 mL 10 mol·L-1氨水 + 0.5 mL 1 mol·L-1稀硫酸 | |
| ③ | 2 mL KMnO4溶液 + 1 mL 10 mol·L-1氨水 + 0.5 mL 1 mol·L-1 Na2SO4溶液 | |
| ④ | 2 mL KMnO4溶液 + 1 mL 5 mol·L-1 (NH4)2SO4溶液 + 0.5 mL蒸馏水 | 无明显变化 |
下列说法
A.实验①中发生了反应2 MnO + 2NH3 = 2MnO2 + N2↑ + 2OH- + 2H2O + 2NH3 = 2MnO2 + N2↑ + 2OH- + 2H2O |
B.溶液完全褪色所需时间② < ①的主要原因:c(H+)增大,MnO 的氧化性增强 的氧化性增强 |
C.对比实验③④可得出,还原性:NH3 > NH |
| D.在实验④的试剂中,逐滴加入浓NaOH溶液,可观察到溶液褪色 |
您最近一年使用:0次
2024-04-01更新
|
636次组卷
|
5卷引用:北京市丰台区2023-2024学年高三下学期综合练习(一)化学试题
北京市丰台区2023-2024学年高三下学期综合练习(一)化学试题(已下线)通关练03 常考化学实验基础知识-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)北京市北京师范大学燕化附属中学2023-2024学年高一下学期期中考试化学试卷 江西省宜春市宜丰中学2023-2024学年高一下学期4月期中考试化学试题山东省潍坊一中2023-2024学年高一下学期期中模拟检测化学试题