10-11高一上·安徽蚌埠·期中
1 . 下列物质中既有氧化性又有还原性的是
| A.HClO | B.Na | C.SiO2 | D.N2O5 |
您最近一年使用:0次
真题
2 . 某反应中反应物与生成物有:AsH3、H2SO4、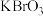 、H3AsO4、H2O和一种未知物质X。
、H3AsO4、H2O和一种未知物质X。
(1)已知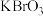 在反应中得到电子,则该反应的还原剂是
在反应中得到电子,则该反应的还原剂是______________ 。
(2)已知0.2mol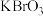 在反应中得到1mol电子生成X,则X的化学式为
在反应中得到1mol电子生成X,则X的化学式为_____________ 。
(3)根据上述反应可推知_________ 。
a.氧化性: b.氧化性:
b.氧化性:
c.还原性: d.还原性:
d.还原性:
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方
向和数目:
___________ 。
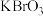 、H3AsO4、H2O和一种未知物质X。
、H3AsO4、H2O和一种未知物质X。(1)已知
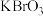 在反应中得到电子,则该反应的还原剂是
在反应中得到电子,则该反应的还原剂是(2)已知0.2mol
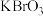 在反应中得到1mol电子生成X,则X的化学式为
在反应中得到1mol电子生成X,则X的化学式为(3)根据上述反应可推知
a.氧化性:
 b.氧化性:
b.氧化性:
c.还原性:
 d.还原性:
d.还原性:
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方
向和数目:

您最近一年使用:0次
2016-12-09更新
|
633次组卷
|
2卷引用:2020年安徽省全省教学质量检测统一考试(练习检测一)
3 . 下列有关实验操作、现象与结论对应关系正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol·L-1 硫酸溶液 | 试管口出现红棕色气体 | 溶液中NO3- 被Fe2+还原为NO2 |
| B | H2S通入CuSO4溶液中 | 溶液中出现黑色沉淀 | 酸性:H2S>H2SO4溶液 |
| C | 在CuSO4溶液中加入KI溶液,再加入苯,振荡、静置 | 有白色沉淀生成,苯层呈紫红色 | 白色沉淀可能为CuI |
| D | 将一小块钠投入到CuSO4溶液中 | 有无色无味的气体放出,且出现蓝色沉淀 | 氧化性:H+>Cu2+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2014·河北唐山·一模
名校
4 . 根据表中信息判断,下列选项正确的是
| 序号 | 反应物 | 产物 |
| ① | KMnO4,H2O2,H2SO4 | K2SO4、MnSO4……… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-………… | Cl2、Mn2+ |
| A.第①组反应的其余产物为H2O |
| B.第②组反应中Cl2与FeBr2的物质的量之比小于或等于1 : 2 |
| C.第③组反应中生成1 mol Cl2,转移电子5 mol |
| D.氧化性由强到弱的顺序为MnO4->Cl2>Fe3+>Br2 |
您最近一年使用:0次
2014-04-02更新
|
1191次组卷
|
7卷引用:2015-2016学年安徽省六安一中高一上学期期末化学试卷
2013·上海浦东新·二模
名校
5 . 重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业上通过煅烧铬铁矿制取,其反应如下:
反应Ⅰ 4Fe(CrO2)2+8Na2CO3+7O2→ 2Fe2O3+8Na2CrO4+8CO2
反应Ⅱ 2CrO42-+ 2H+ → Cr2O72-+ H2O
反应Ⅲ 3CrO42- + 4H+ →Cr3O102-+ 2H2O(副反应)
(1)上述反应中不属于氧化还原反应有________ 个。已知Fe(CrO2)2中铬元素是+3价,关于反应Ⅰ的下列说法中正确的是________ 。
a.被氧化的元素只有+3的Cr,被还原的元素只有0价的O
b.氧化剂与还原剂的物质的量之比为4:7
c.每生成1molCO2,转移3.5mol电子
d.每摩尔+3的Cr能还原0.75mol氧气
(2)+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O72-,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式并标出电子转移的方向和数目:_________________________________________________________ 。
(3)某厂废水中含1.00×10−3mol/L的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Cr的化合价为+3,Fe的化合价依次为+3、+2)。欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入_____________ g FeSO4·7H2O。
反应Ⅰ 4Fe(CrO2)2+8Na2CO3+7O2→ 2Fe2O3+8Na2CrO4+8CO2
反应Ⅱ 2CrO42-+ 2H+ → Cr2O72-+ H2O
反应Ⅲ 3CrO42- + 4H+ →Cr3O102-+ 2H2O(副反应)
(1)上述反应中不属于氧化还原反应有
a.被氧化的元素只有+3的Cr,被还原的元素只有0价的O
b.氧化剂与还原剂的物质的量之比为4:7
c.每生成1molCO2,转移3.5mol电子
d.每摩尔+3的Cr能还原0.75mol氧气
(2)+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O72-,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式并标出电子转移的方向和数目:
(3)某厂废水中含1.00×10−3mol/L的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Cr的化合价为+3,Fe的化合价依次为+3、+2)。欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入
您最近一年使用:0次
2013-10-09更新
|
1345次组卷
|
4卷引用:安徽省六安市第一中学2018届高三上学期第二次月考化学试题
安徽省六安市第一中学2018届高三上学期第二次月考化学试题(已下线)2013届上海市浦东新区高三下学期二模化学试卷(已下线)上海市浦东新区2013届高三4月高考预测(二模)化学试题陕西省汉中中学2021-2022学年高二下学期4月月考化学试题
11-12高三·浙江温州·阶段练习
真题
名校
6 . 硒和硫是同一主族元素,二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和一定量的浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3反应的化学方程式:________________________________________ 。
(2)已知:Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O===Se+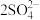 +4H+,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
+4H+,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________________________________ 。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①_____SeO2+_______KI+______HNO3=__________Se+__________I2+__________KNO3+_______H2O
②I2+2Na2S2O3===Na2S4O6+2NaI
配平化学方程①,并标出电子转移的方向和数目。__________
(4)实验中,准确称量SeO2样品0.1500g,消耗了0.2000mol·L-1的Na2S2O3溶液25.00mL,所测样品中SeO2的质量分数为__________ 。
(1)Se和一定量的浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3反应的化学方程式:
(2)已知:Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O===Se+
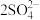 +4H+,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
+4H+,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①_____SeO2+_______KI+______HNO3=__________Se+__________I2+__________KNO3+_______H2O
②I2+2Na2S2O3===Na2S4O6+2NaI
配平化学方程①,并标出电子转移的方向和数目。
(4)实验中,准确称量SeO2样品0.1500g,消耗了0.2000mol·L-1的Na2S2O3溶液25.00mL,所测样品中SeO2的质量分数为
您最近一年使用:0次
2012-11-23更新
|
1465次组卷
|
16卷引用:安徽省合肥市第六中学2017-2018学年高一上学期期中考试化学试题
安徽省合肥市第六中学2017-2018学年高一上学期期中考试化学试题(已下线)2013届浙江省乐清市第二中学高三第一次月考化学试卷(已下线)2012-2013学年湖北省部分重点中学高一秋季期中联考化学试卷(已下线)2013-2014黑龙江省鹤岗一中高二下学期期末考试化学试卷2016届山东省枣庄市第二中学高三9月阶段性学情检测化学试题2016届重庆市万州二中高三上学期9月月考化学试卷2016届江西省高安市第二中学高三上学期第二次段考化学试卷2016届山西省晋中市四校高三上学期期中联考化学试卷2016届山西平遥中学等重点中学高三第三次练兵化学试卷2016届辽宁省实验中学分校高三上期中测试理综化学试卷2017届湖北省荆州中学高三上学期8月摸底化学试卷2018届高三一轮复习化学:考点14-氧化还原反应的计算山东省济宁市微山县第二中学2018届高三上学期第一次月考化学试题北京市第二十中学2018届高三10月月考化学试题吉林省白城市通榆县第一中学2020届高三上学期第一次月考化学试题2012年上海市高考化学试题
7 . 若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应不正确的是
| A.Mn+2HCl=MnCl2+H2↑ | B.Mg+MnSO4=MgSO4+Mn |
| C.Mn+Cu(NO3)2=Mn(NO3)2+Cu | D.Fe+MnSO4=FeSO4+Mn |
您最近一年使用:0次
10-11高三·安徽淮北·阶段练习
8 . 雄黄(AS4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
⑴As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,该反应的化学方程式为_______________ 。
⑵上述反应中的氧化剂是________ ,反应产生的气体可用_____ 吸收。
⑶As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O,若生成2mol H3AsO4,则反应中转移电子的物质的量为________ 。若将该反应设计成一原电池,则NO2应该在____ 极附近逸出。
⑷将⑶中反应产物NO2充满干燥的烧瓶,然后将烧瓶倒立于少水槽中,向烧瓶中通入一定量的氧气,气体恰好完全溶于水(假设溶液没有扩散),则烧瓶中溶液溶质的物质的量浓度为_______ (设该条件下的气体摩尔体积为23.8 ,结果保留到小数点后三位)。
,结果保留到小数点后三位)。
⑴As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,该反应的化学方程式为
⑵上述反应中的氧化剂是
⑶As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O,若生成2mol H3AsO4,则反应中转移电子的物质的量为
⑷将⑶中反应产物NO2充满干燥的烧瓶,然后将烧瓶倒立于少水槽中,向烧瓶中通入一定量的氧气,气体恰好完全溶于水(假设溶液没有扩散),则烧瓶中溶液溶质的物质的量浓度为
 ,结果保留到小数点后三位)。
,结果保留到小数点后三位)。
您最近一年使用:0次
11-12高三上·安徽合肥·阶段练习
9 . 水热法制备Fe3O4纳米颗粒的反应是 3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,回答下列问题:
(1)x=________ ;
(2)该反应中的还原剂是___________ ;
(3)1 mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为__________ ;
(4)该反应中,每生成1 mol Fe3O4,该反应转移的电子总的物质的量为____________ ;
(5)Na2S2O3与稀硫酸反应生成一种沉淀和一种有刺激性气味的气体,写出该反应的离子方程式:_________________ 。
(1)x=
(2)该反应中的还原剂是
(3)1 mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为
(4)该反应中,每生成1 mol Fe3O4,该反应转移的电子总的物质的量为
(5)Na2S2O3与稀硫酸反应生成一种沉淀和一种有刺激性气味的气体,写出该反应的离子方程式:
您最近一年使用:0次



