1 .  又称百毒净,可用于水的净化和纸张、纺织品的漂白等。用如图所示装置(夹持装置和加热装置省略)制备
又称百毒净,可用于水的净化和纸张、纺织品的漂白等。用如图所示装置(夹持装置和加热装置省略)制备 并探究
并探究 的某些性质,已知
的某些性质,已知 浓度较大时易分解爆炸。
浓度较大时易分解爆炸。
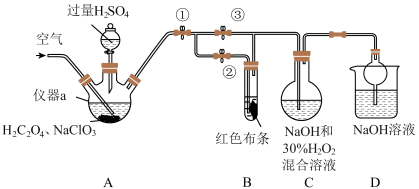
回答下列问题:
(1)通入空气的目的为_______ 。
(2)补充并配平实验中制备 的化学方程式:
的化学方程式:_______ 。
_______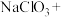 _______
_______ _______
_______ _______
_______ _______
_______ _______+_______
_______+_______
工业上也可用 氧化
氧化 溶液制取
溶液制取 ,写出该反应的离子方程式,并用单线桥法标出电子转移的方向和数目:
,写出该反应的离子方程式,并用单线桥法标出电子转移的方向和数目:_______ 。
(3)关闭止水夹②,打开止水夹①③,通入空气一段时间后,装置C中生成了 和气体,反应中
和气体,反应中 表现出
表现出_______ (填“氧化”或“还原”)性;若关闭止水夹③,打开止水夹②,B中可观察到的现象为_______ 。
(4)D装置的作用是_______ 、_______ 。
(5) 和
和 在水处理过程中分别被还原为
在水处理过程中分别被还原为 和
和 。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么
。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么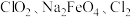 三种消毒杀菌剂的消毒效率由高到低的顺序是
三种消毒杀菌剂的消毒效率由高到低的顺序是_______ (填化学式)。
 又称百毒净,可用于水的净化和纸张、纺织品的漂白等。用如图所示装置(夹持装置和加热装置省略)制备
又称百毒净,可用于水的净化和纸张、纺织品的漂白等。用如图所示装置(夹持装置和加热装置省略)制备 并探究
并探究 的某些性质,已知
的某些性质,已知 浓度较大时易分解爆炸。
浓度较大时易分解爆炸。
回答下列问题:
(1)通入空气的目的为
(2)补充并配平实验中制备
 的化学方程式:
的化学方程式:_______
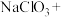 _______
_______ _______
_______ _______
_______ _______
_______ _______+_______
_______+_______
工业上也可用
 氧化
氧化 溶液制取
溶液制取 ,写出该反应的离子方程式,并用单线桥法标出电子转移的方向和数目:
,写出该反应的离子方程式,并用单线桥法标出电子转移的方向和数目:(3)关闭止水夹②,打开止水夹①③,通入空气一段时间后,装置C中生成了
 和气体,反应中
和气体,反应中 表现出
表现出(4)D装置的作用是
(5)
 和
和 在水处理过程中分别被还原为
在水处理过程中分别被还原为 和
和 。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么
。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么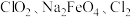 三种消毒杀菌剂的消毒效率由高到低的顺序是
三种消毒杀菌剂的消毒效率由高到低的顺序是
您最近一年使用:0次
2 . 某研究小组利用如图装置(夹持装置略)制备氯气,并探究不同条件下氯气与二价锰化合物的反应。
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、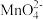 (绿色)、
(绿色)、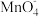 (紫色)
(紫色)
ii.浓碱条件下,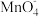 可被OH-还原为
可被OH-还原为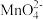
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱
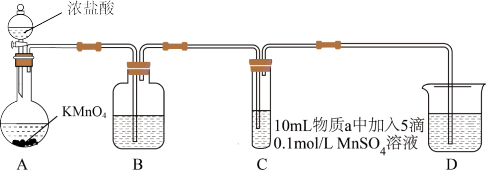
(1)盛装浓盐酸的仪器名称是____ ,为减缓生成Cl2的速率,可以采用的方法是____ 。
(2)B中试剂是____ 。
(3)D的作用是____ ,可选用的试剂____ (填标号)。
a.NaCl b.FeCl2 c.Na2SO3 d.NaOH e.H2SO4
(4)通入Cl2后,I中产生棕黑色沉淀的化学方程式为_____ 。
(5)对比实验I、II通入Cl2后的实验现象,可以得出的结论是:二价锰化合物的还原性____ 。
(6)根据资料ii,III中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将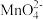 氧化为
氧化为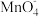
①用离子方程式表示可能导致溶液碱性减弱的原因____ ,但通过实验测定溶液的碱性变化很小。
②取III中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填“化学式”)氧化,可证明III的悬浊液中氧化剂过量。
③取III中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深的原因是____ 。
④从反应速率的角度,分析实验III未得到绿色溶液的可能原因____ 。
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、
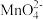 (绿色)、
(绿色)、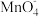 (紫色)
(紫色)ii.浓碱条件下,
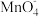 可被OH-还原为
可被OH-还原为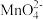
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱

| 序号 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| I | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| II | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| III | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)B中试剂是
(3)D的作用是
a.NaCl b.FeCl2 c.Na2SO3 d.NaOH e.H2SO4
(4)通入Cl2后,I中产生棕黑色沉淀的化学方程式为
(5)对比实验I、II通入Cl2后的实验现象,可以得出的结论是:二价锰化合物的还原性
(6)根据资料ii,III中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将
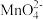 氧化为
氧化为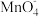
①用离子方程式表示可能导致溶液碱性减弱的原因
②取III中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取III中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深的原因是
④从反应速率的角度,分析实验III未得到绿色溶液的可能原因
您最近一年使用:0次
名校
解题方法
3 . 下列方案设计、现象和结论都正确的是
| 实验目的 | 方案设计 | 现象和结论 | |
| A | 证明H2O2有氧化性 | 将足量的H2O2溶液滴入酸性高锰酸钾溶液中 | 若溶液中的紫红色褪去,则证明H2O2有氧化性 |
| B | 探究浓硫酸的特性 | 将浓硫酸滴到蔗糖表面,固体变黑膨胀,有刺激性气体产生 | 浓硫酸有脱水性和强氧化性 |
| C | 鉴别两种红棕色气体NO2和Br2(g) | 向盛有KI-淀粉溶液的试管中通入气体 | 溶液变成蓝色,说明该气体是Br2(g) |
| D | 检验MnO2和浓盐酸反应后是否有酸剩余 | 取少量反应后的溶液于试管中,依次加入稀硝酸、AgNO3溶液,观察 | 若产生大量白色沉淀,则说明盐酸有剩余 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-25更新
|
248次组卷
|
4卷引用:安徽省舒城中学2021-2022学年高一下学期第二次月考化学试题
名校
4 . 下列实验过程可以达到实验目的的是
| 选项 | 实验目的 | 实验过程 |
| A | 移取15.00 mLKI溶液 | 向20 mL量筒加入KI溶液至刻度线15处,然后倒出 |
| B | 制取并纯化SO2 | 将浓硫酸滴入Na2SO3中,生成的气体依次通过饱和NaHCO3溶液、浓硫酸 |
| C | 比较BaSO4和BaSO3的Ksp | 向盛有BaCl2溶液的试管中先加入Na2SO3溶液,然后加入Na2SO4,观察现象 |
| D | 探究H2O2的还原性 | 向盛有2mL酸性KMnO4溶液的试管中滴加浓的H2O2溶液,观察现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-05-06更新
|
212次组卷
|
3卷引用:安徽省滁州市明光市第二中学2020-2021学年高二下学期期末评价性考试化学试题
5 . 用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
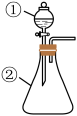
| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 氯化铝溶液 | 氢氧化钠溶液 | 立即产生白色沉淀 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生大量红棕色气体 |
| C | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| D | 稀盐酸 | 碳酸钠溶液 | 立即产生大量气泡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 .  是一种易自燃的气体,能被
是一种易自燃的气体,能被 溶液吸收生成
溶液吸收生成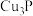 。实验室利用白磷与过量的NaOH溶液制备
。实验室利用白磷与过量的NaOH溶液制备 (反应过程中同时有
(反应过程中同时有 生成)。下列说法不正确的是
生成)。下列说法不正确的是
 是一种易自燃的气体,能被
是一种易自燃的气体,能被 溶液吸收生成
溶液吸收生成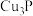 。实验室利用白磷与过量的NaOH溶液制备
。实验室利用白磷与过量的NaOH溶液制备 (反应过程中同时有
(反应过程中同时有 生成)。下列说法不正确的是
生成)。下列说法不正确的是A.熔沸点: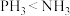 |
B.制取 时, 时, |
| C.装置中加入白磷前应先通入氮气 |
D. 溶液吸收 溶液吸收 表现了 表现了 的氧化性 的氧化性 |
您最近一年使用:0次
名校
解题方法
7 . 某科学小组为研究不同价态含硫物质的转化设计了如图实验,请回答有关问题。

(1)装置A中发生反应的化学方程式为________ 。该反应体现了浓硫酸的_________ 性。
(2)B处实验现象是___________ ,由此推测硫元素从+4价变为+6价。
(3)检验B处有 生成的方法是
生成的方法是___________ 。
(4)C处观察到蘸有 溶液的棉花上出现黄色固体,可推测此反应过程中硫元素的价态变化分别是
溶液的棉花上出现黄色固体,可推测此反应过程中硫元素的价态变化分别是___________ 。
(5)D装置的作用是___________ ,发生反应的化学方程式为___________ 。
(6)工业上煅烧硫铁矿制取硫酸,煅烧 含
含 的硫铁矿石(杂质不参加反应),假设还有质量分数为4%的硫留在炉渣里,计算理论上可制备
的硫铁矿石(杂质不参加反应),假设还有质量分数为4%的硫留在炉渣里,计算理论上可制备 浓硫酸的质量为
浓硫酸的质量为___________  (提示:化合物中某元素的损失率=该化合物损失率)。
(提示:化合物中某元素的损失率=该化合物损失率)。

(1)装置A中发生反应的化学方程式为
(2)B处实验现象是
(3)检验B处有
 生成的方法是
生成的方法是(4)C处观察到蘸有
 溶液的棉花上出现黄色固体,可推测此反应过程中硫元素的价态变化分别是
溶液的棉花上出现黄色固体,可推测此反应过程中硫元素的价态变化分别是(5)D装置的作用是
(6)工业上煅烧硫铁矿制取硫酸,煅烧
 含
含 的硫铁矿石(杂质不参加反应),假设还有质量分数为4%的硫留在炉渣里,计算理论上可制备
的硫铁矿石(杂质不参加反应),假设还有质量分数为4%的硫留在炉渣里,计算理论上可制备 浓硫酸的质量为
浓硫酸的质量为 (提示:化合物中某元素的损失率=该化合物损失率)。
(提示:化合物中某元素的损失率=该化合物损失率)。
您最近一年使用:0次
2024-02-21更新
|
858次组卷
|
2卷引用:安徽省亳州市第二完全中学2023-2024学年高一下学期3月第一次月考化学试题
名校
解题方法
8 . I.氯气是一种重要的化工原料,氯气及其化合物在自来水的消毒、农药的生产、药物的合成等领域都有着重要的应用。
(1)NaClO具有较强的_______ (填“氧化”或“还原”)性,是常用的消毒剂和漂白剂的有效成分。
(2)黄色气体 可用于污水杀菌和饮用水净化。
可用于污水杀菌和饮用水净化。
① 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 ,
, 被氧化为
被氧化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
② 可将废水中的
可将废水中的 氧化为
氧化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为_______ 。
Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题:

(3)实验室常用A装置制备氯气,写出该反应的离子方程式_______ 。
(4)C装置的作用是_______ 。
(5)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成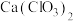 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是_______ 。
②另一个副反应会导致漂白粉中 含量偏高,为避免此副反应的发生,装置的改进措施为
含量偏高,为避免此副反应的发生,装置的改进措施为_______ 。
(1)NaClO具有较强的
(2)黄色气体
 可用于污水杀菌和饮用水净化。
可用于污水杀菌和饮用水净化。①
 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 ,
, 被氧化为
被氧化为 ,该反应的离子方程式为
,该反应的离子方程式为②
 可将废水中的
可将废水中的 氧化为
氧化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题:

(3)实验室常用A装置制备氯气,写出该反应的离子方程式
(4)C装置的作用是
(5)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成
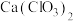 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是②另一个副反应会导致漂白粉中
 含量偏高,为避免此副反应的发生,装置的改进措施为
含量偏高,为避免此副反应的发生,装置的改进措施为
您最近一年使用:0次
9 . 二氧化氯( )是一种黄绿色的气体,易溶于水,熔点:-59℃,沸点:11℃。
)是一种黄绿色的气体,易溶于水,熔点:-59℃,沸点:11℃。 浓度过高时易发生分解生成氯气和氧气,是一种有效的绿色氧化剂,可用于饮用水的消毒和纸浆漂白等。利用亚硫酸铵、氯酸钠和硫酸制备
浓度过高时易发生分解生成氯气和氧气,是一种有效的绿色氧化剂,可用于饮用水的消毒和纸浆漂白等。利用亚硫酸铵、氯酸钠和硫酸制备 的实验装置如下(夹持装置已省略):
的实验装置如下(夹持装置已省略):
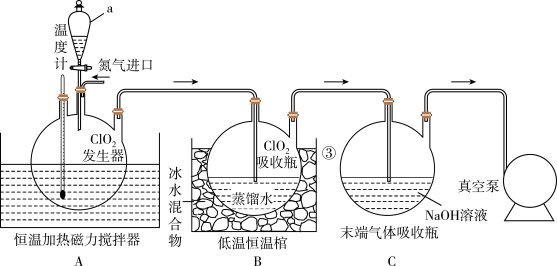
回答下列问题:
(1)仪器a的名称为_______ ;装置A中发生反应的化学方程式为_______ 。
(2)氮气流速过快或过慢都不利于 的吸收,试分析原因:
的吸收,试分析原因:_______ ;_______ 。
(3)装置C的作用是_______ 。
(4)若加入反应物中 浓度过大,会产生大量
浓度过大,会产生大量 与
与 反应,使
反应,使 产率降低,反应的离子方程式为
产率降低,反应的离子方程式为_______ ,可以用取样注射器吸取少量液体于试管中,加入_______ (填字母),来检验是否产生了大量 。
。
A.酸性 溶液 B.品红溶液 C.
溶液 B.品红溶液 C. 溶液
溶液
(5)取VmL装置A中溶液,用2步碘量法测定其中 、
、 的浓度。
的浓度。
第1步:调节溶液 ,加入足量KI溶液,此时
,加入足量KI溶液,此时 不被还原,而
不被还原,而 变为
变为 ,发生的反应为
,发生的反应为 ,生成的
,生成的 用
用 的
的 标准溶液滴定,消耗标准溶液的体积为
标准溶液滴定,消耗标准溶液的体积为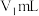 (
( )。
)。
第2步:调节溶液 ,此时溶液中剩余未反应的
,此时溶液中剩余未反应的 以及由第1步
以及由第1步 被还原所生成的
被还原所生成的 都被还原(
都被还原( ),滴定时消耗
),滴定时消耗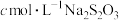 的标准溶液的体积为
的标准溶液的体积为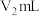 。原溶液中
。原溶液中 的浓度为
的浓度为_______  。
。
 )是一种黄绿色的气体,易溶于水,熔点:-59℃,沸点:11℃。
)是一种黄绿色的气体,易溶于水,熔点:-59℃,沸点:11℃。 浓度过高时易发生分解生成氯气和氧气,是一种有效的绿色氧化剂,可用于饮用水的消毒和纸浆漂白等。利用亚硫酸铵、氯酸钠和硫酸制备
浓度过高时易发生分解生成氯气和氧气,是一种有效的绿色氧化剂,可用于饮用水的消毒和纸浆漂白等。利用亚硫酸铵、氯酸钠和硫酸制备 的实验装置如下(夹持装置已省略):
的实验装置如下(夹持装置已省略):
回答下列问题:
(1)仪器a的名称为
(2)氮气流速过快或过慢都不利于
 的吸收,试分析原因:
的吸收,试分析原因:(3)装置C的作用是
(4)若加入反应物中
 浓度过大,会产生大量
浓度过大,会产生大量 与
与 反应,使
反应,使 产率降低,反应的离子方程式为
产率降低,反应的离子方程式为 。
。A.酸性
 溶液 B.品红溶液 C.
溶液 B.品红溶液 C. 溶液
溶液(5)取VmL装置A中溶液,用2步碘量法测定其中
 、
、 的浓度。
的浓度。第1步:调节溶液
 ,加入足量KI溶液,此时
,加入足量KI溶液,此时 不被还原,而
不被还原,而 变为
变为 ,发生的反应为
,发生的反应为 ,生成的
,生成的 用
用 的
的 标准溶液滴定,消耗标准溶液的体积为
标准溶液滴定,消耗标准溶液的体积为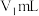 (
( )。
)。第2步:调节溶液
 ,此时溶液中剩余未反应的
,此时溶液中剩余未反应的 以及由第1步
以及由第1步 被还原所生成的
被还原所生成的 都被还原(
都被还原( ),滴定时消耗
),滴定时消耗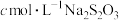 的标准溶液的体积为
的标准溶液的体积为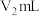 。原溶液中
。原溶液中 的浓度为
的浓度为 。
。
您最近一年使用:0次
名校
解题方法
10 . 物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据如图所示,回答下列问题:

(1)Y的化学式为__________________
(2)气体X和气体Y混合产生淡黄色的烟,写出该反应的化学方程式________ 。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是______ (填序号)。
a.Na2S +S b.Na2SO3+S c.Na2SO3+Na2SO4 d.SO2+Na2SO4
(4)如图为铜丝与W的浓溶液反应并验证其产物性质的实验装置。________ 。想要立即终止①的反应,最恰当的方法是__________ 。
a.上移铜丝,使其脱离溶液 b.撤去酒精灯 c.拔去橡胶塞倒出溶液
②装置④中品红溶液的作用是________ ,棉花团的作用__________ 。
③反应停止后,待装置冷却,把③取下后向其中加入氯水,观察到白色沉淀生成,写出相关反应的离子方程式__________ 。

(1)Y的化学式为
(2)气体X和气体Y混合产生淡黄色的烟,写出该反应的化学方程式
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是
a.Na2S +S b.Na2SO3+S c.Na2SO3+Na2SO4 d.SO2+Na2SO4
(4)如图为铜丝与W的浓溶液反应并验证其产物性质的实验装置。
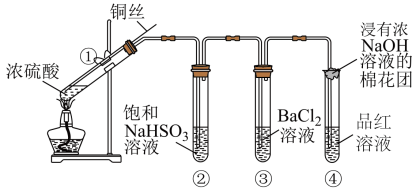
a.上移铜丝,使其脱离溶液 b.撤去酒精灯 c.拔去橡胶塞倒出溶液
②装置④中品红溶液的作用是
③反应停止后,待装置冷却,把③取下后向其中加入氯水,观察到白色沉淀生成,写出相关反应的离子方程式
您最近一年使用:0次
2020-05-08更新
|
118次组卷
|
2卷引用:安徽省滁州市明光市明光中学2019-2020高一下学期第二次月考化学试题



