1 . 回答下列问题:
(1)某反应为:4CuI+Hg = Cu2HgI4+2Cu (反应前后的I均为-1价),上述反应产物Cu2HgI4中,Hg元素显_______ 价;CuI发生_______ 反应(填“氧化”或“还原”)。当生成0.2mol Cu时,转移的电子数为_______ 。
(2)有同学认为所有酸碱中和反应均可表示为H++OH- =H2O。请举个例子反驳上述观点(用离子方程式表示)_______ 。
(3)有A、B、C、D、E五瓶透明溶液,溶质分别是HCl、BaCl2、NaHSO4、Na2CO3、AgNO3中的一种。已知:①A与B反应有气体生成;②B与C反应有沉淀生成;③C与D反应有沉淀生成;④D与E反应有沉淀生成;⑤A与E反应有气体生成;⑥②和③的反应中生成的沉淀是同一种物质。请填空:
i.B是_______ ,D是_______ 。
ii.⑤反应的离子方程式是_______ 。
(1)某反应为:4CuI+Hg = Cu2HgI4+2Cu (反应前后的I均为-1价),上述反应产物Cu2HgI4中,Hg元素显
(2)有同学认为所有酸碱中和反应均可表示为H++OH- =H2O。请举个例子反驳上述观点(用离子方程式表示)
(3)有A、B、C、D、E五瓶透明溶液,溶质分别是HCl、BaCl2、NaHSO4、Na2CO3、AgNO3中的一种。已知:①A与B反应有气体生成;②B与C反应有沉淀生成;③C与D反应有沉淀生成;④D与E反应有沉淀生成;⑤A与E反应有气体生成;⑥②和③的反应中生成的沉淀是同一种物质。请填空:
i.B是
ii.⑤反应的离子方程式是
您最近一年使用:0次
2 . 甲醛与新制氢氧化铜反应的产物随反应条件改变而有所不同。实验室对该反应在一定条件下所得产物成分进行探究,具体过程如下。取一定量的 溶液、
溶液、 溶液和甲醛于锥形瓶中,控制温度
溶液和甲醛于锥形瓶中,控制温度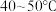 回流
回流 ,收集到大量气体X,并有砖红色沉淀生成。
,收集到大量气体X,并有砖红色沉淀生成。
(1)①“控制温度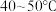 ”的常用加热方法是
”的常用加热方法是___________ 。
②气体X能燃烧且完全燃烧产物不会使澄清石灰水变浑浊,说明该气体是___________ 。
(2)在探究甲醛的氧化产物时,发现未生成 。为了进一步确定甲醛是否被氧化为
。为了进一步确定甲醛是否被氧化为 ,进行如图实验(省略夹持和加热装置,甲酸与浓硫酸反应能生成CO,而CO可将银氨溶液还原成银单质)。
,进行如图实验(省略夹持和加热装置,甲酸与浓硫酸反应能生成CO,而CO可将银氨溶液还原成银单质)。
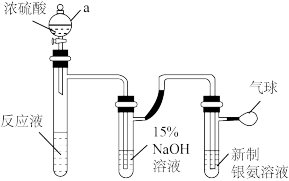
①仪器a的名称是___________ 。
②b中, 溶液的作用是
溶液的作用是___________ 。
③c中,银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为___________ 。
 溶液、
溶液、 溶液和甲醛于锥形瓶中,控制温度
溶液和甲醛于锥形瓶中,控制温度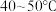 回流
回流 ,收集到大量气体X,并有砖红色沉淀生成。
,收集到大量气体X,并有砖红色沉淀生成。(1)①“控制温度
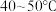 ”的常用加热方法是
”的常用加热方法是②气体X能燃烧且完全燃烧产物不会使澄清石灰水变浑浊,说明该气体是
(2)在探究甲醛的氧化产物时,发现未生成
 。为了进一步确定甲醛是否被氧化为
。为了进一步确定甲醛是否被氧化为 ,进行如图实验(省略夹持和加热装置,甲酸与浓硫酸反应能生成CO,而CO可将银氨溶液还原成银单质)。
,进行如图实验(省略夹持和加热装置,甲酸与浓硫酸反应能生成CO,而CO可将银氨溶液还原成银单质)。
①仪器a的名称是
②b中,
 溶液的作用是
溶液的作用是③c中,银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
3 . 氢能源是一种重要的清洁能源。现有两种可产生H2的固体化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g·L-1。请回答下列问题:
(1)乙的电子式是_______ 。
(2)甲可在加热时将二氧化碳还原为甲烷,其化学方程式是_______ 。
(3)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式_______ 。
(4)甲与乙之间能发生反应产生H2,判断理由是_______ 。
(1)乙的电子式是
(2)甲可在加热时将二氧化碳还原为甲烷,其化学方程式是
(3)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式
(4)甲与乙之间能发生反应产生H2,判断理由是
您最近一年使用:0次
4 . 回答下列问题:
(1)按如图所示操作,充分反应后:

①I中发生反应的离子方程式为_______ ;
②II中铜丝上观察到的现象是_______ ;
③结合I、II实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为_______ 。
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、 HNO3、NO、H2O。该反应体系中的还原产物是_______ 。
(3)将Cl2通入HBr溶液中,发生反应Cl2+2Br-=2Cl-+Br2,而将少量 Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,这个事实说明具有还原性的粒子的还原性强弱顺序为_______ 。
(1)按如图所示操作,充分反应后:

①I中发生反应的离子方程式为
②II中铜丝上观察到的现象是
③结合I、II实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、 HNO3、NO、H2O。该反应体系中的还原产物是
(3)将Cl2通入HBr溶液中,发生反应Cl2+2Br-=2Cl-+Br2,而将少量 Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,这个事实说明具有还原性的粒子的还原性强弱顺序为
您最近一年使用:0次
名校
解题方法
5 . 有下列三个在溶液中发生的氧化还原反应:
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③K2Cr2O7+14HCl=2KCl+2CrCl3+7H2O+3Cl2↑
请根据上述反应分析推断后回答下列问题:
(1)FeCl3、I2、Cl2、K2Cr2O7的氧化性由强到弱依次是___________ 。
(2)Cr2O 、I-在强酸性溶液中能否大量共存?
、I-在强酸性溶液中能否大量共存?___________ (填“能”或“不能”),理由是___________ 。
(3)在酸性溶液中存在大量的I-,则Cr2O 、Fe3+、Fe2+、Cl-中能与I-大量共存的离子是
、Fe3+、Fe2+、Cl-中能与I-大量共存的离子是___________ 。
(4)+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O 还原成Cr3+,反应的离子方程式为
还原成Cr3+,反应的离子方程式为___________ 。
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③K2Cr2O7+14HCl=2KCl+2CrCl3+7H2O+3Cl2↑
请根据上述反应分析推断后回答下列问题:
(1)FeCl3、I2、Cl2、K2Cr2O7的氧化性由强到弱依次是
(2)Cr2O
 、I-在强酸性溶液中能否大量共存?
、I-在强酸性溶液中能否大量共存?(3)在酸性溶液中存在大量的I-,则Cr2O
 、Fe3+、Fe2+、Cl-中能与I-大量共存的离子是
、Fe3+、Fe2+、Cl-中能与I-大量共存的离子是(4)+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O
 还原成Cr3+,反应的离子方程式为
还原成Cr3+,反应的离子方程式为
您最近一年使用:0次
2021-08-06更新
|
1259次组卷
|
10卷引用:重庆市南开中学2020-2021学年高一上学期期中(半期)考试化学试题
重庆市南开中学2020-2021学年高一上学期期中(半期)考试化学试题第3课时 氧化还原反应的基本规律和配平(课后)——课前、课中、课后同步专题精编(人教版2019必修第一册)江西省奉新县第一中学2021-2022学年高一上学期第一次月考化学试题河南省驻马店市新蔡县第一高级中学2021-2022学年高一上学期10月月考化学试题(已下线)1.3.2 氧化剂与还原剂 氧化还原反应规律-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)天津市第二十五中学2022-2023学年高一上学期第一次阶段检测化学试题内蒙古乌兰察布市2022-2023学年高一上学期期中考试化学试题河南省开封市尉氏三中南校区2021-2022学年高一上学期月考化学试题湖南省株洲市第二中学2023-2024学年高一上学期第二次适应性检测化学试题 黑龙江省牡丹江市第二高级中学2023-2024学年高一上学期期中考试化学试题
名校
6 . FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
Ⅰ.实验室制备FeBr2
实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴, 为外套电炉丝的不锈钢管,
为外套电炉丝的不锈钢管, 是两个耐高温的瓷皿,其中盛有细铁粉。实验开始时,先将铁粉加热至
是两个耐高温的瓷皿,其中盛有细铁粉。实验开始时,先将铁粉加热至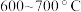 ,然后将干燥、纯净的CO2气流通入D中,
,然后将干燥、纯净的CO2气流通入D中, 管中反应开始。不断将d中液溴滴入温度为
管中反应开始。不断将d中液溴滴入温度为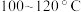 的D中。经过几小时的连续反应,在钢管的一端沉积有黄绿色鳞片状溴化亚铁。
的D中。经过几小时的连续反应,在钢管的一端沉积有黄绿色鳞片状溴化亚铁。


(1)若在A中盛固体CaCO3,a中盛6 mol/L盐酸,为使通入D中的CO2为干燥纯净的气体,则图中B、C处的洗气瓶中的试剂:B为___________ ,C为___________ 。为防止污染空气,实验时应在F处连接盛___________ 的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用是①___________ ,②___________ 。
Ⅱ.探究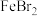 的还原性
的还原性
(3)实验需要90 mL0.1 mol/L FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外,还需要的玻璃仪器是___________ 。
(4)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设。假设1:Br-被Cl2氧化成Br2溶解在溶液中:假设2:Fe2+被Cl2氧化成Fe3+。设计实验证明假设2正确:___________ 。
(5)请用一个离子方程式来证明还原性Fe2+>Br-:___________ 。
(6)若在40 mL上述FeBr2溶液中通入3×10-3mol Cl2,则反应的离子方程式为___________ 。
Ⅰ.实验室制备FeBr2
实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,
 为外套电炉丝的不锈钢管,
为外套电炉丝的不锈钢管, 是两个耐高温的瓷皿,其中盛有细铁粉。实验开始时,先将铁粉加热至
是两个耐高温的瓷皿,其中盛有细铁粉。实验开始时,先将铁粉加热至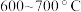 ,然后将干燥、纯净的CO2气流通入D中,
,然后将干燥、纯净的CO2气流通入D中, 管中反应开始。不断将d中液溴滴入温度为
管中反应开始。不断将d中液溴滴入温度为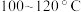 的D中。经过几小时的连续反应,在钢管的一端沉积有黄绿色鳞片状溴化亚铁。
的D中。经过几小时的连续反应,在钢管的一端沉积有黄绿色鳞片状溴化亚铁。

(1)若在A中盛固体CaCO3,a中盛6 mol/L盐酸,为使通入D中的CO2为干燥纯净的气体,则图中B、C处的洗气瓶中的试剂:B为
(2)反应过程中要不断通入CO2,其主要作用是①
Ⅱ.探究
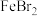 的还原性
的还原性(3)实验需要90 mL0.1 mol/L FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外,还需要的玻璃仪器是
(4)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设。假设1:Br-被Cl2氧化成Br2溶解在溶液中:假设2:Fe2+被Cl2氧化成Fe3+。设计实验证明假设2正确:
(5)请用一个离子方程式来证明还原性Fe2+>Br-:
(6)若在40 mL上述FeBr2溶液中通入3×10-3mol Cl2,则反应的离子方程式为
您最近一年使用:0次
2021-08-05更新
|
260次组卷
|
5卷引用:2017届江西省上高二中高三上学期第三次月考化学试卷
2017届江西省上高二中高三上学期第三次月考化学试卷黑龙江省哈尔滨市第六中学2017届高三下学期第三次模拟考试理科综合化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题27 假设猜想型实验探究评价题重庆市第三十七中学校 2021-2022学年(2022届)高三上学期 7月月考化学试题天津市新华中学2022-2023学年高三上学期学科练习(一)化学试题
名校
解题方法
7 . 有关短周期元素A、B、C、D、E、F的信息如下:
请回答下列问题:
(1)写出实验室制取乙的化学方程式___ 。
(2)下列说法正确的是___ (填序号)。

①实验室可用如图所示装置制取B的最高价氧化物
②用C单质做成的槽车,都可用来运输甲的浓溶液
③D单质在氧气中燃烧后的产物可用在防毒面具中作供氧剂
④鼓励乘坐公交车出行,倡导低碳生活,是控制和治理BO2解决“温室效应”的有效途径之一
⑤DF的电子式为
(3)将E的常见氧化物(该氧化物能使品红溶液褪色)通入由CuSO4和NaCl混合的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,可知其中含Cl:35.7%,Cu:64.3%,则该氧化物在上述反应中的作用是___ 。
A.漂白剂 B.氧化剂 C.还原剂
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | M层上有3个电子 |
| D | 短周期原子半径最大的主族元素 |
| E | 其单质是淡黄色固体 |
| F | 最高正价与最低负价代数和为6 |
(1)写出实验室制取乙的化学方程式
(2)下列说法正确的是

①实验室可用如图所示装置制取B的最高价氧化物
②用C单质做成的槽车,都可用来运输甲的浓溶液
③D单质在氧气中燃烧后的产物可用在防毒面具中作供氧剂
④鼓励乘坐公交车出行,倡导低碳生活,是控制和治理BO2解决“温室效应”的有效途径之一
⑤DF的电子式为

(3)将E的常见氧化物(该氧化物能使品红溶液褪色)通入由CuSO4和NaCl混合的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,可知其中含Cl:35.7%,Cu:64.3%,则该氧化物在上述反应中的作用是
A.漂白剂 B.氧化剂 C.还原剂
您最近一年使用:0次
解题方法
8 . 已知气体A和B的热浓溶液发生歧化反应会生成C和D,将D放入E中生成A和C,有时生成 ,将C加入硝酸银溶液中生成白色沉淀,且不溶于E,已知A是黄绿色气体。
,将C加入硝酸银溶液中生成白色沉淀,且不溶于E,已知A是黄绿色气体。
(1)写出化学式:A_____ ,B_____ ,C______ ,D_______ ;
(2)写出D加热分解发生歧化反应的化学式________ 。
 ,将C加入硝酸银溶液中生成白色沉淀,且不溶于E,已知A是黄绿色气体。
,将C加入硝酸银溶液中生成白色沉淀,且不溶于E,已知A是黄绿色气体。(1)写出化学式:A
(2)写出D加热分解发生歧化反应的化学式
您最近一年使用:0次
9 . 能将KI氧化为I2的若干种氧化剂有H2O2、Cl2、KIO3、HNO3、KClO3、KMnO4等。
(1)上述试剂最适合贴上的一个标签是_______ (填序号)。
A. B.
B.  C.
C. D.
D.
(2)配平方程式:KClO3+KI+H2SO4=K2SO4+KCl+I2+H2O,____________ 。已知过量KClO3会引起副反应:KClO3+I2→KIO3+Cl2,据此判断:I2和Cl2相比,氧化性较强的是_______ 。
(3)写出KI溶液与Cl2反应的离子方程式为_______ 。
(4)以单线桥法表示下列氧化还原反应的电子转移:H2O2+2H++3I-= +2H2O,
+2H2O,_____________ 。
(5)已知下列四种氧化剂(氧化KI后)对应的还原产物情况如下:
请判断,等物质的量的四种氧化剂分别与足量KI作用,得到I2最多的是_______ 。
(6)根据信息“氧化性Cl2>Br2>HNO3>I2”思考:对于I-、Br-混合溶液,若控制性氧化I-而不氧化Br-,请提出两种合理的氧化方案:①加入_______ ;②加入_______ 。
(1)上述试剂最适合贴上的一个标签是
A.
 B.
B.  C.
C. D.
D.
(2)配平方程式:KClO3+KI+H2SO4=K2SO4+KCl+I2+H2O,
(3)写出KI溶液与Cl2反应的离子方程式为
(4)以单线桥法表示下列氧化还原反应的电子转移:H2O2+2H++3I-=
 +2H2O,
+2H2O,(5)已知下列四种氧化剂(氧化KI后)对应的还原产物情况如下:
| 氧化剂 | KMnO4 | KIO3 | H2O2 | HNO3 |
| 还原产物 | Mn2+ | I2 | H2O | NO |
(6)根据信息“氧化性Cl2>Br2>HNO3>I2”思考:对于I-、Br-混合溶液,若控制性氧化I-而不氧化Br-,请提出两种合理的氧化方案:①加入
您最近一年使用:0次
2021-02-09更新
|
453次组卷
|
4卷引用:四川省成都市第七中学2020-2021学年高一上学期期中考试化学试题
四川省成都市第七中学2020-2021学年高一上学期期中考试化学试题(已下线)期中测试卷01-【对点变式题】2021-2022学年高一化学上学期期中期末必考题精准练(人教版2019)江苏省苏州实验中学2021-2022学年第高一上学期12月月考调研化学试题陕西省西安市铁一中学2021-2022学年高一上学期期中化学试题
解题方法
10 . 二氧化氯(ClO2)是安全、无毒的绿色消毒剂,浓度过高时易发生分解,常将其制备成NaClO2固体以便运输和储存。某研究性学习小组在实验室探究过氧化氢法制备亚氯酸钠。已知:NaClO2饱和溶液在温度低于38℃时,析出晶体是NaClO2·3H2O,温度高于38℃时,析出晶体是NaClO2,回答下列问题:
探究步骤:
I.NaClO2制备:装置如图所示(夹持装置略去)。

(1)该实验中,仪器A与分液漏斗相比,优点是____ 。
(2)装置B用于制备ClO2,制备过程中需要控制空气的流速,过快或过慢均会降低NaClO2产率,原因是____ 。
(3)装置C的作用是____ 。装置D中生成NaClO2的离子方程式为____ 。
(4)F装置可用NaOH溶液吸收尾气中的ClO2,生成物质的量之比为1:1的两种盐,一种为NaClO2,另一种为____ 。
II.产品分离提纯:
(5)反应后在装置D处获得NaClO2溶液。从NaClO2溶液中得到NaClO2晶体的操作步骤是:减压蒸发、_____ 、洗涤、干燥。
III.产品纯度测定:
(6)准确称取1.000g产品,加入适量蒸馏水配成100.00mL溶液;取10.00mL待测液于锥形瓶中,加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应;滴加几滴淀粉溶液,用0.2000 mol·L-1Na2S2O3标准液滴定,至滴定终点。重复3次,测得标准液体积平均值为20.00mL。
(滴定反应的离子方程式为I2+2 =2I-+
=2I-+ ),假设杂质不参加反应,样品中NaClO2的质量分数为
),假设杂质不参加反应,样品中NaClO2的质量分数为____ 。
探究步骤:
I.NaClO2制备:装置如图所示(夹持装置略去)。

(1)该实验中,仪器A与分液漏斗相比,优点是
(2)装置B用于制备ClO2,制备过程中需要控制空气的流速,过快或过慢均会降低NaClO2产率,原因是
(3)装置C的作用是
(4)F装置可用NaOH溶液吸收尾气中的ClO2,生成物质的量之比为1:1的两种盐,一种为NaClO2,另一种为
II.产品分离提纯:
(5)反应后在装置D处获得NaClO2溶液。从NaClO2溶液中得到NaClO2晶体的操作步骤是:减压蒸发、
III.产品纯度测定:
(6)准确称取1.000g产品,加入适量蒸馏水配成100.00mL溶液;取10.00mL待测液于锥形瓶中,加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应;滴加几滴淀粉溶液,用0.2000 mol·L-1Na2S2O3标准液滴定,至滴定终点。重复3次,测得标准液体积平均值为20.00mL。
(滴定反应的离子方程式为I2+2
 =2I-+
=2I-+ ),假设杂质不参加反应,样品中NaClO2的质量分数为
),假设杂质不参加反应,样品中NaClO2的质量分数为
您最近一年使用:0次



