1 . 如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:

(1)写出N2的一种用途:___________ 。
(2)写出NO2与H2O反应的化学方程式:___________ 。
(3)HNO3与图中的物质C常用于检验Cl-的存在,则C的化学式为___________ 。
(4)实验室制备B的化学方程式为:___________ 。
(5)从N元素化合价角度分析,上图中涉及的六种物质只有还原性的是___________ (填化学式,下同),既有氧化性又有还原性的是___________ 。

(1)写出N2的一种用途:
(2)写出NO2与H2O反应的化学方程式:
(3)HNO3与图中的物质C常用于检验Cl-的存在,则C的化学式为
(4)实验室制备B的化学方程式为:
(5)从N元素化合价角度分析,上图中涉及的六种物质只有还原性的是
您最近一年使用:0次
2 . 利用元素的化合价推测物质的性质是化学研究的重要手段。下图是硫元素的常见化合价与部分物质类别的对应关系:

(1)X与Y的反应中,氧化剂和还原剂的物质的量之比为___________ 。
(2) (s)与70% Z溶液反应的化学方程式为
(s)与70% Z溶液反应的化学方程式为___________ ,该反应体现了Z的___________ 性。
(3)将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀;然后再加入适量Z的浓溶液,迅速搅拌。可以观察到的现象为___________ 。上述实验不能表明Z的浓溶液具有的性质是___________ 。
A.酸性 B.吸水性 C.脱水性 D.强氧化性
(4) 中硫元素的化合价为
中硫元素的化合价为___________ ,从氧化还原反应的角度分析,下列制备 的原料选择,理论上可行的是
的原料选择,理论上可行的是___________ 。
A. B.
B.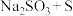 C.
C.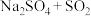 D.
D.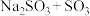
(5)某工厂每天燃烧含硫质量分数为0.64%的煤100t,如果煤中的硫全部转化为 ,且产生的
,且产生的 全部用来生产硫酸,理论上每年(按365天计)可得到98%的浓硫酸的质量为
全部用来生产硫酸,理论上每年(按365天计)可得到98%的浓硫酸的质量为___________ 。

(1)X与Y的反应中,氧化剂和还原剂的物质的量之比为
(2)
 (s)与70% Z溶液反应的化学方程式为
(s)与70% Z溶液反应的化学方程式为(3)将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀;然后再加入适量Z的浓溶液,迅速搅拌。可以观察到的现象为
A.酸性 B.吸水性 C.脱水性 D.强氧化性
(4)
 中硫元素的化合价为
中硫元素的化合价为 的原料选择,理论上可行的是
的原料选择,理论上可行的是A.
 B.
B.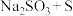 C.
C.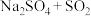 D.
D.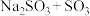
(5)某工厂每天燃烧含硫质量分数为0.64%的煤100t,如果煤中的硫全部转化为
 ,且产生的
,且产生的 全部用来生产硫酸,理论上每年(按365天计)可得到98%的浓硫酸的质量为
全部用来生产硫酸,理论上每年(按365天计)可得到98%的浓硫酸的质量为
您最近一年使用:0次
名校
解题方法
3 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:

已知:g为钠盐。
(1)按物质性质分类,c、d均属于___________ 氧化物。
(2)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有___________ (填化学式)。
(3)若将a与c混合可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为___________ 。
(4)f的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为___________ 。
(5)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是___________ (填字母)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)c→e→f是硫酸型酸雨的形成途径之一、某地收集的雨水样品在不同时间测得pH如表所示,请用化学方程式解释该雨水样品随时间变化酸性逐渐增强的原因___________ 。

已知:g为钠盐。
(1)按物质性质分类,c、d均属于
(2)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(3)若将a与c混合可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为
(4)f的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为
(5)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)c→e→f是硫酸型酸雨的形成途径之一、某地收集的雨水样品在不同时间测得pH如表所示,请用化学方程式解释该雨水样品随时间变化酸性逐渐增强的原因
| 时间/h | 0 | 2 | 4 | 6 | 8 | 10 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 |
您最近一年使用:0次
4 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:___________ 性。
(2)从硫元素化合价变化的角度分析,图中只有还原性的物质有___________ (填化学式)。
(3)将H2S与SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为___________ 。
(4)配平下列反应:___________
________Na2S+________Na2SO3+________H2SO4=________Na2SO4+________S↓+________H2O
(5)如图是验证SO2性质的实验装置。___________ (填序号,下同);B中___________ ;C中___________ 。
②D装置的作用是___________ 。

(2)从硫元素化合价变化的角度分析,图中只有还原性的物质有
(3)将H2S与SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为
(4)配平下列反应:
________Na2S+________Na2SO3+________H2SO4=________Na2SO4+________S↓+________H2O
(5)如图是验证SO2性质的实验装置。
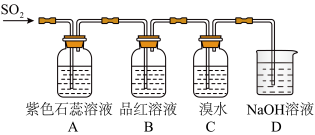
②D装置的作用是
您最近一年使用:0次
2022-12-21更新
|
232次组卷
|
2卷引用:湖北省武汉海淀外国语实验学校2022-2023学年高三上学期10月月考化学试题
解题方法
5 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
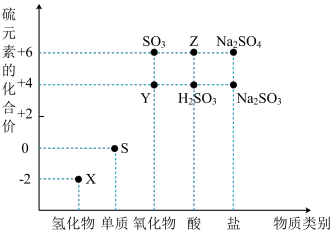
(1)S在周期表中的位置是_______ ;非金属性S_______ Cl(填“>”或“<”),S与Cl的最高价氧化物对应的水化物相比,酸性更强的是_______ (填化学式)。
(2)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______ (填化学式)。
(3)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_______ (填字母)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(4)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为_______ 。

(1)S在周期表中的位置是
(2)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(3)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(4)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为
您最近一年使用:0次
6 . 下表是元素周期表的一部分,回答下列有关问题:

(1)在①—⑩元素中,最活泼的金属元素是_______ (填元素名称),①的最高价氧化物的水化物为_______ (填“强”或“弱”)酸,④的最高价氧化物的水化物的电子式为_______ ,②③④的离子半径由大到小的顺序为_______ (用离子符号表示)。
(2)⑥的单质与⑩的最高价氧化物的水化物反应的离子方程式为_______
(3)⑧号元素的化合价与部分物质类别的对应关系如下图所示,回答相关问题:

①X的电离方程式为_______ 。
②Y可用于实验室制O2,其焰色反应为紫色,则Y含有的化学键类型有_______ ;写出实验室在催化剂作用下用Y制氧气的化学方程式_______ 。Y在400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1,生成的两种盐的化学式分别为_______ 。

(1)在①—⑩元素中,最活泼的金属元素是
(2)⑥的单质与⑩的最高价氧化物的水化物反应的离子方程式为
(3)⑧号元素的化合价与部分物质类别的对应关系如下图所示,回答相关问题:

①X的电离方程式为
②Y可用于实验室制O2,其焰色反应为紫色,则Y含有的化学键类型有
您最近一年使用:0次
解题方法
7 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有___________ (填化学式)。
(2)化合物X为___________ 。Y为___________ (填化学式);将X与Y混合,可生成黄色固体,该反应的化学反应方程式为___________ 。
(3) 是重要的化工原料。从氧化还原反应的角度分析,下列制备
是重要的化工原料。从氧化还原反应的角度分析,下列制备 的方案理论上可行的是
的方案理论上可行的是___________ (填序号)。
a. b.
b. c.
c. d.
d.

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(2)化合物X为
(3)
 是重要的化工原料。从氧化还原反应的角度分析,下列制备
是重要的化工原料。从氧化还原反应的角度分析,下列制备 的方案理论上可行的是
的方案理论上可行的是a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次
名校
解题方法
8 . 利用物质类别及核心元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:

(1)质量相同的a和b,物质的量之比为_______ 。将H2S与a混合,发生反应的氧化剂与还原剂的物质的量之比为_______ 。
(2)c的浓溶液能与S反应产生一种气体,该气体的化学式为_______ 。
(3)将足量的a通入BaCl2溶液中,下列说法正确的是_______(填标号)。
(4)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理:4Ag+2H2S+O2=2Ag2S+2H2O。H2S在该反应中_______(填标号)。
(5)若e为正盐,且能被酸性K2Cr2O7氧化为Na2SO4,Cr2O 被还原为Cr3+,写出此反应的离子方程式:
被还原为Cr3+,写出此反应的离子方程式:_______ 。
(6)若e为酸式盐,将0.1mole的溶液中加入适量H2O2氧化后,稀释成10L溶液进行环保回收,此时稀释后溶液的pH为_______ 。

(1)质量相同的a和b,物质的量之比为
(2)c的浓溶液能与S反应产生一种气体,该气体的化学式为
(3)将足量的a通入BaCl2溶液中,下列说法正确的是_______(填标号)。
| A.溶液中出现白色沉淀 |
| B.溶液没有明显变化 |
| C.若再通入Cl2或NH3,则溶液中均会出现白色沉淀 |
| D.将溶液蒸干后仍然能得到BaCl2 |
| A.是氧化剂 | B.是还原剂 |
| C.既是氧化剂也是还原剂 | D.既不是氧化剂也不是还原剂 |
 被还原为Cr3+,写出此反应的离子方程式:
被还原为Cr3+,写出此反应的离子方程式:(6)若e为酸式盐,将0.1mole的溶液中加入适量H2O2氧化后,稀释成10L溶液进行环保回收,此时稀释后溶液的pH为
您最近一年使用:0次
2022-05-18更新
|
127次组卷
|
2卷引用:西藏自治区拉萨市拉萨中学2022届高三第八次月考理综化学试题
9 . 某小组以4H++4I-+O2=2I2+2H2O为研究对象,探究影响氧化还原反应因素。
(1)实验Ⅳ的作用是______________ 。用CCl4萃取Ⅰ、Ⅱ、Ⅲ、Ⅳ的溶液,萃取后下层CCl4的颜色均无明显变化。
(2)取萃取后上层溶液,用淀粉检验:Ⅰ、Ⅲ的溶液变蓝;Ⅱ、Ⅳ的溶液未变蓝。溶液变蓝说明Ⅰ、Ⅲ中生成了______________ 。
(3)查阅资料:I2易溶于KI溶液。下列实验证实了该结论并解释Ⅰ、Ⅲ的萃取现象。
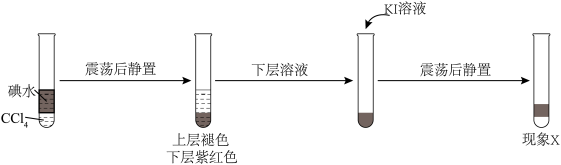
现象x是______________ 。
(4)针对Ⅱ中溶液未检出I2的原因,提出三种假设:
假设1:溶液中c(H+)较小。小组同学认为此假设不成立,依据是______________ 。
假设2:O2只氧化了SO2,化学方程式是______________ 。
假设3:I2不能在此溶液中存在。
(5)设计下列实验,验证了假设3,并继续探究影响氧化还原反应的因素。
i.取Ⅱ中亮黄色溶液,滴入品红,红色褪去。
ii.取Ⅱ中亮黄色溶液,加热,黄色褪去,经品红检验无SO2。加入酸化的AgNO3溶液,产生大量AgI沉淀,长时间静置,沉淀无明显变化。
iii.取Ⅱ中亮黄色溶液,控制一定电压和时间进行电解,结果如下。
结合化学反应,解释上表中的现象:______________ 。
(6)综合实验证据说明影响I-被氧化的因素及对应关系______________ 。
| 实验 | 气体a | 编号及现象 |
 | HCl | Ⅰ.溶液迅速呈黄色 |
| SO2 | Ⅱ.溶液较快呈亮黄色 | |
| CO2 | Ⅲ.长时间后,溶液呈很浅的黄色 | |
| 空气 | Ⅳ.长时间后,溶液无明显变化 |
(2)取萃取后上层溶液,用淀粉检验:Ⅰ、Ⅲ的溶液变蓝;Ⅱ、Ⅳ的溶液未变蓝。溶液变蓝说明Ⅰ、Ⅲ中生成了
(3)查阅资料:I2易溶于KI溶液。下列实验证实了该结论并解释Ⅰ、Ⅲ的萃取现象。

现象x是
(4)针对Ⅱ中溶液未检出I2的原因,提出三种假设:
假设1:溶液中c(H+)较小。小组同学认为此假设不成立,依据是
假设2:O2只氧化了SO2,化学方程式是
假设3:I2不能在此溶液中存在。
(5)设计下列实验,验证了假设3,并继续探究影响氧化还原反应的因素。
i.取Ⅱ中亮黄色溶液,滴入品红,红色褪去。
ii.取Ⅱ中亮黄色溶液,加热,黄色褪去,经品红检验无SO2。加入酸化的AgNO3溶液,产生大量AgI沉淀,长时间静置,沉淀无明显变化。
iii.取Ⅱ中亮黄色溶液,控制一定电压和时间进行电解,结果如下。
| 电解时间/min | 溶液 | 阳极 | 阴极 |
| t1 | 黄色变浅、有少量SO42- | 检出I2,振荡后消失 | H2 |
 | 溶液无色、有大量SO42- | 检出I2,振荡后消失 | H2 |
(6)综合实验证据说明影响I-被氧化的因素及对应关系
您最近一年使用:0次
2019-12-21更新
|
336次组卷
|
2卷引用:北京市第四中学2020届高三上学期期中考试化学试题
10 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。

回答下列问题:
(1)X的电离方程式为___ 。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=___ 。
(3)Y可用于实验室制O2,其焰色试验为紫色,则Y的化学式为___ ;Y在400℃时分解只生成两种盐。其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1,生成的两种盐的化学式分别___ 。
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的___ 倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为___ ,其中氧化剂与还原剂的物质的量之比为___ 。

回答下列问题:
(1)X的电离方程式为
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=
(3)Y可用于实验室制O2,其焰色试验为紫色,则Y的化学式为
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为
您最近一年使用:0次



