名校
1 . 关于反应 ,下列说法不正确的是
,下列说法不正确的是
 ,下列说法不正确的是
,下列说法不正确的是A.该反应中 中N元素被氧化 中N元素被氧化 |
| B.氧化产物与还原产物的物质的量之比为3∶4 |
C.反应中每生成1.4mol  时转移的电子数为4.8 时转移的电子数为4.8 |
D. 发生还原反应 发生还原反应 |
您最近一年使用:0次
2023-12-01更新
|
160次组卷
|
3卷引用:山东省菏泽市鄄城县第一中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
2 . 利用空气催化氧化法除掉电石渣浆(含CaO)上层清液中的S2-并制取石膏(CaSO4•2H2O)的过程如图:
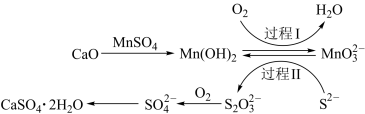
下列说法错误的是

下列说法错误的是
| A.CaSO4•2H2O属于盐类和纯净物 |
| B.过程I中氧化剂与还原剂的物质的量之比为1∶2 |
C.过程II中,反应的离子方程式为4MnO +2S2-+9H2O=S2O +2S2-+9H2O=S2O +4Mn(OH)2↓+10OH- +4Mn(OH)2↓+10OH- |
D.将10L上层清液中的S2-(S2-浓度为480mg•L-1)转化为SO ,理论上共需要0.15molO2 ,理论上共需要0.15molO2 |
您最近一年使用:0次
2023-05-07更新
|
903次组卷
|
6卷引用:山东省菏泽市郓城县第一中学(英华校区)2023-2024学年高三上学期10月阶段性考试化学试题
山东省菏泽市郓城县第一中学(英华校区)2023-2024学年高三上学期10月阶段性考试化学试题湖南省邵阳市2023届高三第三次联考(三模)化学试题(已下线)专题09 氧化还原反应(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)吉林省长春市东北师范大学附属中学2023-2024学年高三上学期9月一模化学试题吉林省延边第一中学2023-2024学年高三上学期第二次模考化学试题
名校
3 . 关于反应 ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是A. 既是氧化剂又是还原剂 既是氧化剂又是还原剂 | B.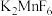 是氧化产物 是氧化产物 |
| C.氧化剂与还原剂物质的量之比为2:3 | D.生成1mol  ,转移4mol电子 ,转移4mol电子 |
您最近一年使用:0次
2023-05-06更新
|
511次组卷
|
4卷引用:山东省菏泽市郓城县第一中学(英华校区)2023-2024学年高三上学期10月阶段性考试化学试题
山东省菏泽市郓城县第一中学(英华校区)2023-2024学年高三上学期10月阶段性考试化学试题浙江省温州市2023届高三下学期5月第三次模拟适应性考试化学试题(已下线)【2023】【高三下】【模拟考】【温州三模】【高中化学】【李鼎收集】(已下线)第05练 氧化还原反应的综合考查-2023年【暑假分层作业】高二化学(2024届一轮复习通用)
名校
4 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,有强还原性,在空气中极易被氧化。用NaHSO3还原法制备保险粉的流程如图所示。下列说法正确的是


A.反应1的离子方程式为 |
| B.反应1结束后,可用盐酸酸化的BaCl2溶液检验NaHSO3是否被氧化 |
| C.反应2中消耗的氧化剂和还原剂的物质的量之比为1∶2 |
| D.反应2以及结晶脱水均可在空气中进行 |
您最近一年使用:0次
2023-01-15更新
|
783次组卷
|
5卷引用:山东省菏泽市鄄城县第一中学2022-2023学年高一上学期期末考试化学试题
5 . 已知反应: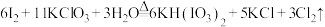 ,下列说法正确的是
,下列说法正确的是
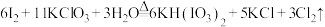 ,下列说法正确的是
,下列说法正确的是A.还原产物只有 |
| B.反应中氧化剂和还原剂的物质的量之比为6:11 |
C.可用碱石灰吸收反应产生的 制备漂白粉 制备漂白粉 |
D.产生 (标准状况) (标准状况) 时,转移 时,转移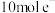 |
您最近一年使用:0次
解题方法
6 . F2和 Xe 在一定条件下可生成氧化性极强且极易水解的 XeF2、XeF4和 XeF6三种化合物。其中 XeF4与水可发生如下反应:6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑。下列判断中不正确的 是
| A.XeF2、XeF4和 XeF6都不能在空气中长期存放 |
| B.XeF6分子中 Xe 的化合价为+6 价 |
| C.XeF4按已知方式水解,反应中氧化剂和还原剂的物质的量之比为 1∶2 |
| D.XeF4按已知方式水解,反应中每生成 3molO2,转移 12mol 电子 |
您最近一年使用:0次
2021-10-19更新
|
76次组卷
|
2卷引用:山东省鄄城县实验中学2021-2022学年高三上学期第一次月考化学试卷题
7 . 关于反应8NH3+6NO2=7N2+12H2O,下列说法正确的是
| A.NH3中H元素被氧化 |
| B.NO2在反应过程中失去电子 |
| C.还原剂与氧化剂的物质的量之比为3:4 |
| D.氧化产物与还原产物的质量之比为4:3 |
您最近一年使用:0次
2021-01-09更新
|
9406次组卷
|
46卷引用:山东省菏泽外国语学校2023-2024学年高三上学期第一次月考化学试卷
山东省菏泽外国语学校2023-2024学年高三上学期第一次月考化学试卷2021年1月新高考浙江化学高考真题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练浙江省瑞安中学2020-2021学年高一下学期期初考试化学试题(已下线)第06讲 氧化还原反应(精练)-2022年高考化学一轮复习讲练测(已下线)课时09 氧化还原反应概念及应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第5讲 氧化还原反应(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)专题03 氧化还原反应-十年(2012-2021)高考化学真题分项汇编(浙江专用)甘肃省天水市田家炳中学2021-2022学年高三上学期第一阶段考试化学试题浙江省温州市瑞安市上海新纪元高级中学2021-2022学年高一9月份月考(5-6班)化学试题河南省新乡县高级中学2021-2022学年高一上学期第一次月考化学试题黑龙江省哈尔滨市第九中学2021-2022学年高一上学期第一次阶段性验收测试化学试题(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)江西省赣州市赣县第三中学2021-2022学年高一上学期期中适应考试化学试题(已下线)2021年1月浙江高考化学试题变式题1-10(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)山西省临汾市第一中学集团校2021-2022学年高二上学期期末联考化学试题(已下线)卷06 氧化还原-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)查补易混易错点05 氧化还原反应-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)微专题10 “守恒法”在氧化还原反应计算中的应用-备战2023年高考化学一轮复习考点微专题(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第03讲 氧化还原反应(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第03练 氧化还原反应-2023年高考化学一轮复习小题多维练(全国通用)浙江省金华市曙光学校2021-2022学年高三下学期5月模拟考试化学试题重庆市璧山来凤中学校2022-2023学年高三10月月考化学试题辽宁省北镇市满族高级中学2022-2023学年高三上学期第一次质量检测化学试题广东省广州市第七中学2022-2023学年高一上学期期中考试化学试题(已下线)专题04 氧化还原反应及其应用(讲)-2023年高考化学二轮复习讲练测(新高考专用)安徽省六安市舒城育才学校2022-2023学年高三上学期12月月考化学试题上海市实验学校2023届高三下学期3月月考化学试题广东省广州市第七中学2022-2023学年高一上学期期中考试化学试题(已下线)专题09 氧化还原反应(已下线)专题09 氧化还原反应(已下线)第4讲 氧化还原反应的基本概念与规律(已下线)第05练 氧化还原反应的综合考查-2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点11 氮及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)陕西省榆林市“府、米、绥、横、靖”五校联考2022-2023学年高二下学期期末考试化学试题陕西省汉中市西乡县第一中学2023-2024学年高二上学期开学考试化学试题四川省攀枝花市第十五中学校2023-2024学年高三上学期8月考试化学试题北京市首都师范大学附属中学2022-2023学年高三上学期开学测试化学试题宁夏青铜峡市宁朔中学2023-2024学年高一下学期开学考试化学试题
名校
解题方法
8 . NH3和NO2在催化剂作用下反应:8NH3+6NO2=7N2+12H2O。若还原产物比氧化产物少0.1 mol,则下列判断正确的是
| A.转移电子4.8NA个 | B.生成气体的体积42.56 L(标准状况) |
| C.还原剂比氧化剂多0.2 mol | D.被还原的氮原子是11.2 g |
您最近一年使用:0次
2020-11-24更新
|
228次组卷
|
12卷引用:山东省郓城实验中学2018届高三10月月考化学试题
山东省郓城实验中学2018届高三10月月考化学试题河北省武邑中学2018届高三上学期第一次月考化学试题四川省新津中学2018届高三上学期入学考试化学试题甘肃省兰州第一中学2018届高三上学期第二次月考(9月)化学试题安徽省滁州市民办高中2017-2018学年高一下学期第一次联考化学试题(已下线)学科网2019年高考化学一轮复习讲练测2.4 氧化还原反应的规律及应用 练湖北省宜昌市部分示范高中教学协作体2020届高三9月联考化学试题广东省北大附中深圳南山分校2020届高三上学期期中考试化学试题四川省攀枝花市第十五中学2019-2020学年高一下学期第二次月考化学试题河南省商丘市第一高级中学2020-2021学年高一上学期期中考试化学试题福建省莆田第十五中学2020届高三9月月考化学试题江苏省常州市第一中学2021-2022学年高一上学期期中考试化学试题
名校
解题方法
9 . SO2通入足量Fe(NO3)3稀溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。针对上述一系列变化过程,下列说法不正确的是( )
| A.上述过程中,最终被还原的是NO3- |
| B.从上述过程中可以得出氧化性:稀硝酸>稀硫酸>Fe3+ |
| C.上述过程中,会产生一种无色的难溶于水的气体 |
| D.若通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积比为3∶2 |
您最近一年使用:0次
2019-12-05更新
|
560次组卷
|
7卷引用:山东省菏泽一中南京路校区2023-2024学年高一上学期1月月考化学试题
山东省菏泽一中南京路校区2023-2024学年高一上学期1月月考化学试题2015-2016学年天津市六校高一上学期期末化学试卷2015-2016学年安徽省六安一中高一下周末作业二化学试卷鲁科版必修一2019—2020学年第三章检测试题贵州省黔南布依族苗族自治州瓮安第二中学2019-2020学年高一上学期期末考试化学试题(已下线)第三单元 物质的性质与转化(能力提升)-2020-2021学年高一化学必修第一册单元测试定心卷 (鲁科版2019)山东省枣庄市第八中学2022-2023学年高一上学期期末考试化学试题
名校
10 . 某离子反应涉及H2O、ClO-、NH4+ 、H+、N2、Cl-六种微粒。其中c(NH4+ )随反应进行逐渐减小。下列判断正确的是
| A.反应的还原产物是N2 |
| B.消耗1 mol氧化剂,转移电子3 mol |
| C.氧化剂与还原剂的物质的量之比为2:3 |
| D.反应后溶液的酸性明显增强 |
您最近一年使用:0次
2016-11-23更新
|
364次组卷
|
15卷引用:2017届山东省菏泽市高三上学期期末学分认定考试B卷化学试卷
2017届山东省菏泽市高三上学期期末学分认定考试B卷化学试卷2016届吉林省吉林大学附属中学高三上第四次摸底考试化学试卷2017届湖南省岳阳市华容县四校高三联考二化学试卷2017届福建省泉州市南安一中高三上学期第一次阶段考化学试卷陕西省西安中学2018届高三10月月考化学试题陕西省西安中学2018届高三上学期期中考试化学试题(已下线)【中等生百日捷进提升系列-基础练测】专题2.4 氧化还原反应江西省上饶中学2019届高三上学期开学检测化学试题福建省晋江市季延中学2018-2019学年高二上学期开学考试化学试题江西省赣州市会昌中学2019届高三上学期第一次月考(10月)化学试题山西省运城市临猗中学2019届高三上学期第一次月考化学试题【校级联考】福建省泉州市永春县永春二中、永春五中2019届高三上学期期中联合考试化学试题辽宁省沈阳铁路实验中学2020届高三上学期开学考试化学试题陕西省黄陵中学2019-2020学年高一上学期期末考试化学试题(普通班)甘肃省白银市第十中学2019-2020学年高一上学期期中考试化学试题



