1 . 某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。
已知:①A中反应为KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。
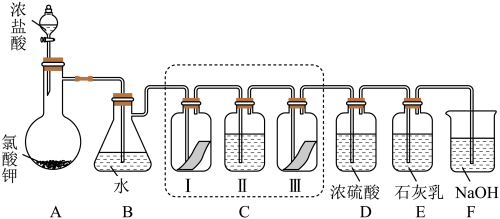
(1)写出B装置中反应的离子方程式_______ 。实验结束后,立即将B中溶液滴几滴在紫色石蕊试纸上,可观察到的现象是_______ 。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III 处依次放入的物质正确的是_______ (填编号)。
(3)F 装置的作用是(用离子方程式表示)_______
(4)为测定E中所得漂白粉的有效成分含量。称取 a g 漂白粉样品溶解,往所得溶液中通入 CO2至不再产生沉淀为止,若反应生成沉淀的物质的量为 b mol,则该漂白粉中有效成分的质量分数为_______ (用含 a、b 的式子表示)。
已知:①A中反应为KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。

(1)写出B装置中反应的离子方程式
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III 处依次放入的物质正确的是
编号 | I | II | III |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(4)为测定E中所得漂白粉的有效成分含量。称取 a g 漂白粉样品溶解,往所得溶液中通入 CO2至不再产生沉淀为止,若反应生成沉淀的物质的量为 b mol,则该漂白粉中有效成分的质量分数为
您最近一年使用:0次
解题方法
2 . 某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。已知:
①A 中反应为 KClO3+6HCl(浓) = KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为 Ca(OH)2,其他杂质不参与反应。
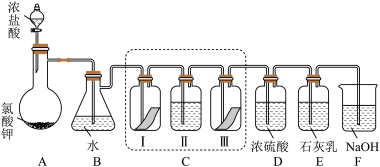
(1)写出 B 装置中反应的化学方程式_______________ 。实验结束后,立即将 B 中溶液滴几滴在紫色石蕊试纸上,可观察到的现象是______________ 。
(2)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中 I、II、III 处依次放入的物质正确的是_________ (填编号)。
(3)待 E 中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其有效成份为____________ (填化学式)。
(4)F 装置的作用是(用离子方程式表示)_____________
(5)为测定(3)中所得漂白粉的有效成份含量。称取 a g 漂白粉样品溶解,往所得溶液中通入 CO2至不再产生沉淀为止,若反应生成沉淀的物质的量为 b mol,则该漂白粉中有效成份的质量分数为_________________ (用含 a、b 的式子表示)。
①A 中反应为 KClO3+6HCl(浓) = KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为 Ca(OH)2,其他杂质不参与反应。

(1)写出 B 装置中反应的化学方程式
(2)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中 I、II、III 处依次放入的物质正确的是
| 编号 | I | II | III |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(4)F 装置的作用是(用离子方程式表示)
(5)为测定(3)中所得漂白粉的有效成份含量。称取 a g 漂白粉样品溶解,往所得溶液中通入 CO2至不再产生沉淀为止,若反应生成沉淀的物质的量为 b mol,则该漂白粉中有效成份的质量分数为
您最近一年使用:0次
名校
解题方法
3 . 下列实验方案能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 检验纯碱入中是否存在NaCl | 向待测液中加入AgNO3溶液 |
| B | 检验新制氯水的酸碱性 | 将pH试纸放在玻璃片上,用玻璃棒蘸取新制氯水点在试纸中部,再与标准比色卡对照 |
| C | 除去CO2气体中混杂的少量HCl气体 | 将混合气体依次通过盛有饱和NaHCO3溶液和浓硫酸的洗气瓶 |
| D | 测定NaHCO3和CaCO3固体混合物中的NaHCO3质量分数 | 准确称取ag样品和试管总质量。充分加热后冷却至室温,再称量总质量为bg |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-19更新
|
78次组卷
|
3卷引用:福建省师范大学附属中学2023-2024学年高一上学期期末考试化学试题
名校
4 . 某小组同学在实验室制备、收集氯气,并进行氯水中相关物质的性质探究,回答下列问题。
(1)制备Cl2。写出装置Ⅰ中发生的化学反应方程式_____________ 。
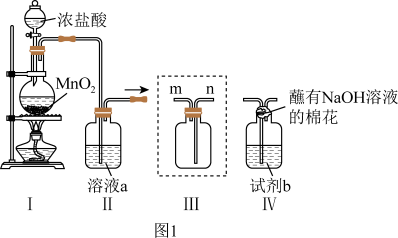
(2)氯水相关物质的性质探究。
①若装置Ⅳ中试剂b为H2O,制得氯水。写出Cl2与H2O反应的化学方程式为_________ 。
②若装置Ⅳ中试剂b为CCl4,可制得Cl2的CCl4溶液(Cl2可溶于CCl4溶液,且不与CCl4反应)。取稀盐酸、新制氯水、Cl2的CCl4溶液,分别滴在三张红色纸条上,可观察到只有滴加新制氯水的红色纸条褪色,证明____________________________ 。
③验证氯水中HClO光照分解的产物。将装置Ⅳ广口瓶中的氯水转移至三颈瓶内,将pH传感器、氯离子传感器、氧气传感器分别插入三颈瓶中(如图2),用强光照射氯水,进行实验并采集数据,获得相关变化曲线。

若能够证明氯水中HClO在光照下发生了分解反应,则图3中纵坐标可以表示的物理量是
_________ (填字母)。(注:酸性溶液中,c(H+)越大,pH越小,溶液酸性越强)。
a.氯水的pH b.氢离子的浓度 c.氯离子的浓度 d.氧气的体积分数 e.溶液的颜色
据此数据,可分析得到HClO在光照下发生的化学反应方程式为__________________ 。
(3)若要模拟工业制备漂白粉,装置Ⅳ中试剂b为_____ ,制备漂白粉的化学方程式为______________ 。
若用43.50g二氧化锰与足量浓盐酸(质量分数为36.50%)完全反应,制取氯气。将所得气体全部用于制备漂白粉,所制得的漂白粉中所含有效成分的质量为________ 。(本题要求写出计算过程,答案保留2位小数)
(1)制备Cl2。写出装置Ⅰ中发生的化学反应方程式

(2)氯水相关物质的性质探究。
①若装置Ⅳ中试剂b为H2O,制得氯水。写出Cl2与H2O反应的化学方程式为
②若装置Ⅳ中试剂b为CCl4,可制得Cl2的CCl4溶液(Cl2可溶于CCl4溶液,且不与CCl4反应)。取稀盐酸、新制氯水、Cl2的CCl4溶液,分别滴在三张红色纸条上,可观察到只有滴加新制氯水的红色纸条褪色,证明
③验证氯水中HClO光照分解的产物。将装置Ⅳ广口瓶中的氯水转移至三颈瓶内,将pH传感器、氯离子传感器、氧气传感器分别插入三颈瓶中(如图2),用强光照射氯水,进行实验并采集数据,获得相关变化曲线。

若能够证明氯水中HClO在光照下发生了分解反应,则图3中纵坐标可以表示的物理量是
a.氯水的pH b.氢离子的浓度 c.氯离子的浓度 d.氧气的体积分数 e.溶液的颜色
据此数据,可分析得到HClO在光照下发生的化学反应方程式为
(3)若要模拟工业制备漂白粉,装置Ⅳ中试剂b为
若用43.50g二氧化锰与足量浓盐酸(质量分数为36.50%)完全反应,制取氯气。将所得气体全部用于制备漂白粉,所制得的漂白粉中所含有效成分的质量为
您最近一年使用:0次
名校
解题方法
5 . 现有以下物质:
①KHSO4 固体 ②Al ③KIO3固体 ④Fe(OH)3胶体 ⑤FeSO4溶液 ⑥干冰 ⑦氯水 ⑧乙醇 ⑨熔融碳酸钠
回答下列问题:
(1)以上物质在上述状态下能导电的是___________ 。
(2)①在水溶液中的电离方程式为___________ 。
(3)向碳酸钠溶液中通入CO2反应的化学方程式:___________ 。
(4)③可发生如下反应 (未配平);配平该反应并用双线桥法分析电子转移的情况:
(未配平);配平该反应并用双线桥法分析电子转移的情况:___________ ;每生成3.81g I2,反应中转移电子的数目为___________ 。
(5)氯水中含有多种成分,因而具有多种性质。
①向氯水中滴加品红溶液观察到的现象是___________ ,可证明氯水中存在___________ 微粒。
②氯水久置过程中发生的变化,用化学反应方程式表示为___________ 。
③数字化实验将传感器、数据采集器和计算机相连,可利用信息技术对化学实验进行数据的采集和分析。下图是将传感器插入盛有氯水的广口瓶中测定光照氯水过程所得到的图像,该图像的纵坐标表示的意义是___________ 。
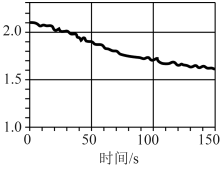
A.氯离子浓度 B.氧气体积分数 C.氯水的 D.Cl2的含量 E.氯水导电能力
D.Cl2的含量 E.氯水导电能力
①KHSO4 固体 ②Al ③KIO3固体 ④Fe(OH)3胶体 ⑤FeSO4溶液 ⑥干冰 ⑦氯水 ⑧乙醇 ⑨熔融碳酸钠
回答下列问题:
(1)以上物质在上述状态下能导电的是
(2)①在水溶液中的电离方程式为
(3)向碳酸钠溶液中通入CO2反应的化学方程式:
(4)③可发生如下反应
 (未配平);配平该反应并用双线桥法分析电子转移的情况:
(未配平);配平该反应并用双线桥法分析电子转移的情况:(5)氯水中含有多种成分,因而具有多种性质。
①向氯水中滴加品红溶液观察到的现象是
②氯水久置过程中发生的变化,用化学反应方程式表示为
③数字化实验将传感器、数据采集器和计算机相连,可利用信息技术对化学实验进行数据的采集和分析。下图是将传感器插入盛有氯水的广口瓶中测定光照氯水过程所得到的图像,该图像的纵坐标表示的意义是

A.氯离子浓度 B.氧气体积分数 C.氯水的
 D.Cl2的含量 E.氯水导电能力
D.Cl2的含量 E.氯水导电能力
您最近一年使用:0次
解题方法
6 . 海水中的卤素资源。地球是一颗蓝色星球,浩瀚的海洋覆盖了 70%以上的地球表面,是蕴藏着极为丰富化学资源的“聚宝盆”,其中氯化物含量很高,氯和同族的氟、溴、 碘、砹总称为卤素。
(1)氯在元素周期表中的位置是_______ 。
(2)下列关于卤族元素性质的比较,不正确的是_______。
(3)将氯气分别通入含下列离子的溶液中,离子浓度减小的是_______。
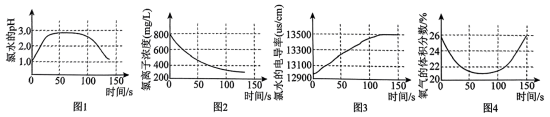
(4)氯气的水溶液即氯水,某学习小组拟用手持技术对新制饱和氯水进行检测,下列图像变化最有可能是其检测结果的是_______。
(1)氯在元素周期表中的位置是
(2)下列关于卤族元素性质的比较,不正确的是_______。
| A.酸性:HIO4>HBrO4>HClO4 | B.原子半径: I>Br>Cl |
| C.还原性:I->Br->Cl- | D.非金属性: Cl>Br>I |
A. | B. | C.Mg2+ | D.Fe³⁺ |

| A.图1 表示氯水pH 随时间的变化 |
| B.图2表示溶液中氯离子浓度随时间的变化 |
| C.图 3 表示氯水的电导率随时间的变化 |
| D.图4 表示液面上方氧气体积分数随时间的变化 |
您最近一年使用:0次
名校
解题方法
7 . 某品牌洁厕液的主要信息如图所示,下列说法正确的是
| 产品信息 产品名称:洁厕液 产品含量:500mL 产品成分:稀盐酸、香精 适用范围:便池、马桶和其他陶瓷表面 HCl含量:36.5 g/瓶 |
| A.该洁厕液能使紫色石蕊试液先变蓝后褪色 |
| B.该洁厕液易腐蚀大理石地砖 |
| C.HCl具有强氧化性,因此该洁厕液可用于杀菌消毒 |
| D.该洁厕液中HCl的物质的量浓度为1mol⋅L﹣1 |
您最近一年使用:0次
名校
8 . A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2−具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是_______ 。
(2)写出实验室制备F单质的化学反应方程式:_______ 。
(3)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为_______ ,其水溶液与少量的F单质反应的化学方程式为_______ 。
(4)由这些元素组成的物质,其组成和结构信息如下表:
①写出a与水反应的化学方程式:_______ 。
②写出b与二氧化碳反应的化学方程式:_______ 。
③写出c的结构式:_______ 。
(1)A在周期表中的位置是
(2)写出实验室制备F单质的化学反应方程式:
(3)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为
(4)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
②写出b与二氧化碳反应的化学方程式:
③写出c的结构式:
您最近一年使用:0次
9 . 海洋蕴藏着中极为丰富的化学资源,如海水中就有80多种元素,所含的盐大部分是氯化钠。十九世纪末工业上开始通过电解饱和食盐水的方法制备氯气、氨气和烧碱,并以它们为原料生产一系列含氯、含钠产品(氯碱工业),请回答下列问题:
(1)天原化工厂是我国最早的氯碱企业,其创始人是______(单选)
(2)电解饱和食盐水时,与电源正极相连的电极叫阳极,阳极产物是氯气,可以用______ 检验,现象为______ ,写出检验氯气的离子方程式_____________________
(3)工业上用氯气与消石灰制成漂白粉,漂白粉的有效成分为______(单选)
(4)新制氧水呈浅黄绿色,是因为氯水中存在______(单选)
(5)有两组学生根据不同的反应原理在实验室制取氯气。

①请按要求填表。
②有同学建议第一组使用图所示装置作为氯气的发生装置,请谈谈你的看法______ 。
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用如图表示。
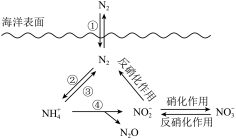
(6)海洋中的氮循环属于固氮作用的一步是______ (填图中的数字序号)。
(7)下列关于海洋氮循环的说法正确的是______(双选)。
(8)有氧时,在硝化细菌作用下, 可实现过程④的转化,方程式如下,请标出该反应的电子转移的方向与数目。
可实现过程④的转化,方程式如下,请标出该反应的电子转移的方向与数目。_______ 。

(9)有人研究了温度对海洋硝化细菌去除氯氮效果的影响.下表为对 人工海水样本的监测数据.硝化细菌去除氨氮的最佳反应温度是
人工海水样本的监测数据.硝化细菌去除氨氮的最佳反应温度是______ ,在最佳反应温度时, 内去除氨氮反应的平均速率是
内去除氨氮反应的平均速率是____  。
。
(1)天原化工厂是我国最早的氯碱企业,其创始人是______(单选)
| A.侯德榜 | B.吴蕴初 | C.荣毅仁 | D.戴安邦 |
(3)工业上用氯气与消石灰制成漂白粉,漂白粉的有效成分为______(单选)
A. | B. | C. | D. |
A. | B. | C. | D. |

①请按要求填表。
实验组 | 实验原理 | 发生装置(填编号) |
第一组 |  | |
第二组 | 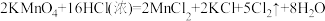 |

氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用如图表示。

(6)海洋中的氮循环属于固氮作用的一步是
(7)下列关于海洋氮循环的说法正确的是______(双选)。
| A.海洋中存在游离态的氮 |
| B.海洋中的氮循环起始于氮的氧化 |
C.向海洋排放含 的废水会影响海洋中 的废水会影响海洋中 的含量 的含量 |
| D.海洋中的反硝化作用一定有氧气的参与 |
 可实现过程④的转化,方程式如下,请标出该反应的电子转移的方向与数目。
可实现过程④的转化,方程式如下,请标出该反应的电子转移的方向与数目。
(9)有人研究了温度对海洋硝化细菌去除氯氮效果的影响.下表为对
 人工海水样本的监测数据.硝化细菌去除氨氮的最佳反应温度是
人工海水样本的监测数据.硝化细菌去除氨氮的最佳反应温度是 内去除氨氮反应的平均速率是
内去除氨氮反应的平均速率是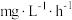 。
。温度/ | 样本氨氮含量/ | 处理 | 处理 |
氨氮含量/ | 氨氮含量/ | ||
20 | 1008 | 838 | 788 |
25 | 1008 | 757 | 468 |
30 | 1008 | 798 | 600 |
40 | 1008 | 977 | 910 |
您最近一年使用:0次
名校
10 . 生活中用自来水养金鱼时,需将自来水先在阳光下暴晒一段时间的主要目的是
| A.分解除去次氯酸 | B.紫外线杀菌消毒 | C.增加水中 含量 含量 | D.提高水的温度 |
您最近一年使用:0次






