解题方法
1 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)实验室制Cl2的反应中,浓盐酸所起的作用有_______ (填序号)。
①氧化性 ②还原性 ③碱性 ④酸性
(2)“84消毒液”的有效成分是NaClO,可由Cl2与NaOH溶液反应得到,其离子方程式为_______ (用离子方程式表示,)。
(3)在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:
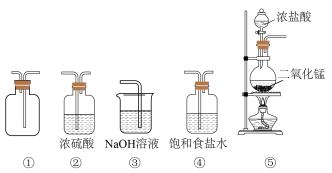
A.上述仪器的正确顺序(用序号表示):_______ ;
B.②装置中,浓硫酸的作用是_______ ;
C.⑤装置中发生反应的离子方程式为:_______ 。
(1)实验室制Cl2的反应中,浓盐酸所起的作用有
①氧化性 ②还原性 ③碱性 ④酸性
(2)“84消毒液”的有效成分是NaClO,可由Cl2与NaOH溶液反应得到,其离子方程式为
(3)在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:

A.上述仪器的正确顺序(用序号表示):
B.②装置中,浓硫酸的作用是
C.⑤装置中发生反应的离子方程式为:
您最近一年使用:0次
2023-02-10更新
|
62次组卷
|
2卷引用:新疆可克达拉镇江高级中学2022-2023学年高一上学期期中考试化学试题
名校
解题方法
2 . 瑞典化学家舍勒是最早发现氯气的人,他在研究软锰矿矿石(主要成分是二氧化锰)时,把浓盐酸和软锰矿矿石混合加热,意外地得到了氯气。至今,实验室中还用这种方法制取氯气,装置如图所示,化学反应方程式为: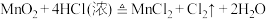
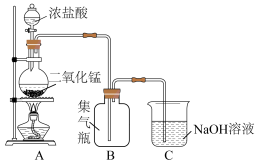
回答下列问题:
(1)实验室制取 的反应中,浓盐酸表现
的反应中,浓盐酸表现_________ (填“氧化性”、“还原性”或“酸性”)。
(2)请用单线桥表示该反应中电子转移的方向和数目_________ 。
(3)标况下,若生成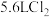 ,则转移电子的数目为
,则转移电子的数目为_________ 。
(4)装置C可吸收多余的 ,生成
,生成 和
和 ,写出离子方程式
,写出离子方程式_________ 。所用 溶液一般为
溶液一般为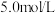 ,用
,用 固体配制
固体配制 该溶液,需要用到的仪器有托盘天平、烧杯、玻璃棒、胶头滴管、
该溶液,需要用到的仪器有托盘天平、烧杯、玻璃棒、胶头滴管、_________ 。
(5) 有强氧化性,某实验小组为探究
有强氧化性,某实验小组为探究 、
、 、
、 在酸性条件下的氧化性强弱,设计实验如下:实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;实验②:向实验①的溶液中加入少量亚硫酸钠溶液,蓝色又褪去。以上实验说明,在酸性条件下
在酸性条件下的氧化性强弱,设计实验如下:实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;实验②:向实验①的溶液中加入少量亚硫酸钠溶液,蓝色又褪去。以上实验说明,在酸性条件下 、
、 、
、 的氧化性由弱到强的顺序是
的氧化性由弱到强的顺序是_________ 。
(6)装置C中也可能生成 ,
, 和浓盐酸也可以制备
和浓盐酸也可以制备 ,试写出离子方程式
,试写出离子方程式_________ 。
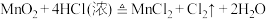

回答下列问题:
(1)实验室制取
 的反应中,浓盐酸表现
的反应中,浓盐酸表现(2)请用单线桥表示该反应中电子转移的方向和数目
(3)标况下,若生成
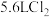 ,则转移电子的数目为
,则转移电子的数目为(4)装置C可吸收多余的
 ,生成
,生成 和
和 ,写出离子方程式
,写出离子方程式 溶液一般为
溶液一般为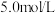 ,用
,用 固体配制
固体配制 该溶液,需要用到的仪器有托盘天平、烧杯、玻璃棒、胶头滴管、
该溶液,需要用到的仪器有托盘天平、烧杯、玻璃棒、胶头滴管、(5)
 有强氧化性,某实验小组为探究
有强氧化性,某实验小组为探究 、
、 、
、 在酸性条件下的氧化性强弱,设计实验如下:实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;实验②:向实验①的溶液中加入少量亚硫酸钠溶液,蓝色又褪去。以上实验说明,在酸性条件下
在酸性条件下的氧化性强弱,设计实验如下:实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;实验②:向实验①的溶液中加入少量亚硫酸钠溶液,蓝色又褪去。以上实验说明,在酸性条件下 、
、 、
、 的氧化性由弱到强的顺序是
的氧化性由弱到强的顺序是(6)装置C中也可能生成
 ,
, 和浓盐酸也可以制备
和浓盐酸也可以制备 ,试写出离子方程式
,试写出离子方程式
您最近一年使用:0次
3 . 工业上以晒盐后的卤水为原料进行提溴,主要流程如下:
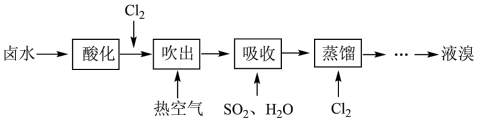
(1)卤水呈碱性,在通入Cl2先需先酸化,原因是___________ 。
(2)向酸化后的卤水中通入Cl2时发生反应的离子方程式为___________ 。
(3)已知吸收反应的化学方程式为:SO2+Br2+2H2O=H2SO4+2HBr
①设立“吸收”步骤的目的是___________ 。
②由该反应可知关于物质氧化性和还原性比较正确的是___________ 。
A.氧化性:Br2>H2SO4 B.还原性:SO2>H2SO4
C.氧化性:Br2>HBr D.还原性:HBr>H2SO4
③有人提出“吸收”步骤也可以用有机溶剂,下列有机溶剂适用的是___________ 。
A.苯 B.四氯化碳 C.植物油 D.酒精
(4)蒸馏时应控制温度不超过100℃,原因是___________ 。
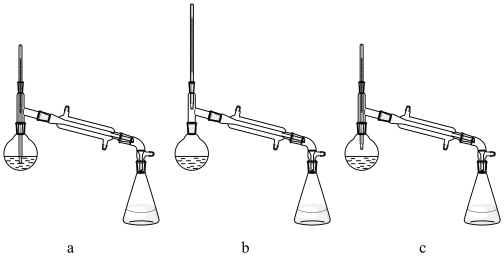
(5)下图的实验室蒸馏操作中,仪器选择及安装都正确的是___________ 。
(6)经该方法处理后,1m3海水最终得到38.4gBr2,若总提取率为60%,则原海水中溴离子的浓度是___________ mmol/L (毫摩尔/L)。

(1)卤水呈碱性,在通入Cl2先需先酸化,原因是
(2)向酸化后的卤水中通入Cl2时发生反应的离子方程式为
(3)已知吸收反应的化学方程式为:SO2+Br2+2H2O=H2SO4+2HBr
①设立“吸收”步骤的目的是
②由该反应可知关于物质氧化性和还原性比较正确的是
A.氧化性:Br2>H2SO4 B.还原性:SO2>H2SO4
C.氧化性:Br2>HBr D.还原性:HBr>H2SO4
③有人提出“吸收”步骤也可以用有机溶剂,下列有机溶剂适用的是
A.苯 B.四氯化碳 C.植物油 D.酒精
(4)蒸馏时应控制温度不超过100℃,原因是
(5)下图的实验室蒸馏操作中,仪器选择及安装都正确的是

(6)经该方法处理后,1m3海水最终得到38.4gBr2,若总提取率为60%,则原海水中溴离子的浓度是
您最近一年使用:0次
解题方法
4 . 实验室要制取一瓶纯净干燥的氯气。现有如图所示仪器和药品可供使用:

(1)实验室制取氯气的原理:
其中HCl所表现的性质是
(2)接上述仪器的正确顺序是 。
| A.ABCEFGHD | B.ABCFEGHD | C.AFEBCGHD | D.AFEBCHGD |
A.除去氯气中的水蒸气 B.除去氯气中的氯化氢
C.尾气吸收 D.收集氯气
您最近一年使用:0次
2022-12-07更新
|
329次组卷
|
2卷引用:黑龙江省海林林业局第一中学2021-2022学年高一上学期第二次月考化学试题
名校
解题方法
5 . 某实验小组利用微型实验装置进行氯气的制备和性质探究,装置如图所示,下列有关说法错误的是
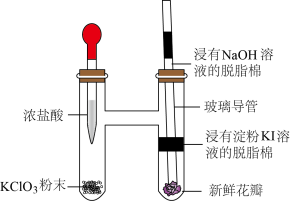
A. 与浓盐酸反应,HCl只体现还原性 与浓盐酸反应,HCl只体现还原性 |
B.浸有淀粉KI溶液的脱脂棉变蓝,说明氧化性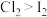 |
| C.新鲜花瓣褪色是因为氯气与水反应生成的HClO有漂白性 |
| D.浸有NaOH溶液的脱脂棉可吸收过量氯气 |
您最近一年使用:0次
2023-04-27更新
|
704次组卷
|
3卷引用:广东省大湾区2023届普通高中毕业班下学期联合模拟考试(二)化学试题
6 . 某小组同学制备并验证 的性质。装置如下图所示,培养皿中A、B、C三个塑料瓶盖内盛有不同物质。向
的性质。装置如下图所示,培养皿中A、B、C三个塑料瓶盖内盛有不同物质。向 固体上滴加浓盐酸,迅速用玻璃片将培养皿盖严。
固体上滴加浓盐酸,迅速用玻璃片将培养皿盖严。
(1)该实验利用了 的
的_______ (填“氧化性”或“还原性”)。
(2)瓶盖A中证明 的氧化性强于
的氧化性强于 的实验现象是
的实验现象是_______ 。
(3)瓶盖B中的 试纸先变红后褪色,试纸褪色的原因是
试纸先变红后褪色,试纸褪色的原因是_______ 。
(4)瓶盖C中的 溶液可吸收
溶液可吸收 ,反应的化学方程式为
,反应的化学方程式为_______ 。
 的性质。装置如下图所示,培养皿中A、B、C三个塑料瓶盖内盛有不同物质。向
的性质。装置如下图所示,培养皿中A、B、C三个塑料瓶盖内盛有不同物质。向 固体上滴加浓盐酸,迅速用玻璃片将培养皿盖严。
固体上滴加浓盐酸,迅速用玻璃片将培养皿盖严。| 实验装置 | 瓶盖 | 物质 |
 | A | 湿润的淀粉 试纸 试纸 |
| B | 湿润的 试纸 试纸 | |
| C | 蘸有 溶液的棉花 溶液的棉花 |
(1)该实验利用了
 的
的(2)瓶盖A中证明
 的氧化性强于
的氧化性强于 的实验现象是
的实验现象是(3)瓶盖B中的
 试纸先变红后褪色,试纸褪色的原因是
试纸先变红后褪色,试纸褪色的原因是(4)瓶盖C中的
 溶液可吸收
溶液可吸收 ,反应的化学方程式为
,反应的化学方程式为
您最近一年使用:0次
名校
7 . 下列对客观事实的解析不正确的是
| 选项 | 客观事实 | 解析 |
| A | 用84消毒液(含NaClO)能杀灭细菌 | NaClO有氧化性 |
| B | SO2能使酸性高锰酸钾溶液褪色 | SO2有还原性 |
| C | 镀锌铁皮的镀层破损后,仍具有防护功能 | 金属活动性:Zn>Fe |
| D | HF的热稳定性大于HCl | HF分子间能形成氢键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-26更新
|
209次组卷
|
2卷引用:广东省广州市2022-2023学年高三上学期11月调研测试化学试题
8 . “新冠”疫情期间,人们广泛使用“84消毒液”进行环境消毒。某品牌“84消毒液”张贴标签如图所示。
回答下列问题:
(1)NaClO(次氯酸钠)中Cl元素的化合价是___________ 。“84消毒液”进行环境消毒时利用了NaClO的___________ (填“氧化性”或“还原性”)。
(2)一瓶该品牌“84消毒液”中含NaClO_______ g,NaCIO的物质的量浓度为________ mol·L-1(计算结果保留2位有效数字)。
(3)配制500 mL0.1 mol·L-1 NaClO 溶液。
①转移溶液时用到的玻璃仪器有:500 mL容量瓶、___________
②配制过程中,下列操作会导致所配溶液浓度偏小的是___________ (填字母序号)。
A.容量瓶内有少量蒸馏水
B.移液时,液体不慎撒到容量瓶外
C.洗涤液未转移至容量瓶中
D.定容时俯视刻度线
(4)常温下,可将Cl2通入NaOH 溶液来制取“84消毒液”。Cl2与NaOH溶液反应生成NaClO和一种常见的盐,该反应的化学方程式是___________ 。
84消毒液 【有效成分】NaClO 【规格】750mL 【质量分数】25% 【密度】1.2g/cm3 |
(1)NaClO(次氯酸钠)中Cl元素的化合价是
(2)一瓶该品牌“84消毒液”中含NaClO
(3)配制500 mL0.1 mol·L-1 NaClO 溶液。
①转移溶液时用到的玻璃仪器有:500 mL容量瓶、
②配制过程中,下列操作会导致所配溶液浓度偏小的是
A.容量瓶内有少量蒸馏水
B.移液时,液体不慎撒到容量瓶外
C.洗涤液未转移至容量瓶中
D.定容时俯视刻度线
(4)常温下,可将Cl2通入NaOH 溶液来制取“84消毒液”。Cl2与NaOH溶液反应生成NaClO和一种常见的盐,该反应的化学方程式是
您最近一年使用:0次
解题方法
9 . 高铁酸钠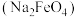 是一种绿色杀菌消毒剂,可用于饮用水处理。某实验小组用如图装置(夹持仪器略)制备
是一种绿色杀菌消毒剂,可用于饮用水处理。某实验小组用如图装置(夹持仪器略)制备 溶液,再用制得的
溶液,再用制得的 溶液在碱性条件下与
溶液在碱性条件下与 溶液反应制备
溶液反应制备 ,原理
,原理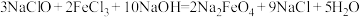 。
。
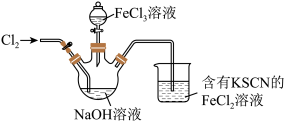
回答下列问题:
(1) 中铁元素的化合价为
中铁元素的化合价为_______ ,其杀菌作用是基于它具有_______ 性。
(2)用双线桥法标出反应 的电子转移方向及数目
的电子转移方向及数目_______ ,根据该制备原理可知氧化性
_______  (填“>”或“<”)。
(填“>”或“<”)。
(3)当烧杯中出现_______ 现象时,说明通入的氯气已经过量。
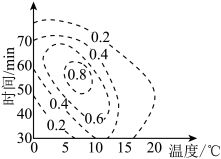
(4) 的理论产率与合成条件相应曲面投影的关系如图(虚线上的数据表示
的理论产率与合成条件相应曲面投影的关系如图(虚线上的数据表示 的理论产率),则制备
的理论产率),则制备 的最适宜的条件范围是
的最适宜的条件范围是_______ 。
(5)制备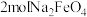 ,至少需要标准状况下的氯气
,至少需要标准状况下的氯气_______ L。
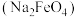 是一种绿色杀菌消毒剂,可用于饮用水处理。某实验小组用如图装置(夹持仪器略)制备
是一种绿色杀菌消毒剂,可用于饮用水处理。某实验小组用如图装置(夹持仪器略)制备 溶液,再用制得的
溶液,再用制得的 溶液在碱性条件下与
溶液在碱性条件下与 溶液反应制备
溶液反应制备 ,原理
,原理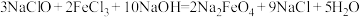 。
。
回答下列问题:
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)用双线桥法标出反应
 的电子转移方向及数目
的电子转移方向及数目
 (填“>”或“<”)。
(填“>”或“<”)。(3)当烧杯中出现
(4)
 的理论产率与合成条件相应曲面投影的关系如图(虚线上的数据表示
的理论产率与合成条件相应曲面投影的关系如图(虚线上的数据表示 的理论产率),则制备
的理论产率),则制备 的最适宜的条件范围是
的最适宜的条件范围是
(5)制备
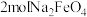 ,至少需要标准状况下的氯气
,至少需要标准状况下的氯气
您最近一年使用:0次
名校
解题方法
10 . Ⅰ.新型冠状病毒肺炎疫情在全球多地爆发,“84消毒液”是大规模环境消毒剂。已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
(1)下列说法不正确的是_________
(2)该“84消毒液”的物质的量浓度约为_______  。(保留一位小数)
。(保留一位小数)
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。回答下列问题。
①配制一定物质的量浓度的上述消毒液需要选用如图所示的部分仪器,还需要的玻璃仪器是_______ (填仪器名称)
②若需配置质量分数为20%的NaClO消毒液,除需要托盘天平、药匙、玻璃棒、烧杯、胶头滴管外,还缺少的仪器是_______ 。
(4)请将下列各操作按正确的顺序将字母代号填写在横线上_______ 。
A.用托盘天平称取NaClO固体
B.塞好瓶塞,反复颠倒摇匀,装瓶,贴标签
C.加蒸馏水至离容量瓶瓶颈刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至刻度线
D.用适量蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液一并转入容量瓶,并轻摇容量瓶使其混匀
E.待溶液冷却至室温,再将溶液转入容量瓶
F.将已称量的NaClO固体置于烧杯中,加适量蒸馏水溶解完全
(5)若所配制的次氯酸钠溶液的物质的量浓度偏小,则下列可能的原因分析中正确的是_______。
Ⅱ.回答下列问题
(6) 常温下为黄色气体,易溶于水,其水溶液类似于NaClO具强氧化性,故也可作为一种广谱杀菌剂。一种有效成分为
常温下为黄色气体,易溶于水,其水溶液类似于NaClO具强氧化性,故也可作为一种广谱杀菌剂。一种有效成分为 、
、 、
、 的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到
的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到 溶液。上述过程中,生成
溶液。上述过程中,生成 的反应属于歧化反应,
的反应属于歧化反应, 在酸性条件下生成的另外一种含氯物质为NaCl,则每消耗1mol
在酸性条件下生成的另外一种含氯物质为NaCl,则每消耗1mol ,生成的
,生成的 分子数为
分子数为_______ ;产生“气泡”的化学方程式为_______ 。
(7)某工厂将氯气通入到40%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为_______ kg(保留整数)。
| 84消毒液 (有效成分)NaClO (规格)1000mL (质量分数)25% (密度) 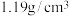 |
| A.“84消毒液的有效成分是NaClO |
| B.“洁厕灵”(主要成分为盐酸)与“84消毒液”混用效果更好 |
C.检验该消毒液中是否含有 的原理为: 的原理为: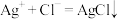 |
| D.盛装“84消毒液”的瓶子瓶盖忘盖,长时间后可能失效 |
 。(保留一位小数)
。(保留一位小数)(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。回答下列问题。
①配制一定物质的量浓度的上述消毒液需要选用如图所示的部分仪器,还需要的玻璃仪器是

②若需配置质量分数为20%的NaClO消毒液,除需要托盘天平、药匙、玻璃棒、烧杯、胶头滴管外,还缺少的仪器是
(4)请将下列各操作按正确的顺序将字母代号填写在横线上
A.用托盘天平称取NaClO固体
B.塞好瓶塞,反复颠倒摇匀,装瓶,贴标签
C.加蒸馏水至离容量瓶瓶颈刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至刻度线
D.用适量蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液一并转入容量瓶,并轻摇容量瓶使其混匀
E.待溶液冷却至室温,再将溶液转入容量瓶
F.将已称量的NaClO固体置于烧杯中,加适量蒸馏水溶解完全
(5)若所配制的次氯酸钠溶液的物质的量浓度偏小,则下列可能的原因分析中正确的是_______。
| A.配制前,容量瓶中有少量蒸馏水 |
| B.洗涤液未转移到容量瓶中 |
| C.未经冷却立即转液 |
| D.定容时,仰视溶液的凹液面 |
Ⅱ.回答下列问题
(6)
 常温下为黄色气体,易溶于水,其水溶液类似于NaClO具强氧化性,故也可作为一种广谱杀菌剂。一种有效成分为
常温下为黄色气体,易溶于水,其水溶液类似于NaClO具强氧化性,故也可作为一种广谱杀菌剂。一种有效成分为 、
、 、
、 的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到
的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到 溶液。上述过程中,生成
溶液。上述过程中,生成 的反应属于歧化反应,
的反应属于歧化反应, 在酸性条件下生成的另外一种含氯物质为NaCl,则每消耗1mol
在酸性条件下生成的另外一种含氯物质为NaCl,则每消耗1mol ,生成的
,生成的 分子数为
分子数为(7)某工厂将氯气通入到40%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为
您最近一年使用:0次



