名校
1 . 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
已知:①K2FeO4为紫色固体,微溶于KOH溶液
②在碱性条件下,次氯酸盐(MClO)可将Fe(OH)3氧化成高铁酸盐(M2FeO4)。
④K2FeO4具有强氧化性,在酸性或中性溶液中迅速产生O2,在碱性溶液中较稳定。某学习小组设计了下面的实验制备K2FeO4并探究其性质。
(1)K2FeO4的制备
该小组用如图所示装置制备K2FeO4(夹持装置路)。
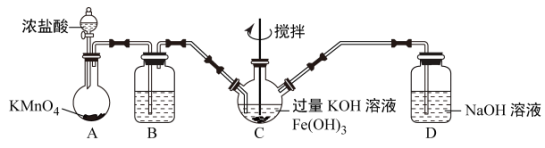
①K2FeO4中铁元素的化合价为___ 价。
②以上装置图中有一处明显的错误请你帮助指出来:___ 。
③A装置作用是产生黄绿色氯气(Cl2),写出A中发生反应的离子方程式__ 。
④C中发生的反应有Cl2+2KOH=KCl+KClO+H2O,还有生成K2FeO4的反应。写出得到K2FeO4的化学方程式为___ 。
(2)性质探究
用KOH溶液充分洗涤C中所得固体得到固体物质K2FeO4
①絮凝实验:甲同学取少量K2FeO4加入浑的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。查阅资料此时发生反应的离子方程式为:4FeO +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:
+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:___ 。
②乙同学取少量K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体。产生黄绿色气体的原因可能是___ 。(用文字描述)
已知:①K2FeO4为紫色固体,微溶于KOH溶液
②在碱性条件下,次氯酸盐(MClO)可将Fe(OH)3氧化成高铁酸盐(M2FeO4)。
④K2FeO4具有强氧化性,在酸性或中性溶液中迅速产生O2,在碱性溶液中较稳定。某学习小组设计了下面的实验制备K2FeO4并探究其性质。
(1)K2FeO4的制备
该小组用如图所示装置制备K2FeO4(夹持装置路)。

①K2FeO4中铁元素的化合价为
②以上装置图中有一处明显的错误请你帮助指出来:
③A装置作用是产生黄绿色氯气(Cl2),写出A中发生反应的离子方程式
④C中发生的反应有Cl2+2KOH=KCl+KClO+H2O,还有生成K2FeO4的反应。写出得到K2FeO4的化学方程式为
(2)性质探究
用KOH溶液充分洗涤C中所得固体得到固体物质K2FeO4
①絮凝实验:甲同学取少量K2FeO4加入浑的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。查阅资料此时发生反应的离子方程式为:4FeO
 +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:
+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:②乙同学取少量K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体。产生黄绿色气体的原因可能是
您最近一年使用:0次
2021-09-17更新
|
322次组卷
|
2卷引用:江苏省南京市第二十九中学2020-2021学年高一上学期10月月考化学试卷
名校
2 . 高铁酸钾 是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知:
是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知: 为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生
为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生 :
:
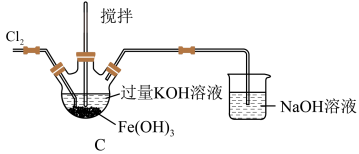
(1)C中得到紫色固体和溶液,写出得到紫色固体的化学方程式为___________ (并用双线桥表示电子转移),C中 发生的反应还有
发生的反应还有___________ 。(用离子方程式表示)
(2)探究 的性质
的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计如下方案:
,设计如下方案:
方案一:取少量a,经测定含有
方案二:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将 溶出,得到紫色溶液b。取少量b,滴加盐酸,有
溶出,得到紫色溶液b。取少量b,滴加盐酸,有 产生。
产生。
①由方案一中可知a中含有 ,但该离子的产生不能判断一定是
,但该离子的产生不能判断一定是 将
将 氧化所得,还可能由
氧化所得,还可能由___________ 产生(文字描述)。
②方案二中要用KOH溶液充分洗涤所得固体的原因是___________ 。
③根据 的制备实验得出:氧化性
的制备实验得出:氧化性 大于
大于 ,而方案二实验中
,而方案二实验中 和
和 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是___________ 。
(3)高铁酸钾水处理原理如图所示。
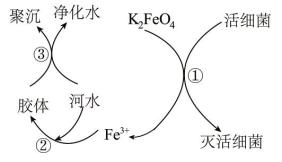
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
①过程①中活细菌表现了___________ (填“氧化”或“还原”)性,该过程的还原产物是___________ (填离子符号);过程③属于___________ (填“物理”或“化学”)变化。
②根据上述原理分析,作水处理剂时, 的作用有
的作用有___________ 。(填两个)
 是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知:
是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知: 为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生
为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生 :
:
(1)C中得到紫色固体和溶液,写出得到紫色固体的化学方程式为
 发生的反应还有
发生的反应还有(2)探究
 的性质
的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计如下方案:
,设计如下方案:方案一:取少量a,经测定含有

方案二:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将
 溶出,得到紫色溶液b。取少量b,滴加盐酸,有
溶出,得到紫色溶液b。取少量b,滴加盐酸,有 产生。
产生。①由方案一中可知a中含有
 ,但该离子的产生不能判断一定是
,但该离子的产生不能判断一定是 将
将 氧化所得,还可能由
氧化所得,还可能由②方案二中要用KOH溶液充分洗涤所得固体的原因是
③根据
 的制备实验得出:氧化性
的制备实验得出:氧化性 大于
大于 ,而方案二实验中
,而方案二实验中 和
和 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是(3)高铁酸钾水处理原理如图所示。

【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
①过程①中活细菌表现了
②根据上述原理分析,作水处理剂时,
 的作用有
的作用有
您最近一年使用:0次
名校
3 . 某小组在实验室用NaClO溶液和NH3反应制备N2H4,并进行相关的性质探究实验。
I.制备N2H4
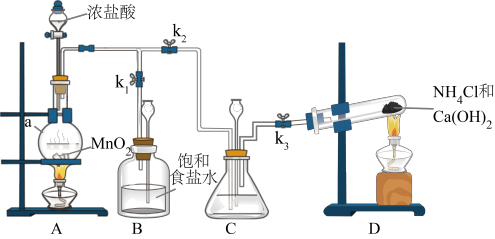
(1)装置C中盛放的试剂是___________ ,其作用是___________ 。(用离子方程式表示)
(2)装置D发生的反应的方程式为___________ 。
(3)制备N2H4的离子方程式为___________ 。
II.探究N2H4的还原性与碱性。将制得的肼分离提纯后,进行如图实验。
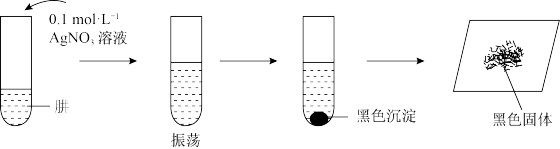
【查阅资料】AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如表方案,进行实验。
(4)请完成表中的空白部分
(5)实验表明,黑色固体主要成分是Ag,还有少量氧化银。请解释原因:___________ 。
I.制备N2H4

(1)装置C中盛放的试剂是
(2)装置D发生的反应的方程式为
(3)制备N2H4的离子方程式为
II.探究N2H4的还原性与碱性。将制得的肼分离提纯后,进行如图实验。

【查阅资料】AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如表方案,进行实验。
(4)请完成表中的空白部分
| 操作 | 现象 | 实验结论 |
| i. 取少量黑色固体于试管中,加入适量 | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ii. 取少量黑色固体于试管中加入足量稀硝酸,振荡。 | 黑色固体是Ag和Ag2O |
您最近一年使用:0次
4 . 利用下图,可以从不同角度研究含氯物质的性质及其转化关系,图中甲~辛均含氯元素。回答下列问题:

(1)丙的化学式为_______ ;从组成和性质上分析,丁属于_______ (填“酸性”或“碱性”)氧化物。
(2)图中甲、乙、丁、戊中,属于电解质的是__________ (填化学式);根据氯元素的化合价判断,乙物质__________ 。
a 只有氧化性 b 既有氧化性又有还原性
c 只有还原性 d 既能做氧化剂也能做还原剂
(3)电解甲溶液制备己的化学反应为:甲+ H2O→己+H2↑,反应中甲与H2O的物质的量之比是______ 。
(4)庚是漂白粉的有效成分,用乙制取庚的化学反应方程式为_________ 。
(5)辛在MnO2催化下受热分解可用于制备一种常见气体,这种气体的化学式是____ 。

(1)丙的化学式为
(2)图中甲、乙、丁、戊中,属于电解质的是
a 只有氧化性 b 既有氧化性又有还原性
c 只有还原性 d 既能做氧化剂也能做还原剂
(3)电解甲溶液制备己的化学反应为:甲+ H2O→己+H2↑,反应中甲与H2O的物质的量之比是
(4)庚是漂白粉的有效成分,用乙制取庚的化学反应方程式为
(5)辛在MnO2催化下受热分解可用于制备一种常见气体,这种气体的化学式是
您最近一年使用:0次
2020-03-15更新
|
265次组卷
|
4卷引用:山东省淄博市2019-2020学年高一上学期期末质量检测化学试题
山东省淄博市2019-2020学年高一上学期期末质量检测化学试题(已下线)【浙江新东方】【2020】【高一上】【期中】【HD-LP409】【化学】(已下线)【浙江新东方】72云南省大理州祥云县2019-2020学年高一下学期期末统测化学试题
名校
5 . 某小组在实验室先制备NaClO溶液,再通入 反应制备
反应制备 (肼),并进行相关的性质探究实验。
(肼),并进行相关的性质探究实验。
I.制备
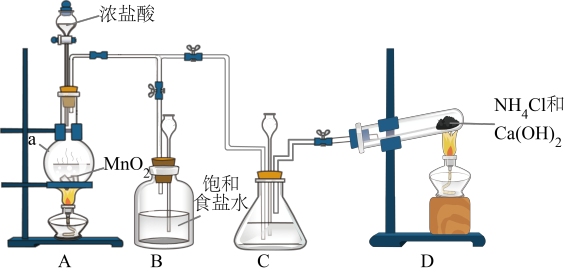
(1)仪器a的名称是___________ 。
(2)装置C中盛放的试剂是___________ 。
(3)装置D发生的化学反应方程式为___________ 。
(4)制备 的离子方程式为
的离子方程式为___________ 。
II.探究 (肼)的还原性与碱性。将制得的肼分离提纯后,进行如图实验。
(肼)的还原性与碱性。将制得的肼分离提纯后,进行如图实验。
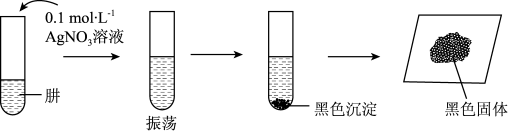
【查阅资料】AgOH在溶液中不稳定,易分解生成黑色的 ,
, 可溶于氨水。
可溶于氨水。
【提出假设】黑色固体可能是Ag、 中的一种或两种。
中的一种或两种。
【实验验证】设计如下方案,进行实验。
(5)请完成表中的空白部分
(6)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因: ___________ 。
 反应制备
反应制备 (肼),并进行相关的性质探究实验。
(肼),并进行相关的性质探究实验。I.制备


(1)仪器a的名称是
(2)装置C中盛放的试剂是
(3)装置D发生的化学反应方程式为
(4)制备
 的离子方程式为
的离子方程式为II.探究
 (肼)的还原性与碱性。将制得的肼分离提纯后,进行如图实验。
(肼)的还原性与碱性。将制得的肼分离提纯后,进行如图实验。
【查阅资料】AgOH在溶液中不稳定,易分解生成黑色的
 ,
, 可溶于氨水。
可溶于氨水。【提出假设】黑色固体可能是Ag、
 中的一种或两种。
中的一种或两种。【实验验证】设计如下方案,进行实验。
(5)请完成表中的空白部分
| 操作 | 现象 | 实验结论 |
| i.取少量黑色固体于试管中,加入适量① | 黑色固体部分溶解 | 黑色固体有 |
| ii.取少量黑色固体于试管中加入足量稀硝酸,振荡 | ② | 黑色固体是Ag和 |
您最近一年使用:0次
名校
解题方法
6 . 某小组利用氯气与NaOH制取NaClO并探究其性质。
已知:①Ag2SO4:白色固体,微溶于水。
②在水中,Fe3+的存在形式有:[Fe(H2O)4(OH)2]+呈黄色;[Fe(H2O)6]3+呈淡紫色,通常只能观察到无色。
I.制备
(1)A中反应的离子方程式是_______ 。
(2)一段时间后,NaOH已完全反应,测得A中溶液pH=10,用化学用语表示其原因:_______ 。
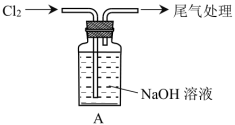
II.探究性质
取I所得A中溶液5mL于试管中,向其中加入稍过量的0.1mol/LFeSO4溶液和适量H2SO4溶液,观察到无沉淀产生,溶液变为黄色。
(3)甲同学对溶液变黄色可能发生的反应提出下列三种猜想:
猜想1:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O
猜想2:2Fe2++2ClO-+4H+=2Fe3++Cl2↑+2H2O
猜想3:Cl-+ClO-+2H+=Cl2↑+H2O
乙同学认为猜想2和3不合理,用离子方程式表示原因_______ 。经证实,猜想1正确。
III.进一步探究
取II中黄色溶液,分为4份,进行下列操作。
(4)实验i的现象是_______ 。
(5)实验ii加入AgNO3出现白色沉淀,不能说明溶液中存在Cl-,原因是_______ 。
(6)资料表明,氧化性:ClO->Br2>Fe3+>I2。甲同学认为由实验iii的现象证明溶液中仍存在ClO-。乙同学认为甲同学的推断不严谨,设计了能确证溶液中是否存在ClO-的实验方案:_______ 。
(7)实验iv中黄色溶液变浅至几乎无色,结合化学用语解释原因_______ 。
已知:①Ag2SO4:白色固体,微溶于水。
②在水中,Fe3+的存在形式有:[Fe(H2O)4(OH)2]+呈黄色;[Fe(H2O)6]3+呈淡紫色,通常只能观察到无色。
I.制备
(1)A中反应的离子方程式是
(2)一段时间后,NaOH已完全反应,测得A中溶液pH=10,用化学用语表示其原因:

II.探究性质
取I所得A中溶液5mL于试管中,向其中加入稍过量的0.1mol/LFeSO4溶液和适量H2SO4溶液,观察到无沉淀产生,溶液变为黄色。
(3)甲同学对溶液变黄色可能发生的反应提出下列三种猜想:
猜想1:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O
猜想2:2Fe2++2ClO-+4H+=2Fe3++Cl2↑+2H2O
猜想3:Cl-+ClO-+2H+=Cl2↑+H2O
乙同学认为猜想2和3不合理,用离子方程式表示原因
III.进一步探究
取II中黄色溶液,分为4份,进行下列操作。
| 序号 | 操作 | 现象 |
| i | 加入NaOH溶液 | |
| ii | 加入AgNO3溶液 | 白色沉淀 |
| iii | 加入NaI溶液,再加入一定量CCl4,振荡 | 下层呈紫红色 |
| iv | 加入一定量H2SO4溶液 | 黄色变浅几乎无色 |
(5)实验ii加入AgNO3出现白色沉淀,不能说明溶液中存在Cl-,原因是
(6)资料表明,氧化性:ClO->Br2>Fe3+>I2。甲同学认为由实验iii的现象证明溶液中仍存在ClO-。乙同学认为甲同学的推断不严谨,设计了能确证溶液中是否存在ClO-的实验方案:
(7)实验iv中黄色溶液变浅至几乎无色,结合化学用语解释原因
您最近一年使用:0次
2021-03-08更新
|
332次组卷
|
3卷引用:北京市昌平区2021届高三上学期期末考试化学试题
7 . 实验小组制备高铁酸钾(K2FeO4) 并探究其性质。
资料: K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4 (夹持装置略)
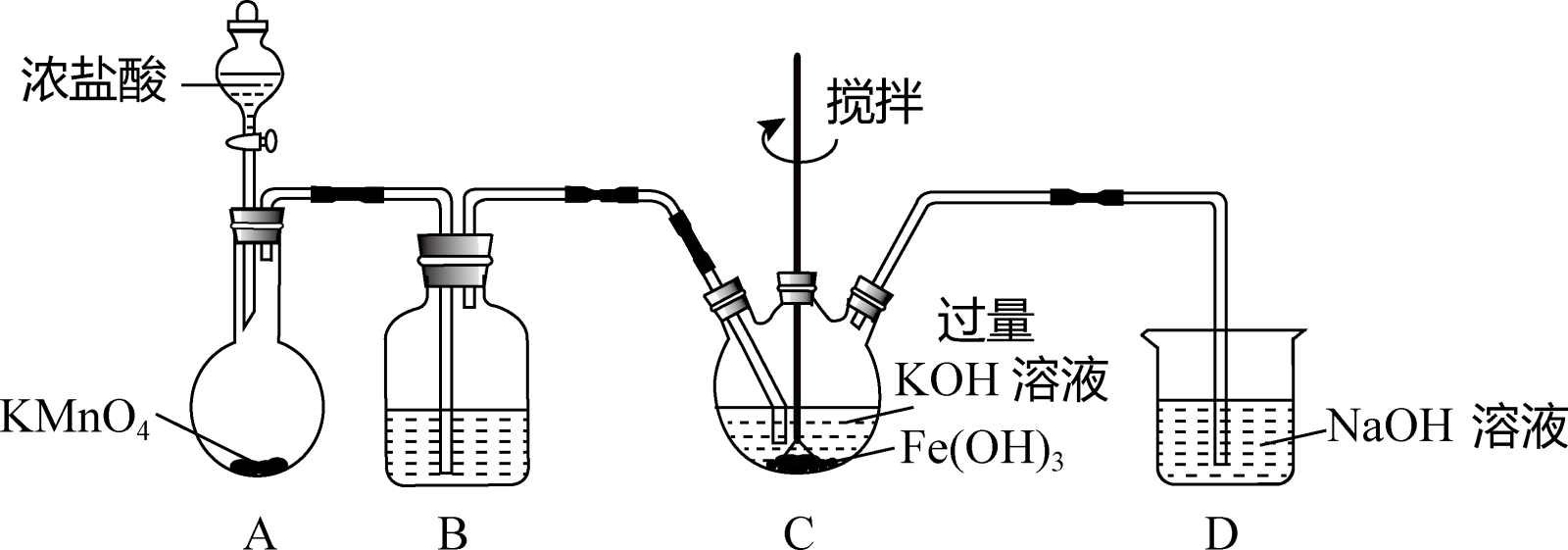
①连接仪器后的必要操作为_______ 。
②A为氯气发生装置。A中化学反应的还原剂是_______ 。
③装置B的作用是除杂,所用试剂为_______ 。
④C中得到紫色固体和溶液。C中的反应有:3Cl2 + 2Fe(OH)3+ 10KOH=2K2FeO4 + 6KCl+ 8H2O。此反应表明:氧化性Cl2_______ FeO (填“>”或“<”);C中除发生③中的反应,还发生反应的离子方程式为
(填“>”或“<”);C中除发生③中的反应,还发生反应的离子方程式为_______ 。
(2)探究K2FeO4的性质。用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液a。取少量a,滴加盐酸,有Cl2产生。
①此实验可证明氧化Cl-的物质只能是FeO 。用KOH溶液洗涤的目的是
。用KOH溶液洗涤的目的是_______ 。
②此实验得出Cl2和FeO 的氧化性强弱关系与制备实验时得出的结论相反,原因是
的氧化性强弱关系与制备实验时得出的结论相反,原因是_______ 。
资料: K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4 (夹持装置略)

①连接仪器后的必要操作为
②A为氯气发生装置。A中化学反应的还原剂是
③装置B的作用是除杂,所用试剂为
④C中得到紫色固体和溶液。C中的反应有:3Cl2 + 2Fe(OH)3+ 10KOH=2K2FeO4 + 6KCl+ 8H2O。此反应表明:氧化性Cl2
 (填“>”或“<”);C中除发生③中的反应,还发生反应的离子方程式为
(填“>”或“<”);C中除发生③中的反应,还发生反应的离子方程式为(2)探究K2FeO4的性质。用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液a。取少量a,滴加盐酸,有Cl2产生。
①此实验可证明氧化Cl-的物质只能是FeO
 。用KOH溶液洗涤的目的是
。用KOH溶液洗涤的目的是②此实验得出Cl2和FeO
 的氧化性强弱关系与制备实验时得出的结论相反,原因是
的氧化性强弱关系与制备实验时得出的结论相反,原因是
您最近一年使用:0次
解题方法
8 . 某研究小组制备氯气并对产生氯气的条件进行探究。
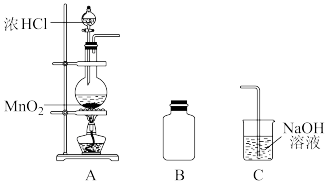
(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的____ (填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是____ 。
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向____ 。
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是____ 。
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。
①已知MnO2呈弱碱性。Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是____ 。
②Ⅱ中发生了分解反应,反应的化学方程式是____ 。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:
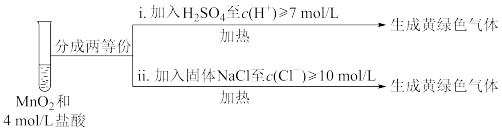
将实验Ⅲ、Ⅳ作对比,得出的结论是____ 。

(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的
(2)A中产生的气体不纯,含有的杂质可能是
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。
| 实验 | 操作 | 现象 |
| Ⅰ | 常温下将MnO2和12mol·L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| Ⅲ | 加热MnO2和4mol·L-1稀盐酸混合物 | 无明显现象 |
②Ⅱ中发生了分解反应,反应的化学方程式是
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:
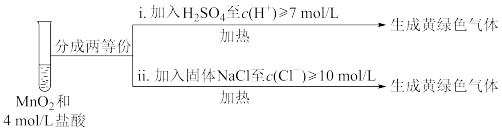
将实验Ⅲ、Ⅳ作对比,得出的结论是
您最近一年使用:0次
名校
解题方法
9 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。
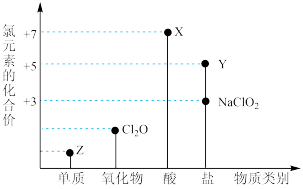
回答下列问题:
(1)X的电离方程式为_________ 。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=_________ 。
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_____________ 。
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的___________ 倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为_____________ 。
(6)自来水中的 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原 ,产物是N2。发生的反应可表示如下,请完成方程式的配平:
,产物是N2。发生的反应可表示如下,请完成方程式的配平:___ Al+ ____  +
+ _____ =___  +
+ _____ N2↑ + _______ H2O

回答下列问题:
(1)X的电离方程式为
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为
(6)自来水中的
 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原 ,产物是N2。发生的反应可表示如下,请完成方程式的配平:
,产物是N2。发生的反应可表示如下,请完成方程式的配平: +
+  +
+
您最近一年使用:0次
2020-06-15更新
|
101次组卷
|
2卷引用:江西省南昌市八一中学2019-2020学年高一下学期期中考试化学试题
10 . 高铁酸钾 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中产生
溶液,具有强氧化性,在酸性或中性溶液中产生 ,在碱性溶液中较稳定.实验室用如图所示装置(夹持仪器已省略)制备
,在碱性溶液中较稳定.实验室用如图所示装置(夹持仪器已省略)制备 。
。

回答下列问题:
(1)仪器a的名称为_______ ,使用前需_______ 。
(2)装置A圆底烧瓶中发生反应的离子方程式为_______ 。
(3)装置B的作用是_______ 。
(4)装置C中发生反应的化学方程式为_______ ,该反应说明在此条件下 的氧化性比
的氧化性比
_______ (填“强”或“弱”),当装置C中得到大量紫色固体时立即停止通入 ,原因是
,原因是_______ 。
(5)装置D可用于吸收多余的 ,吸收液具有
,吸收液具有_______ (填字母)。
a.氧化性 b.还原性 c.漂白性
 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中产生
溶液,具有强氧化性,在酸性或中性溶液中产生 ,在碱性溶液中较稳定.实验室用如图所示装置(夹持仪器已省略)制备
,在碱性溶液中较稳定.实验室用如图所示装置(夹持仪器已省略)制备 。
。
回答下列问题:
(1)仪器a的名称为
(2)装置A圆底烧瓶中发生反应的离子方程式为
(3)装置B的作用是
(4)装置C中发生反应的化学方程式为
 的氧化性比
的氧化性比
 ,原因是
,原因是(5)装置D可用于吸收多余的
 ,吸收液具有
,吸收液具有a.氧化性 b.还原性 c.漂白性
您最近一年使用:0次



