名校
1 . 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
已知:①K2FeO4为紫色固体,微溶于KOH溶液
②在碱性条件下,次氯酸盐(MClO)可将Fe(OH)3氧化成高铁酸盐(M2FeO4)。
④K2FeO4具有强氧化性,在酸性或中性溶液中迅速产生O2,在碱性溶液中较稳定。某学习小组设计了下面的实验制备K2FeO4并探究其性质。
(1)K2FeO4的制备
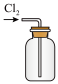
该小组用如图所示装置制备K2FeO4(夹持装置路)。
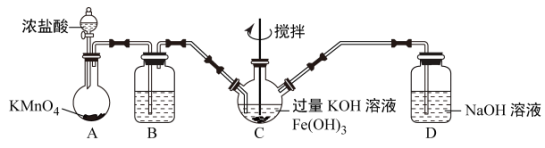
①K2FeO4中铁元素的化合价为___ 价。
②以上装置图中有一处明显的错误请你帮助指出来:___ 。
③A装置作用是产生黄绿色氯气(Cl2),写出A中发生反应的离子方程式__ 。
④C中发生的反应有Cl2+2KOH=KCl+KClO+H2O,还有生成K2FeO4的反应。写出得到K2FeO4的化学方程式为___ 。
(2)性质探究
用KOH溶液充分洗涤C中所得固体得到固体物质K2FeO4
①絮凝实验:甲同学取少量K2FeO4加入浑的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。查阅资料此时发生反应的离子方程式为:4FeO +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:
+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:___ 。
②乙同学取少量K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体。产生黄绿色气体的原因可能是___ 。(用文字描述)
已知:①K2FeO4为紫色固体,微溶于KOH溶液
②在碱性条件下,次氯酸盐(MClO)可将Fe(OH)3氧化成高铁酸盐(M2FeO4)。
④K2FeO4具有强氧化性,在酸性或中性溶液中迅速产生O2,在碱性溶液中较稳定。某学习小组设计了下面的实验制备K2FeO4并探究其性质。
(1)K2FeO4的制备
该小组用如图所示装置制备K2FeO4(夹持装置路)。

①K2FeO4中铁元素的化合价为
②以上装置图中有一处明显的错误请你帮助指出来:
③A装置作用是产生黄绿色氯气(Cl2),写出A中发生反应的离子方程式
④C中发生的反应有Cl2+2KOH=KCl+KClO+H2O,还有生成K2FeO4的反应。写出得到K2FeO4的化学方程式为
(2)性质探究
用KOH溶液充分洗涤C中所得固体得到固体物质K2FeO4
①絮凝实验:甲同学取少量K2FeO4加入浑的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。查阅资料此时发生反应的离子方程式为:4FeO
 +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:
+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:②乙同学取少量K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体。产生黄绿色气体的原因可能是
您最近半年使用:0次
2021-09-17更新
|
322次组卷
|
2卷引用:江苏省南京市第二十九中学2020-2021学年高一上学期10月月考化学试卷
名校
2 . 某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计以下装置进行实验。
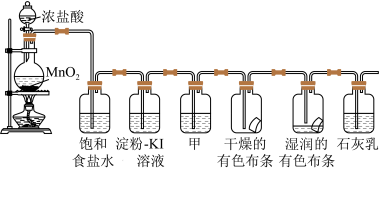
(1)圆底烧瓶内发生的化学方程式为___________ 。在该反应中,被氧化的元素是___________ ,氧化剂与还原剂的物质的量之比为___________ ,比较氧化剂和氧化产物的氧化性大小:___________ ,若产生0.1molCl2,则转移的电子数目为___________ ,该反应中浓盐酸体现了___________ 性质(选填字母编号)。
A.酸性 B.碱性 C.氧化性 D.还原性
(2)饱和食盐水的作用为___________ ,Cl2与石灰乳反应制取漂白粉的化学方程式为___________ 。
(3)若干燥的有色布条不褪色,湿润的有色布条褪色,则甲中盛放___________ (填名称)。
(4)某同学在实验室配制80mL质量分数为36.5%(密度为1.2g/cm3)的浓盐酸溶液用于上述实验。
①该同学应选择___________ mL的容量瓶,配制所得浓盐酸的浓度为___________ mol/L。
②若实验中出现以下情况,对所配溶液的物质的量浓度有何影响? (填“偏高”“偏低”或“无影响”)。容量瓶中原有少量蒸馏水___________ ;定容时俯视容量瓶瓶颈上的刻度线___________ ;向容量瓶中转移溶液时不慎将少量溶液溅出酒在容量瓶外面___________ 。
(5)将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当NaCl和NaClO3的物质的量之比为15:2时反应的离子方程式为___________ 。

(1)圆底烧瓶内发生的化学方程式为
A.酸性 B.碱性 C.氧化性 D.还原性
(2)饱和食盐水的作用为
(3)若干燥的有色布条不褪色,湿润的有色布条褪色,则甲中盛放
(4)某同学在实验室配制80mL质量分数为36.5%(密度为1.2g/cm3)的浓盐酸溶液用于上述实验。
①该同学应选择
②若实验中出现以下情况,对所配溶液的物质的量浓度有何影响? (填“偏高”“偏低”或“无影响”)。容量瓶中原有少量蒸馏水
(5)将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当NaCl和NaClO3的物质的量之比为15:2时反应的离子方程式为
您最近半年使用:0次
名校
3 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。查阅资料显示:
a. 在一定条件下能被
在一定条件下能被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
b.浓碱条件下, 可被
可被 还原为
还原为 。
。
c. 的氧化性与溶液的酸碱性无关,
的氧化性与溶液的酸碱性无关, 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。
d.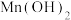 为白色沉淀。实验装置如下图:
为白色沉淀。实验装置如下图:
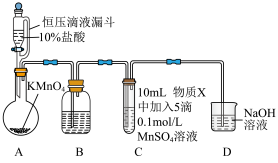
(1)A中发生的反应的化学方程式如下: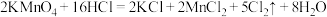 。用双线桥标出该反应中电子转移的方向、得失和数目
。用双线桥标出该反应中电子转移的方向、得失和数目___________ 。
(2)通入 前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为___________ 。
(3)对比实验Ⅰ、Ⅱ通入 后的实验现象,对于
后的实验现象,对于 还原性与溶液酸碱性的认识是
还原性与溶液酸碱性的认识是___________ 。
(4)根据资料b,Ⅲ中应得到绿色溶液,而实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入 导致溶液的碱性减弱。
导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①用离子方程式表示可能导致溶液碱性减弱的原因:___________ 。
②取Ⅲ中放置后的 悬浊液,加入
悬浊液,加入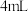 40%
40% 溶液,观察到溶液紫色迅速变为绿色,且有无色无味的气体产生,该气体的化学式为
溶液,观察到溶液紫色迅速变为绿色,且有无色无味的气体产生,该气体的化学式为___________ 。同时还可观察到溶液的绿色缓慢加深,即可证明Ⅲ的悬浊液中氧化剂过量。
a.
 在一定条件下能被
在一定条件下能被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。b.浓碱条件下,
 可被
可被 还原为
还原为 。
。c.
 的氧化性与溶液的酸碱性无关,
的氧化性与溶液的酸碱性无关, 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。d.
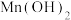 为白色沉淀。实验装置如下图:
为白色沉淀。实验装置如下图:
| 序号 | 物质X | C中实验现象 | |
通入 前 前 | 通入 后 后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5% 溶液 溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40% 溶液 溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(1)A中发生的反应的化学方程式如下:
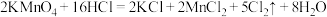 。用双线桥标出该反应中电子转移的方向、得失和数目
。用双线桥标出该反应中电子转移的方向、得失和数目(2)通入
 前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为(3)对比实验Ⅰ、Ⅱ通入
 后的实验现象,对于
后的实验现象,对于 还原性与溶液酸碱性的认识是
还原性与溶液酸碱性的认识是(4)根据资料b,Ⅲ中应得到绿色溶液,而实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入
 导致溶液的碱性减弱。
导致溶液的碱性减弱。原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①用离子方程式表示可能导致溶液碱性减弱的原因:
②取Ⅲ中放置后的
 悬浊液,加入
悬浊液,加入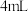 40%
40% 溶液,观察到溶液紫色迅速变为绿色,且有无色无味的气体产生,该气体的化学式为
溶液,观察到溶液紫色迅速变为绿色,且有无色无味的气体产生,该气体的化学式为
您最近半年使用:0次
2023-12-11更新
|
58次组卷
|
2卷引用:福建省厦门大学附属科技中学2023-2024学年高一上学期11月期中考试化学试题
解题方法
4 . 氯气是一种重要的化工原料,大量用于制造盐酸、漂白剂、农药、染料和药品等。
(1)1774年,瑞典化学家舍勒将浓盐酸与软锰矿(主要成分为 )混合加热,发现了氯气。下图为实验室制取Cl2的装置,请回答:
)混合加热,发现了氯气。下图为实验室制取Cl2的装置,请回答:
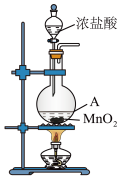
盛放浓盐酸的仪器名称是_______ 。
(2)下图所示制取氯气的净化、收集、尾气处理的装置能达到实验目的的是_______ 。(填序号)
(3)已知:常温下用 和市售浓盐酸(11.9
和市售浓盐酸(11.9 )反应制取Cl2难以进行。但若用漂白粉(有效成分
)反应制取Cl2难以进行。但若用漂白粉(有效成分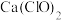 )、高锰酸钾等与浓盐酸反应,常温下很容易制取Cl2。
)、高锰酸钾等与浓盐酸反应,常温下很容易制取Cl2。
①已知,如图装置A是氯气的发生装置。加入适量的浓盐酸充分反应有黄绿色气体生成,写出发生反应的化学方程式,并用单线桥标明电子转移的方向和数目 :_______ 。

②装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅲ处应放入的是_______ (填序号)。
a.干燥的有色布条 b.湿润的有色布条 c.湿润的淀粉 试纸
试纸
装置C的Ⅱ处的试剂是_______ (填序号)。
a.碱石灰(氢氧化钠和氧化钙的固体混合物) b.无水氯化钙 c.浓硫酸
③装置D中一般不用 澄清石灰水吸收多余的氯气。理由是_______ 。
(4)84消毒液是一种常见的含氯消毒剂,其有效成分为次氯酸钠。
资料:84消毒液中含氯微粒主要有 、
、 、
、 ;相同浓度时,
;相同浓度时, 的氧化性强于
的氧化性强于 ;
;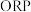 是反映水溶液中所有物质表现出来的氧化—还原性,
是反映水溶液中所有物质表现出来的氧化—还原性,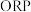 值越大,氧化性越强。
值越大,氧化性越强。
某兴趣小组同学研究84消毒液的漂白性,实验如下。
I.向2 84消毒液中加入2
84消毒液中加入2 水后,放入红色纸片,观察到纸片慢慢褪色。
水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向2 84消毒液中加入2
84消毒液中加入2 白醋后,放入红色纸片,观察到纸片迅速褪色。
白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.测得84消毒液在不同温度时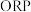 随时间的变化曲线如
随时间的变化曲线如图 。
①已知白醋显酸性,不具有漂白性。实验I、Ⅱ现象不同的原因是_______ 。
②由实验Ⅲ可得出的结论是_______ 。
(1)1774年,瑞典化学家舍勒将浓盐酸与软锰矿(主要成分为
 )混合加热,发现了氯气。下图为实验室制取Cl2的装置,请回答:
)混合加热,发现了氯气。下图为实验室制取Cl2的装置,请回答:
盛放浓盐酸的仪器名称是
(2)下图所示制取氯气的净化、收集、尾气处理的装置能达到实验目的的是
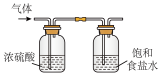 |  |  |
| A.净化Cl2 | B.收集Cl2 | C.尾气处理 |
(3)已知:常温下用
 和市售浓盐酸(11.9
和市售浓盐酸(11.9 )反应制取Cl2难以进行。但若用漂白粉(有效成分
)反应制取Cl2难以进行。但若用漂白粉(有效成分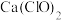 )、高锰酸钾等与浓盐酸反应,常温下很容易制取Cl2。
)、高锰酸钾等与浓盐酸反应,常温下很容易制取Cl2。①已知,如图装置A是氯气的发生装置。加入适量的浓盐酸充分反应有黄绿色气体生成,写出发生反应的化学方程式,并用

②装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅲ处应放入的是
a.干燥的有色布条 b.湿润的有色布条 c.湿润的淀粉
 试纸
试纸装置C的Ⅱ处的试剂是
a.碱石灰(氢氧化钠和氧化钙的固体混合物) b.无水氯化钙 c.浓硫酸
③装置D中一般
(4)84消毒液是一种常见的含氯消毒剂,其有效成分为次氯酸钠。
资料:84消毒液中含氯微粒主要有
 、
、 、
、 ;相同浓度时,
;相同浓度时, 的氧化性强于
的氧化性强于 ;
;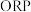 是反映水溶液中所有物质表现出来的氧化—还原性,
是反映水溶液中所有物质表现出来的氧化—还原性,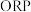 值越大,氧化性越强。
值越大,氧化性越强。某兴趣小组同学研究84消毒液的漂白性,实验如下。
I.向2
 84消毒液中加入2
84消毒液中加入2 水后,放入红色纸片,观察到纸片慢慢褪色。
水后,放入红色纸片,观察到纸片慢慢褪色。Ⅱ.向2
 84消毒液中加入2
84消毒液中加入2 白醋后,放入红色纸片,观察到纸片迅速褪色。
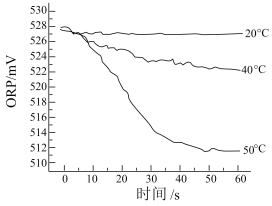
白醋后,放入红色纸片,观察到纸片迅速褪色。Ⅲ.测得84消毒液在不同温度时
 随时间的变化曲线如
随时间的变化曲线如
①已知白醋显酸性,不具有漂白性。实验I、Ⅱ现象不同的原因是
②由实验Ⅲ可得出的结论是
您最近半年使用:0次
5 . 含氯物质在生产生活中有重要作用。
I.实验室制取氯气的装置如图所示。
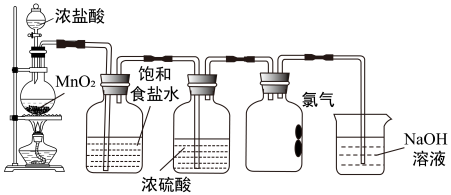
(1)收集氯气的集气瓶中,导管没有画完整,请在答题卡图中补充完整___________ 。
(2)NaOH溶液的作用是(用离子方程式表示)___________
(3)当氯气不再逸出时,圆底烧瓶中的固液混合物中仍存在盐酸和二氧化锰,某合作学习小组分析成因时提出如下猜想:
猜想a;随H+浓度降低,MnO2的氧化性减弱。
猪想b:随Cl-浓度降低,Cl-的还原性___________ (填“增强”、“不变”或“减弱”)。
猜想c:随Mn2+浓度升高,MnO2的氧化性减弱。
①查阅资料:K+、 对体系中各物质的氧化性与还原性均无影响。
对体系中各物质的氧化性与还原性均无影响。
②设计实验验证:将固液混合物均分为三组,保持条件相同,分别向三组固液混合物中加入试剂。
通过三组实验,a、b、c三个猜想都得到了证实,则X为_______ (填化学式),Y为_______ (填化学式)。
II.已知FeCl3固体易升华,其蒸气为黄色。某小组通过下面装置探究MnO2与FeCl3能否反应产生Cl2。
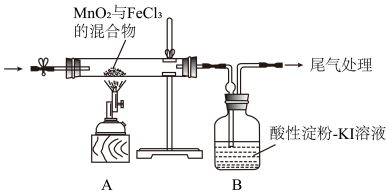
实验操作和现象:
(4)实验前,需要进行的操作为___________ 。
(5)该实验装置从安全角度分析,存在的问题是___________ 。
(6)装置经改进后,继续实验,确认产物有Cl2和MnCl2,则A中发生反应的化学方程式为___________ 。
I.实验室制取氯气的装置如图所示。

(1)收集氯气的集气瓶中,导管没有画完整,请在答题卡图中补充完整
(2)NaOH溶液的作用是(用离子方程式表示)
(3)当氯气不再逸出时,圆底烧瓶中的固液混合物中仍存在盐酸和二氧化锰,某合作学习小组分析成因时提出如下猜想:
猜想a;随H+浓度降低,MnO2的氧化性减弱。
猪想b:随Cl-浓度降低,Cl-的还原性
猜想c:随Mn2+浓度升高,MnO2的氧化性减弱。
①查阅资料:K+、
 对体系中各物质的氧化性与还原性均无影响。
对体系中各物质的氧化性与还原性均无影响。②设计实验验证:将固液混合物均分为三组,保持条件相同,分别向三组固液混合物中加入试剂。
| 组别 | 试剂 | 产物 |
| 1 | 较浓硫酸 | 有Cl2生成 |
| 2 | X | 有Cl2生成 |
| 3 | X和Y | 无Cl2生成 |
II.已知FeCl3固体易升华,其蒸气为黄色。某小组通过下面装置探究MnO2与FeCl3能否反应产生Cl2。

实验操作和现象:
| 实验操作 | 现象 |
| 点燃酒精喷灯,加热 | 加热一段时间后,装置A中产生黄色气体,装置B中溶液变蓝 |
(5)该实验装置从安全角度分析,存在的问题是
(6)装置经改进后,继续实验,确认产物有Cl2和MnCl2,则A中发生反应的化学方程式为
您最近半年使用:0次
6 . 84消毒液是一种常见的含氯消毒剂。如图为某品牌84消毒液的说明书中的部分内容。

产品特点
本品是以次氯酸钠为主要成分的液体消毒剂。可杀灭肠道致病菌、化脓性球菌、致病性酵母菌,并能灭活病毒。
注意事项
①本品易使有色衣脱色,禁止用于丝、毛、麻织物的消毒。
②不得将本品与酸性产品(如洁厕类清洁产品)同时使用。
③置于避光、阴凉处保存。
④需稀释后使用, 勿口服。
(1)84消毒液的主要成分为___________ (用化学式表示)。
(2)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:___________ 。
(3)某同学研究 84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于 ClO-;ORP是反映水溶液中所有物质表现出来的氧化—还原性, ORP值越大, 氧化性越强。
I.向 2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向 2mL84消毒液中加入2mL白醋后, 放入红色纸片, 观察到纸片迅速褪色。
Ⅲ.测得 84消毒液在不同温度时ORP随时间的变化曲线如下。
①已知白醋显酸性,且酸性强于次氯酸,不具有漂白性。实验I、Ⅱ现象不同的原因是___________ 。
②实验表明,向84消毒液中加入较多稀硫酸时会产生氯气,生成氯气的离子方程式是___________ 。
③由实验Ⅲ可得出的结论是___________ 。ORP 值不同的原因可能是___________ 。
(4)某同学将纯净的 Cl2通入一定量石灰乳中来制取漂白粉。
①若通入x个 Cl2全反应,则反应过程中转移电子___________ 个。
②漂白粉的主要成分是___________ 。

产品特点
本品是以次氯酸钠为主要成分的液体消毒剂。可杀灭肠道致病菌、化脓性球菌、致病性酵母菌,并能灭活病毒。
注意事项
①本品易使有色衣脱色,禁止用于丝、毛、麻织物的消毒。
②不得将本品与酸性产品(如洁厕类清洁产品)同时使用。
③置于避光、阴凉处保存。
④需稀释后使用, 勿口服。
(1)84消毒液的主要成分为
(2)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:
(3)某同学研究 84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于 ClO-;ORP是反映水溶液中所有物质表现出来的氧化—还原性, ORP值越大, 氧化性越强。
I.向 2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向 2mL84消毒液中加入2mL白醋后, 放入红色纸片, 观察到纸片迅速褪色。
Ⅲ.测得 84消毒液在不同温度时ORP随时间的变化曲线如下。

①已知白醋显酸性,且酸性强于次氯酸,不具有漂白性。实验I、Ⅱ现象不同的原因是
②实验表明,向84消毒液中加入较多稀硫酸时会产生氯气,生成氯气的离子方程式是
③由实验Ⅲ可得出的结论是
(4)某同学将纯净的 Cl2通入一定量石灰乳中来制取漂白粉。
①若通入x个 Cl2全反应,则反应过程中转移电子
②漂白粉的主要成分是
您最近半年使用:0次
名校
7 . 实验小组制备高铁酸钾 并探究其性质。
并探究其性质。
资料: 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
I.制备 (夹持装置略)
(夹持装置略)
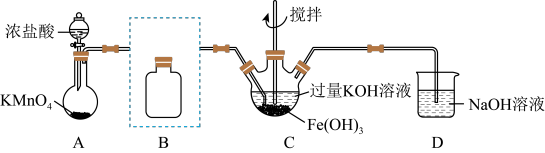
(1)A为氯气发生装置。 中反应的离子方程式是
中反应的离子方程式是_______
(2)B装置盛有饱和 溶液,
溶液, 中得到紫色固体和溶液。
中得到紫色固体和溶液。 中制备高铁酸钾的化学反应方程式为
中制备高铁酸钾的化学反应方程式为_______
II.探究 的性质
的性质
(3)取 中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液
中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液 ,经检验气体中含有
,经检验气体中含有 。
。
为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
由方案Ⅰ可知 中含有
中含有 离子,但该离子的产生不能判断一定是
离子,但该离子的产生不能判断一定是 将
将 氧化,还可能由
氧化,还可能由_______ 产生,(用离子方程式表示)。
(4)根据 的制备实验得出:氧化性
的制备实验得出:氧化性
_______  (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因可能是
的氧化性强弱关系相反,原因可能是_______ 。
 并探究其性质。
并探究其性质。资料:
 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。I.制备
 (夹持装置略)
(夹持装置略)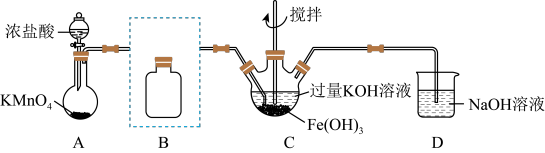
(1)A为氯气发生装置。
 中反应的离子方程式是
中反应的离子方程式是(2)B装置盛有饱和
 溶液,
溶液, 中得到紫色固体和溶液。
中得到紫色固体和溶液。 中制备高铁酸钾的化学反应方程式为
中制备高铁酸钾的化学反应方程式为II.探究
 的性质
的性质(3)取
 中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液
中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液 ,经检验气体中含有
,经检验气体中含有 。
。为证明是否
 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案Ⅰ | 取少量a,经过检验溶液中含有 。 。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将 溶出,得到紫色溶液b。取少量b,滴加盐酸,有 溶出,得到紫色溶液b。取少量b,滴加盐酸,有 产生。 产生。 |
 中含有
中含有 离子,但该离子的产生不能判断一定是
离子,但该离子的产生不能判断一定是 将
将 氧化,还可能由
氧化,还可能由(4)根据
 的制备实验得出:氧化性
的制备实验得出:氧化性
 (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因可能是
的氧化性强弱关系相反,原因可能是
您最近半年使用:0次
2023-01-22更新
|
583次组卷
|
3卷引用:吉林省长春市东北师大附属中学2022-2023学年高一上学期期末考试化学试题
名校
8 . 高铁酸钾 是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知:
是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知: 为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生
为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生 :
:
(1)C中得到紫色固体和溶液,写出得到紫色固体的化学方程式为___________ (并用双线桥表示电子转移),C中 发生的反应还有
发生的反应还有___________ 。(用离子方程式表示)
(2)探究 的性质
的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计如下方案:
,设计如下方案:
方案一:取少量a,经测定含有
方案二:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将 溶出,得到紫色溶液b。取少量b,滴加盐酸,有
溶出,得到紫色溶液b。取少量b,滴加盐酸,有 产生。
产生。
①由方案一中可知a中含有 ,但该离子的产生不能判断一定是
,但该离子的产生不能判断一定是 将
将 氧化所得,还可能由
氧化所得,还可能由___________ 产生(文字描述)。
②方案二中要用KOH溶液充分洗涤所得固体的原因是___________ 。
③根据 的制备实验得出:氧化性
的制备实验得出:氧化性 大于
大于 ,而方案二实验中
,而方案二实验中 和
和 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是___________ 。
(3)高铁酸钾水处理原理如图所示。
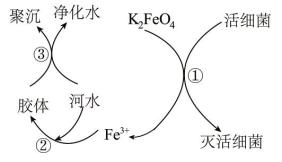
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
①过程①中活细菌表现了___________ (填“氧化”或“还原”)性,该过程的还原产物是___________ (填离子符号);过程③属于___________ (填“物理”或“化学”)变化。
②根据上述原理分析,作水处理剂时, 的作用有
的作用有___________ 。(填两个)
 是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知:
是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知: 为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生
为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生 :
:
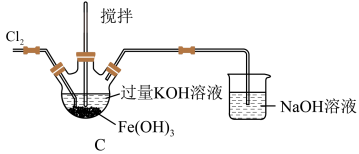
(1)C中得到紫色固体和溶液,写出得到紫色固体的化学方程式为
 发生的反应还有
发生的反应还有(2)探究
 的性质
的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计如下方案:
,设计如下方案:方案一:取少量a,经测定含有

方案二:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将
 溶出,得到紫色溶液b。取少量b,滴加盐酸,有
溶出,得到紫色溶液b。取少量b,滴加盐酸,有 产生。
产生。①由方案一中可知a中含有
 ,但该离子的产生不能判断一定是
,但该离子的产生不能判断一定是 将
将 氧化所得,还可能由
氧化所得,还可能由②方案二中要用KOH溶液充分洗涤所得固体的原因是
③根据
 的制备实验得出:氧化性
的制备实验得出:氧化性 大于
大于 ,而方案二实验中
,而方案二实验中 和
和 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是(3)高铁酸钾水处理原理如图所示。

【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
①过程①中活细菌表现了
②根据上述原理分析,作水处理剂时,
 的作用有
的作用有
您最近半年使用:0次
9 . 实验小组制备高铁酸钾 并探究其性质。
并探究其性质。
资料: 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)制备 (夹持装置略)
(夹持装置略)
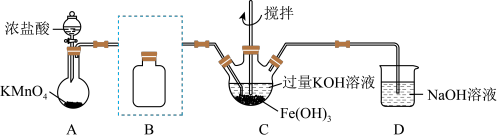
①A为氯气发生装置,写出A中反应的离子反应方程式,并用单线桥表示电子转移_______ 。
②将除杂装置B补充完整;并标明所用试剂_______ 。
③C中得到紫色固体和溶液。C中 发生的反应有
发生的反应有_______ 、_______ 。
(2)探究 的性质
的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 ,为证明是否
,为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
i.由方案I中溶液变红可知a中含有_______ 离子,但该离子的产生不能判断一定 将
将 氧化,还可能由
氧化,还可能由_______ 产生(用离子方程式表示)。
ii.方案II可证明 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是_______ 。
根据 的制备实验得出:氧化性
的制备实验得出:氧化性
_______  (填“>””或“<”),而方案II实验表明,
(填“>””或“<”),而方案II实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。
 并探究其性质。
并探究其性质。资料:
 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)制备
 (夹持装置略)
(夹持装置略)
①A为氯气发生装置,写出A中反应的离子反应方程式,并用单线桥表示电子转移
②将除杂装置B补充完整;并标明所用试剂
③C中得到紫色固体和溶液。C中
 发生的反应有
发生的反应有(2)探究
 的性质
的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 ,为证明是否
,为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案I | 取少量a,滴加 溶液至过量,溶液呈红色 溶液至过量,溶液呈红色 |
| 方案II | 用 溶液充分洗涤C中所得固体,再用 溶液充分洗涤C中所得固体,再用 溶液将 溶液将 溶出,得到紫色溶液b,取少量b,滴加盐酸,有 溶出,得到紫色溶液b,取少量b,滴加盐酸,有 产生。 产生。 |
 将
将 氧化,还可能由
氧化,还可能由ii.方案II可证明
 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是根据
 的制备实验得出:氧化性
的制备实验得出:氧化性
 (填“>””或“<”),而方案II实验表明,
(填“>””或“<”),而方案II实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近半年使用:0次
10 . 利用图,可以从不同角度研究含氯物质的性质及其转化关系,图中甲~辛均含氯元素。回答下列问题:

(1)丙的化学式为______ ;丁属于______ (“酸性”或“碱性”)氧化物。
(2)图中甲、乙、丁、戊中,属于电解质的是_____ (填化学式);根据氯元素的化合价判断,乙物质的性质______ (填标号)。
a.只有氧化性 b.既有氧化性又有还原性 c.只有还原性
(3)物质己的化学式为HClO4,电解甲溶液制备己的化学反应为:甲+H2O 己+H2↑(未配平),配平后参与反应的甲与H2O的微粒个数之比是
己+H2↑(未配平),配平后参与反应的甲与H2O的微粒个数之比是_____ 。
(4)庚是家庭中常用消毒液的有效成分NaClO,用乙制取庚的化学方程式为_____ 。NaClO溶液中显碱性原因:______ (用离子方程式表示)。
(5)辛在MnO2催化下受热分解可用于制备氧气,每生成1.204×1024氧气分子,转移e-的个数为______ 。

(1)丙的化学式为
(2)图中甲、乙、丁、戊中,属于电解质的是
a.只有氧化性 b.既有氧化性又有还原性 c.只有还原性
(3)物质己的化学式为HClO4,电解甲溶液制备己的化学反应为:甲+H2O
 己+H2↑(未配平),配平后参与反应的甲与H2O的微粒个数之比是
己+H2↑(未配平),配平后参与反应的甲与H2O的微粒个数之比是(4)庚是家庭中常用消毒液的有效成分NaClO,用乙制取庚的化学方程式为
(5)辛在MnO2催化下受热分解可用于制备氧气,每生成1.204×1024氧气分子,转移e-的个数为
您最近半年使用:0次



