1 . “新冠”疫情期间,人们广泛使用“84消毒液”进行环境消毒。某品牌“84消毒液”张贴标签如图所示,请回答下列问题:
(1)从组成的阴离子来看,“84消毒液”的有效成分属于_______ 盐。常温下,可将Cl2通入NaOH溶液来制取“84消毒液”该反应的离子方程式是_______ 。
(2)“84消毒液”进行环境消毒时利用了NaClO的_______ (填“氧化性”或“还原性”)
(3)一瓶该品牌的“84消毒液”中含NaClO_______ g,NaClO的物质的量浓度为_______ mol/L(计算结果保留2位有效数字)。
(4)配制500mL0.10mol/LNaClO溶液。
①转移溶液时用到的玻璃仪器有:500mL容量瓶、_______ 、_______ 。
②配制过程中,下列操作会导致所配溶液浓度偏小的是_______ (填字母标号)。
A.容量瓶内有少量蒸馏水
B.移液时,液体不慎撒到容量瓶外
C.洗涤液未转移至容量瓶中
D.定容时俯视刻度线
| 84消毒液 【有效成分】NaClO 【规格】750mL 【质量分数】25% 【密度】1.2g/cm3 |
(2)“84消毒液”进行环境消毒时利用了NaClO的
(3)一瓶该品牌的“84消毒液”中含NaClO
(4)配制500mL0.10mol/LNaClO溶液。
①转移溶液时用到的玻璃仪器有:500mL容量瓶、
②配制过程中,下列操作会导致所配溶液浓度偏小的是
A.容量瓶内有少量蒸馏水
B.移液时,液体不慎撒到容量瓶外
C.洗涤液未转移至容量瓶中
D.定容时俯视刻度线
您最近一年使用:0次
2 . 高铁酸钾(K2FeO4)是一种高效无毒的新型绿色消毒剂,制备流程如下:
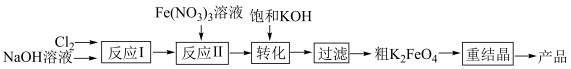
资料信息:
ⅰ.K2FeO4可溶于水,微溶于KOH溶液,难溶于乙醇,KOH易溶于乙醇
ⅱ.在碱性溶液中的溶解度:K2FeO4 < Na2FeO4
ⅲ. 在碱性溶液中稳定,中性和酸性溶液中不稳定
在碱性溶液中稳定,中性和酸性溶液中不稳定
(1)K2FeO4具有强氧化性,其中铁元素的化合价为_____ 价。
(2)反应I目的是制备NaClO,请写出其反应化学方程式___________ 。
(3)反应Ⅱ为碱性条件下制备高铁酸钠(Na2FeO4),3NaClO+ 2Fe(NO3)3+ 10NaOH= 2Na2FeO4+ 6NaNO3+ 3NaCl+ 5H2O在该反应中还原产物为________ (写化学式),生产1mol Na2FeO4转移的电子数为___ NA。
(4)将反应Ⅱ产生的Na2FeO4提取后形成饱和溶液,与饱和KOH进行转化,请写出其反应化学方程式_______ 。
(5)粗K2FeO4需进行重结晶操作以提纯,将粗产品溶于冷的稀KOH溶液中,过滤取滤液,加入饱和KOH溶液,置于冰水浴中,过滤取沉淀,所得沉淀用_______ (选“乙醇”或“水”)洗涤、干燥,可得纯度较高的K2FeO4。
(6)K2FeO4与稀硫酸反应:4 +20H+=4Fe3++3O2↑+10H2O,通过测定生成O2的体积,可计算K2FeO4的纯度。取mg K2FeO4产品与稀硫酸反应,测得生成O2的体积为V mL(标准状况)。计算K2FeO4的纯度
+20H+=4Fe3++3O2↑+10H2O,通过测定生成O2的体积,可计算K2FeO4的纯度。取mg K2FeO4产品与稀硫酸反应,测得生成O2的体积为V mL(标准状况)。计算K2FeO4的纯度
_______ (列出计算式即可)。 (物质的纯度
(物质的纯度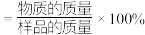 )
)

资料信息:
ⅰ.K2FeO4可溶于水,微溶于KOH溶液,难溶于乙醇,KOH易溶于乙醇
ⅱ.在碱性溶液中的溶解度:K2FeO4 < Na2FeO4
ⅲ.
 在碱性溶液中稳定,中性和酸性溶液中不稳定
在碱性溶液中稳定,中性和酸性溶液中不稳定(1)K2FeO4具有强氧化性,其中铁元素的化合价为
(2)反应I目的是制备NaClO,请写出其反应化学方程式
(3)反应Ⅱ为碱性条件下制备高铁酸钠(Na2FeO4),3NaClO+ 2Fe(NO3)3+ 10NaOH= 2Na2FeO4+ 6NaNO3+ 3NaCl+ 5H2O在该反应中还原产物为
(4)将反应Ⅱ产生的Na2FeO4提取后形成饱和溶液,与饱和KOH进行转化,请写出其反应化学方程式
(5)粗K2FeO4需进行重结晶操作以提纯,将粗产品溶于冷的稀KOH溶液中,过滤取滤液,加入饱和KOH溶液,置于冰水浴中,过滤取沉淀,所得沉淀用
(6)K2FeO4与稀硫酸反应:4
 +20H+=4Fe3++3O2↑+10H2O,通过测定生成O2的体积,可计算K2FeO4的纯度。取mg K2FeO4产品与稀硫酸反应,测得生成O2的体积为V mL(标准状况)。计算K2FeO4的纯度
+20H+=4Fe3++3O2↑+10H2O,通过测定生成O2的体积,可计算K2FeO4的纯度。取mg K2FeO4产品与稀硫酸反应,测得生成O2的体积为V mL(标准状况)。计算K2FeO4的纯度
 (物质的纯度
(物质的纯度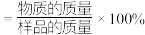 )
)
您最近一年使用:0次
名校
解题方法
3 . 次氯酸盐具有强氧化性。在碱性条件下,利用KClO氧化Fe(NO3)3生成高铁酸钾K2FeO4的工艺流程如下:
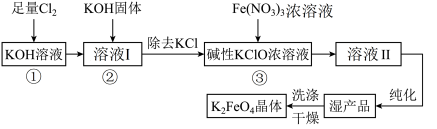
已知:6KOH+3Cl2=5KCl+KClO3+3H2O
回答下列问题:
(1)反应①应在___________ (填“温度较高”或“温度较低”)的情况下进行,该反应的离子方程式为___________ 。
(2)在溶液I中加入KOH固体的目的是___________ 。
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为___________ 。
(4)K2FeO4可作饮用水处理剂,该反应的离子方程式:4FeO +10H2O=4Fe(OH)3(体)+3O2↑+8OH-,K2FeO4处理水中悬浮颗粒物的原理是
+10H2O=4Fe(OH)3(体)+3O2↑+8OH-,K2FeO4处理水中悬浮颗粒物的原理是___________ ;K2FeO4可用于杀菌消毒的原因是___________ 。
(5)该工艺每得到1.98kgK2FeO4,理论上消耗Cl2物质的量为___________ mol。

已知:6KOH+3Cl2=5KCl+KClO3+3H2O
回答下列问题:
(1)反应①应在
(2)在溶液I中加入KOH固体的目的是
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为
(4)K2FeO4可作饮用水处理剂,该反应的离子方程式:4FeO
 +10H2O=4Fe(OH)3(体)+3O2↑+8OH-,K2FeO4处理水中悬浮颗粒物的原理是
+10H2O=4Fe(OH)3(体)+3O2↑+8OH-,K2FeO4处理水中悬浮颗粒物的原理是(5)该工艺每得到1.98kgK2FeO4,理论上消耗Cl2物质的量为
您最近一年使用:0次
2024-01-19更新
|
256次组卷
|
3卷引用:湖北省沙市中学2023-2024学年高一上学期11月月考化学试题
名校
4 . 下图为元素周期表的一部分 ,图中所列字母分别代表一种化学元素
(1)元素b、c、e形成的常见稳定单质中最易与H2化合的是_______ (填化学式)。
(2)元素d、e所形成的某化合物的摩尔质量为110 g·mol-1, 该化合物的化学式为_______ ,其中所含化学键的类型有_______ 。
(3)推测原子序数为35的元素在元素周期表中的位置是_______ 。
(4)依据元素周期律推测,元素f的单质及其化合物的性质正确的是_______(填字母)。
(5)气体分子(ab)2中各原子最外层都达到8电子结构,该分子的电子式为_______ ,(ab)2称为拟卤素,性质与卤素单质相似,常温下其与NaOH溶液反应的化学方程式为_______ 。
| a | b | c | |||||||||||||||
| d | e | ||||||||||||||||
| …… | f | ||||||||||||||||
(2)元素d、e所形成的某化合物的摩尔质量为110 g·mol-1, 该化合物的化学式为
(3)推测原子序数为35的元素在元素周期表中的位置是
(4)依据元素周期律推测,元素f的单质及其化合物的性质正确的是_______(填字母)。
| A.f的单质常温下呈气态 |
| B.f的单质具有强氧化性 |
| C.fc3属于酸性氧化物 |
| D.fc2既有氧化性又有还原性 |
您最近一年使用:0次
5 . 叠氮化钠(NaN3)不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼(N2H4•H2O)并利用其进一步反应制取NaN3的流程如图:
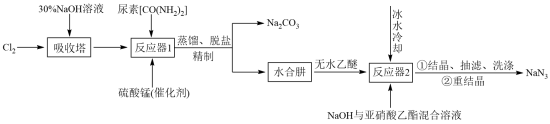
已知:①N2H4•H2O易溶于水,具有强还原性,易被氧化成N2;
②一定条件下,碱性NaClO溶液与尿素溶液反应生成N2H4•H2O。
回答下列问题:
(1)吸收塔内发生反应的离子方程式为____ 。
(2)写出反应器1中生成水合肼反应的化学方程式:_____ 。
(3)反应器2中加入无水乙醚的作用是____ 。
(4)已知亚硝酸乙酯的结构简式为CH3CH2ONO,写出反应器2中生成NaN3和CH3CH2OH的化学方程式:____ 。若生成39gNaN3,则该反应中转移电子的物质的量为____ 。

已知:①N2H4•H2O易溶于水,具有强还原性,易被氧化成N2;
②一定条件下,碱性NaClO溶液与尿素溶液反应生成N2H4•H2O。
回答下列问题:
(1)吸收塔内发生反应的离子方程式为
(2)写出反应器1中生成水合肼反应的化学方程式:
(3)反应器2中加入无水乙醚的作用是
(4)已知亚硝酸乙酯的结构简式为CH3CH2ONO,写出反应器2中生成NaN3和CH3CH2OH的化学方程式:
您最近一年使用:0次
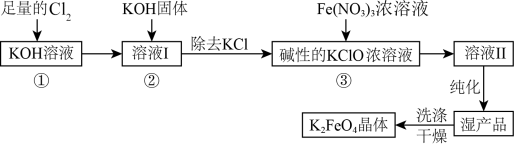
6 . 次氯酸盐具有强氧化性。在碱性条件下,利用 氧化
氧化 生成高铁酸钾
生成高铁酸钾 的工艺流程如下:
的工艺流程如下:
已知:①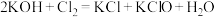 (条件:温度较低);
(条件:温度较低);
②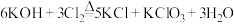 (条件:温度较高)。
(条件:温度较高)。
回答下列问题:
(1)反应①应在
(2)在溶液I中加入
 固体的目的是
固体的目的是(3)从溶液Ⅱ中分离出
 后,还会有副产品
后,还会有副产品 、
、 ,则反应③中发生的离子反应方程式为
,则反应③中发生的离子反应方程式为(4)
 可作饮用水处理剂,该反应的离子方程式:
可作饮用水处理剂,该反应的离子方程式: ,
, 处理水中悬浮颗粒物的原理是
处理水中悬浮颗粒物的原理是(5)目前,人们针对
 的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高
的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高 水溶液稳定性的物质是___________(填字母)。
水溶液稳定性的物质是___________(填字母)。A. | B. | C. | D. |
您最近一年使用:0次
2023-09-21更新
|
349次组卷
|
3卷引用:河南省部分名校2023-2024学年高三上学期核心模拟考试(一)化学试题
名校
解题方法
7 . 利用如图所示的“价-类”二维图,可以从物质类别、化合价角度认识含氯元素的物质的性质及其转化关系,图中甲~辛均为含氯元素的物质。回答下列问题:
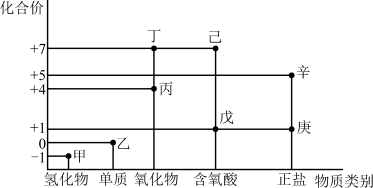
(1)戊的化学式为_______ 。
(2)甲、乙、丙中,属于非电解质的是_______ (填化学式)。根据氯元素的化合价判断乙_______ (填序号)。
a.只有氧化性 b.只有还原性 c.既有氧化性又有还原性
(3)庚是“84”消毒液的有效成分,能有效灭菌,某化学社团模拟生产厂家配制了 “84消毒液”,并在瓶体贴上标签,如图所示,回答下列问题:
“84消毒液”,并在瓶体贴上标签,如图所示,回答下列问题:
①写出氯气和 溶液生产此消毒液的离子方程式
溶液生产此消毒液的离子方程式_______ 。该“84消毒液”有效成分的物质的量浓度为_______ 。
②“84消毒液”与稀硫酸混合使用可增强消毒能力,该社团成员用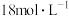 的浓硫酸配制
的浓硫酸配制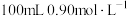 的稀硫酸用于增强“84消毒液”的消毒能力。若所配制的稀硫酸浓度偏高,则可能的原因是
的稀硫酸用于增强“84消毒液”的消毒能力。若所配制的稀硫酸浓度偏高,则可能的原因是_______ 。
A.配制前,容量瓶中有少量蒸馏水
B.量取浓硫酸时,仰视液体的凹液面
C.未冷却,立即转移至容量瓶定容
D.未洗涤烧杯和玻璃棒

(1)戊的化学式为
(2)甲、乙、丙中,属于非电解质的是
a.只有氧化性 b.只有还原性 c.既有氧化性又有还原性
(3)庚是“84”消毒液的有效成分,能有效灭菌,某化学社团模拟生产厂家配制了
 “84消毒液”,并在瓶体贴上标签,如图所示,回答下列问题:
“84消毒液”,并在瓶体贴上标签,如图所示,回答下列问题:| 84消毒液 |
(有效成分) (规格)  (质量分数) 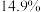 (密度)  |
 溶液生产此消毒液的离子方程式
溶液生产此消毒液的离子方程式②“84消毒液”与稀硫酸混合使用可增强消毒能力,该社团成员用
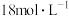 的浓硫酸配制
的浓硫酸配制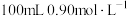 的稀硫酸用于增强“84消毒液”的消毒能力。若所配制的稀硫酸浓度偏高,则可能的原因是
的稀硫酸用于增强“84消毒液”的消毒能力。若所配制的稀硫酸浓度偏高,则可能的原因是A.配制前,容量瓶中有少量蒸馏水
B.量取浓硫酸时,仰视液体的凹液面
C.未冷却,立即转移至容量瓶定容
D.未洗涤烧杯和玻璃棒
您最近一年使用:0次
2022-02-28更新
|
361次组卷
|
2卷引用:重庆第二外国语学校2021-2022学年高一上学期期末考试化学试题
解题方法
8 . 如图所示转化关系中,A、G均为常见气态非金属单质,B为强碱,C溶液具有漂白作用,D为无氧酸盐,常温下E为无色无味的液体,F为淡黄色固体,反应①、②均可在常温下进行。
回答下列问题:

(1)反应①的化学方程式为____ 。
(2)向C溶液中通入少量二氧化碳的离子方程式为____ ;上述物质中,属于非金属氧化物的是_____ 。
(3)反应②的离子方程式为____ ;该反应中,每生成3.36L(标准状况)气体G时,消耗F的质量为____ g。
(4)潮湿的A2与Na2CO3混合制取少量A2O(O为氧元素)的反应中,A2既体现了氧化性,也体现了还原性,同时生成两种盐。写出反应的化学方程式:____ 。
回答下列问题:

(1)反应①的化学方程式为
(2)向C溶液中通入少量二氧化碳的离子方程式为
(3)反应②的离子方程式为
(4)潮湿的A2与Na2CO3混合制取少量A2O(O为氧元素)的反应中,A2既体现了氧化性,也体现了还原性,同时生成两种盐。写出反应的化学方程式:
您最近一年使用:0次
名校
9 . 某校化学实验兴趣小组为探究卤素单质性质进行了以下实验:
I.为验证卤族元素性质的递变规律,某同学设计了如图所示装置。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉-KI试纸、沾有NaOH溶液的棉花。

(1)A处反应的离子方程式:___________ ,B处的实验现象为___________ ,C处沾有NaOH溶液的棉花的作用为___________ ;
(2)该实验___________ 验证非金属性Cl>Br>I(填“能”或“不能”),理由是___________ ;
II.已知Cl2可以将Fe2+氧化成Fe3+,为探究Br2能否将Fe2+氧化成Fe3+,某同学甲做了以下实验:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后观察到溶液呈黄色。
(3)乙同学认为不能据此现象认为Br2氧化性比Fe3+强,理由是___________ ;
(4)丙同学选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了氧化性:Br2>Fe3+。请在表中写出丙同学可能选用的试剂及实验中观察到的现象(供选用的试剂:a.酚酞试液、b.CCl4、c.无水酒精、d.KSCN溶液)。
(5)向FeBr2溶液中通入少量Cl2,发生反应的离子方程式为___________ 。
I.为验证卤族元素性质的递变规律,某同学设计了如图所示装置。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉-KI试纸、沾有NaOH溶液的棉花。

(1)A处反应的离子方程式:
(2)该实验
II.已知Cl2可以将Fe2+氧化成Fe3+,为探究Br2能否将Fe2+氧化成Fe3+,某同学甲做了以下实验:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后观察到溶液呈黄色。
(3)乙同学认为不能据此现象认为Br2氧化性比Fe3+强,理由是
(4)丙同学选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了氧化性:Br2>Fe3+。请在表中写出丙同学可能选用的试剂及实验中观察到的现象(供选用的试剂:a.酚酞试液、b.CCl4、c.无水酒精、d.KSCN溶液)。
| 选用试剂(填序号) | 实验现象 | |
| 方案1 | ||
| 方案2 |
(5)向FeBr2溶液中通入少量Cl2,发生反应的离子方程式为
您最近一年使用:0次
名校
10 . 锰酸钾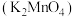 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
在浓强碱溶液中可稳定存在,碱性减弱时易发生反应: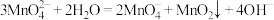 。利用
。利用 氧化
氧化 制备
制备 的装置如图所示(夹持装置略)。下列说法错误的是
的装置如图所示(夹持装置略)。下列说法错误的是

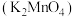 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
在浓强碱溶液中可稳定存在,碱性减弱时易发生反应: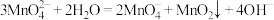 。利用
。利用 氧化
氧化 制备
制备 的装置如图所示(夹持装置略)。下列说法错误的是
的装置如图所示(夹持装置略)。下列说法错误的是 
A.在强碱性环境下,氧化性: |
| B.装置Ⅰ中的漂白粉可以用氯酸钾代替 |
C.装置Ⅱ中盛放浓硫酸,以提高 的产率 的产率 |
| D.装置Ⅳ不需要防倒吸的原因是氢氧化钠溶液与氯气反应速率较慢 |
您最近一年使用:0次



