名校
1 . 高铁酸钾 是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知:
是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知: 为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生
为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生 :
:
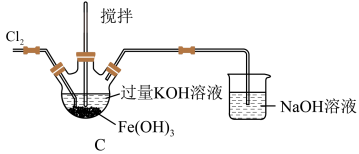
(1)C中得到紫色固体和溶液,写出得到紫色固体的化学方程式为___________ (并用双线桥表示电子转移),C中 发生的反应还有
发生的反应还有___________ 。(用离子方程式表示)
(2)探究 的性质
的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计如下方案:
,设计如下方案:
方案一:取少量a,经测定含有
方案二:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将 溶出,得到紫色溶液b。取少量b,滴加盐酸,有
溶出,得到紫色溶液b。取少量b,滴加盐酸,有 产生。
产生。
①由方案一中可知a中含有 ,但该离子的产生不能判断一定是
,但该离子的产生不能判断一定是 将
将 氧化所得,还可能由
氧化所得,还可能由___________ 产生(文字描述)。
②方案二中要用KOH溶液充分洗涤所得固体的原因是___________ 。
③根据 的制备实验得出:氧化性
的制备实验得出:氧化性 大于
大于 ,而方案二实验中
,而方案二实验中 和
和 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是___________ 。
(3)高铁酸钾水处理原理如图所示。
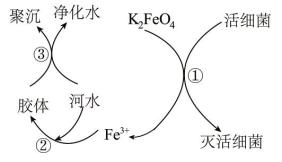
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
①过程①中活细菌表现了___________ (填“氧化”或“还原”)性,该过程的还原产物是___________ (填离子符号);过程③属于___________ (填“物理”或“化学”)变化。
②根据上述原理分析,作水处理剂时, 的作用有
的作用有___________ 。(填两个)
 是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知:
是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知: 为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生
为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生 :
:
(1)C中得到紫色固体和溶液,写出得到紫色固体的化学方程式为
 发生的反应还有
发生的反应还有(2)探究
 的性质
的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计如下方案:
,设计如下方案:方案一:取少量a,经测定含有

方案二:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将
 溶出,得到紫色溶液b。取少量b,滴加盐酸,有
溶出,得到紫色溶液b。取少量b,滴加盐酸,有 产生。
产生。①由方案一中可知a中含有
 ,但该离子的产生不能判断一定是
,但该离子的产生不能判断一定是 将
将 氧化所得,还可能由
氧化所得,还可能由②方案二中要用KOH溶液充分洗涤所得固体的原因是
③根据
 的制备实验得出:氧化性
的制备实验得出:氧化性 大于
大于 ,而方案二实验中
,而方案二实验中 和
和 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是(3)高铁酸钾水处理原理如图所示。

【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
①过程①中活细菌表现了
②根据上述原理分析,作水处理剂时,
 的作用有
的作用有
您最近一年使用:0次
解题方法
2 . 某研究小组制备氯气并对产生氯气的条件进行探究。
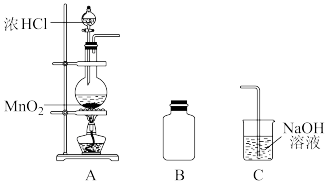
(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的____ (填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是____ 。
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向____ 。
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是____ 。
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。
①已知MnO2呈弱碱性。Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是____ 。
②Ⅱ中发生了分解反应,反应的化学方程式是____ 。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:
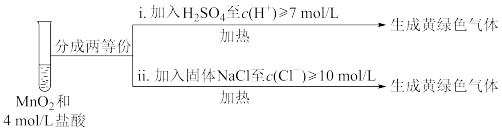
将实验Ⅲ、Ⅳ作对比,得出的结论是____ 。

(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的
(2)A中产生的气体不纯,含有的杂质可能是
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。
| 实验 | 操作 | 现象 |
| Ⅰ | 常温下将MnO2和12mol·L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| Ⅲ | 加热MnO2和4mol·L-1稀盐酸混合物 | 无明显现象 |
②Ⅱ中发生了分解反应,反应的化学方程式是
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:
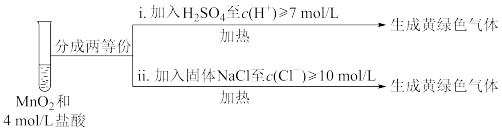
将实验Ⅲ、Ⅳ作对比,得出的结论是
您最近一年使用:0次
名校
3 . 某小组同学研究氯及其化合物的制备和性质。
Ⅰ.氯水具有多种性质,该小组同学用氯水分别与紫色石蕊溶液, 溶液反应。完成下列问题:
溶液反应。完成下列问题:
(1)向紫色石蕊溶液中滴加氯水的现象是___________ ,证明氯水中含有的微粒有___________ 。
(2)向 溶液中滴加少量氯水,证明氯水有氧化性的实验方案为:取适量反应后溶液于试管中,先加入足量的稀盐酸,再滴加
溶液中滴加少量氯水,证明氯水有氧化性的实验方案为:取适量反应后溶液于试管中,先加入足量的稀盐酸,再滴加___________ ,若出现白色沉淀,则证明氯水具有氧化性。
Ⅱ.某学生设计下列实验装置利用 和浓盐酸制备氯气,并用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应):
和浓盐酸制备氯气,并用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应):

请回答下列问题:
(3)写出装置B中制取氯气的化学方程式:___________ 。
(4)漂白粉在U形管中生成,实验结果所得漂白粉 产率太低。经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
产率太低。经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成 ,为避免发生该反应可采取的措施是
,为避免发生该反应可采取的措施是___________ 。
②试判断另一个副反应是___________ (写出此反应的化学方程式)。为避免此副反应的发生,可采取的措施是在B、C之间连接一个盛有___________ 的洗气瓶。
Ⅰ.氯水具有多种性质,该小组同学用氯水分别与紫色石蕊溶液,
 溶液反应。完成下列问题:
溶液反应。完成下列问题:(1)向紫色石蕊溶液中滴加氯水的现象是
(2)向
 溶液中滴加少量氯水,证明氯水有氧化性的实验方案为:取适量反应后溶液于试管中,先加入足量的稀盐酸,再滴加
溶液中滴加少量氯水,证明氯水有氧化性的实验方案为:取适量反应后溶液于试管中,先加入足量的稀盐酸,再滴加Ⅱ.某学生设计下列实验装置利用
 和浓盐酸制备氯气,并用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应):
和浓盐酸制备氯气,并用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应):
请回答下列问题:
(3)写出装置B中制取氯气的化学方程式:
(4)漂白粉在U形管中生成,实验结果所得漂白粉
 产率太低。经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
产率太低。经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:①温度较高时氯气与消石灰反应生成
 ,为避免发生该反应可采取的措施是
,为避免发生该反应可采取的措施是②试判断另一个副反应是
您最近一年使用:0次
2024-01-20更新
|
44次组卷
|
2卷引用:安徽省桐城中学2023-2024学年高一下学期开学检测化学试题
名校
4 . 下图为元素周期表的一部分 ,图中所列字母分别代表一种化学元素
(1)元素b、c、e形成的常见稳定单质中最易与H2化合的是_______ (填化学式)。
(2)元素d、e所形成的某化合物的摩尔质量为110 g·mol-1, 该化合物的化学式为_______ ,其中所含化学键的类型有_______ 。
(3)推测原子序数为35的元素在元素周期表中的位置是_______ 。
(4)依据元素周期律推测,元素f的单质及其化合物的性质正确的是_______(填字母)。
(5)气体分子(ab)2中各原子最外层都达到8电子结构,该分子的电子式为_______ ,(ab)2称为拟卤素,性质与卤素单质相似,常温下其与NaOH溶液反应的化学方程式为_______ 。
| a | b | c | |||||||||||||||
| d | e | ||||||||||||||||
| …… | f | ||||||||||||||||
(2)元素d、e所形成的某化合物的摩尔质量为110 g·mol-1, 该化合物的化学式为
(3)推测原子序数为35的元素在元素周期表中的位置是
(4)依据元素周期律推测,元素f的单质及其化合物的性质正确的是_______(填字母)。
| A.f的单质常温下呈气态 |
| B.f的单质具有强氧化性 |
| C.fc3属于酸性氧化物 |
| D.fc2既有氧化性又有还原性 |
您最近一年使用:0次
2010·北京东城·一模
名校
5 . 氯气是一种重要的化工原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是_________ 。
(2)资料显示:Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
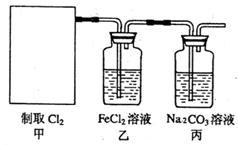
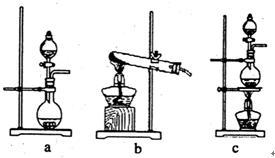
①在该实验中,甲部分的装置是_______ (填字母);
②乙装置中FeCl2溶液与Cl2反应的离子方程式是_______ 。证明FeCl2与Cl2发生了氧化还原反应的实验方法是_________ ;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、清毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是_____________ ;
④该实验存在明显的缺陷,改进的方法是______________ 。
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0g漂白粉配制成250mL溶液,取出25mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1mol·L-1Na2S2O3溶液:2Na2S2O3+I2=Na2S4O6+2NaI,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为____________ 。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是
(2)资料显示:Ca(ClO)2+CaCl2+2H2SO4
 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
①在该实验中,甲部分的装置是

②乙装置中FeCl2溶液与Cl2反应的离子方程式是
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、清毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是
④该实验存在明显的缺陷,改进的方法是
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0g漂白粉配制成250mL溶液,取出25mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1mol·L-1Na2S2O3溶液:2Na2S2O3+I2=Na2S4O6+2NaI,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为
您最近一年使用:0次
6 . 高铁酸钾( )具有极强的氧化性和优良的絮凝功能,是一种绿色环保多功能型水处理剂。下图是生产高铁酸钾的一种工艺流程:
)具有极强的氧化性和优良的絮凝功能,是一种绿色环保多功能型水处理剂。下图是生产高铁酸钾的一种工艺流程:
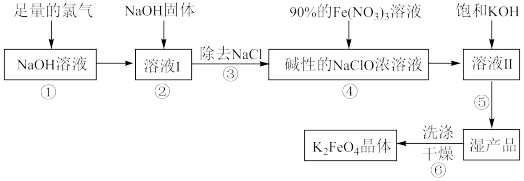
已知 的部分性质如下:
的部分性质如下:
回答下列问题:
(1)写出①中发生反应的化学方程式:___________ 。
(2)②中加入NaOH固体的目的是___________ (填字母序号)。
A.加入NaOH固体做氧化剂有利于除去NaCl
B.为后续反应提供碱性环境
C.NaOH固体溶解时会放出较多的热量,有利于后续生成
(3)完成④中反应的离子方程式:___________ ;反应中氧化剂为:___________ ;每生成1 mol  转移电子的数目为:
转移电子的数目为:___________ 。
(4)从溶液Ⅱ中得到沉淀 的操作是
的操作是___________ 。
(5)⑥中洗涤时,洗涤剂最好选用___________(填字母序号)。
 )具有极强的氧化性和优良的絮凝功能,是一种绿色环保多功能型水处理剂。下图是生产高铁酸钾的一种工艺流程:
)具有极强的氧化性和优良的絮凝功能,是一种绿色环保多功能型水处理剂。下图是生产高铁酸钾的一种工艺流程:
已知
 的部分性质如下:
的部分性质如下:| 溶解性 | 溶于水,微溶于浓KOH溶液,难溶于有机物 |
| 稳定性 | 温度为0~5℃或强碱性溶液中能稳定存在;酸性或中性溶液中放出 |
(1)写出①中发生反应的化学方程式:
(2)②中加入NaOH固体的目的是
A.加入NaOH固体做氧化剂有利于除去NaCl
B.为后续反应提供碱性环境
C.NaOH固体溶解时会放出较多的热量,有利于后续生成

(3)完成④中反应的离子方程式:
 转移电子的数目为:
转移电子的数目为:(4)从溶液Ⅱ中得到沉淀
 的操作是
的操作是(5)⑥中洗涤时,洗涤剂最好选用___________(填字母序号)。
| A.乙醇 | B.KOH溶液 | C. | D. 溶液 溶液 |
您最近一年使用:0次
2023-04-26更新
|
340次组卷
|
2卷引用:黑龙江省双鸭山市第一中学2023-2024学年高一下学期开学化学试题
7 . 氯气是一种重要的工业原料。
(1)写出实验室制取氯气反应的化学方程式________________________ 。
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4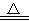 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。

①在该实验中,甲部分的装置是_______ (填字母)。

②乙装置中FeCl2溶液与Cl2反应的离子方程式是________________ 。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质,这种物质是_______ (化学式)。
④有人认为该实验存在明显的缺陷,请你将认为缺少的部分在上图中的相应位置画出,并在添加的装置中标明需要放入的最合适 的化学试剂。______________
请你写出Cl2和“④”中“最合适的化学试剂”反应的离子方程式______________ 。
(1)写出实验室制取氯气反应的化学方程式
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4
 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
①在该实验中,甲部分的装置是

②乙装置中FeCl2溶液与Cl2反应的离子方程式是
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质,这种物质是
④有人认为该实验存在明显的缺陷,请你将认为缺少的部分在上图中的相应位置画出,并在添加的装置中标明需要放入的
请你写出Cl2和“④”中“最合适的化学试剂”反应的离子方程式
您最近一年使用:0次
2017-03-01更新
|
262次组卷
|
2卷引用:2016-2017学年辽宁省六校协作体高一下学期期初化学试卷
8 . 实验室利用以下反应可以快速制取少量氯气: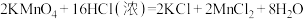
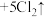 ,关于该反应的说法正确的是
,关于该反应的说法正确的是
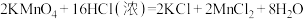
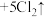 ,关于该反应的说法正确的是
,关于该反应的说法正确的是| A.由该反应判断氧化性:KMnO4>Cl2 |
| B.氧化剂与还原剂的物质的量之比为1:8 |
| C.可以用饱和NaHCO3溶液除去Cl2中混有的HCl |
| D.1 mol Cl2与足量的NaOH溶液充分反应制备“84”消毒液,转移电子的物质的量为2 mol |
您最近一年使用:0次
名校
解题方法
9 . 实验室用如图装置(夹持装置略)制备高效水处理剂高铁酸钾(K2FeO4)。
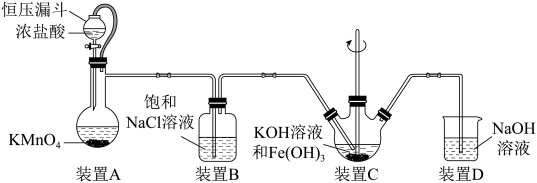
已知:K2FeO4具有强氧化性,可溶于水,微溶于浓KOH溶液,在0℃~5℃、强碱性溶液中比较稳定。
(1)装置A用于制取氯气,盛装KMnO4的仪器为______ ,A中发生反应的离子方程式为________ ,其中恒压漏斗的作用是_________ 。
(2)装置B中饱和NaCl溶液的作用为___________ 。
(3)装置C中生成K2FeO4反应的离子方程式为___________ ,为使C中K2FeO4稳定存在,可以采取的措施有___________ (任答一点)
(4)高铁酸钾作为水处理剂发挥的作用是___________ (答两点)

已知:K2FeO4具有强氧化性,可溶于水,微溶于浓KOH溶液,在0℃~5℃、强碱性溶液中比较稳定。
(1)装置A用于制取氯气,盛装KMnO4的仪器为
(2)装置B中饱和NaCl溶液的作用为
(3)装置C中生成K2FeO4反应的离子方程式为
(4)高铁酸钾作为水处理剂发挥的作用是
您最近一年使用:0次
名校
10 . 卤素单质在碱性溶液中容易发生歧化反应,歧化的产物依反应温度的不同而不同。
 ;
;
下图为制取氯气、氯酸钾、次氯酸钠和检验氯气性质的微型实验装置:

装置中盛装的药品如下:①多用滴管中装有5mL浓盐酸;②微型具支试管中装有1.5g ;③微型具支试管中装有2~3mL浓硫酸;④U形反应管中装有30%KOH溶液;⑤U形反应管中装有
;③微型具支试管中装有2~3mL浓硫酸;④U形反应管中装有30%KOH溶液;⑤U形反应管中装有 NaOH溶液;⑥、⑦双U形反应管中分别装有
NaOH溶液;⑥、⑦双U形反应管中分别装有 淀粉溶液和KBr溶液;⑧尾气出口用浸有
淀粉溶液和KBr溶液;⑧尾气出口用浸有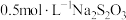 溶液的棉花轻轻覆盖住(用于吸收多余的氯气)。
溶液的棉花轻轻覆盖住(用于吸收多余的氯气)。
(1)整套装置气密性检查的方法:___________ 。
(2)为了使装置④、⑤中的反应顺利完成,应该控制的反应条件分别为___________ ,___________ 。
(3)装置⑥中能够观察到的实验现象是___________ 。
(4)如果把装置⑥、⑦中的试剂互换位置,还能否证明氧化性: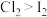 ,
,___________ (填“能”或“不能”),理由是:___________ 。
(5)已知氯酸钾和氯化钾的溶解度曲线如图(a)所示,反应结束后,从装置④中提取氯酸钾晶体的实验操作是___________ 、___________ 、___________ 、___________ 、___________ 。

(6)若采用图(b)所示的装置来制取 。氯气的逸出口是U形管的
。氯气的逸出口是U形管的___________ 端支管口(填“左”或“右”)。
 ;
;
下图为制取氯气、氯酸钾、次氯酸钠和检验氯气性质的微型实验装置:

装置中盛装的药品如下:①多用滴管中装有5mL浓盐酸;②微型具支试管中装有1.5g
 ;③微型具支试管中装有2~3mL浓硫酸;④U形反应管中装有30%KOH溶液;⑤U形反应管中装有
;③微型具支试管中装有2~3mL浓硫酸;④U形反应管中装有30%KOH溶液;⑤U形反应管中装有 NaOH溶液;⑥、⑦双U形反应管中分别装有
NaOH溶液;⑥、⑦双U形反应管中分别装有 淀粉溶液和KBr溶液;⑧尾气出口用浸有
淀粉溶液和KBr溶液;⑧尾气出口用浸有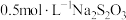 溶液的棉花轻轻覆盖住(用于吸收多余的氯气)。
溶液的棉花轻轻覆盖住(用于吸收多余的氯气)。(1)整套装置气密性检查的方法:
(2)为了使装置④、⑤中的反应顺利完成,应该控制的反应条件分别为
(3)装置⑥中能够观察到的实验现象是
(4)如果把装置⑥、⑦中的试剂互换位置,还能否证明氧化性:
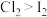 ,
,(5)已知氯酸钾和氯化钾的溶解度曲线如图(a)所示,反应结束后,从装置④中提取氯酸钾晶体的实验操作是

(6)若采用图(b)所示的装置来制取
 。氯气的逸出口是U形管的
。氯气的逸出口是U形管的
您最近一年使用:0次



