1 . 将一定量的氯气通入 热的
热的 浓溶液中,恰好完全反应,溶液中形成
浓溶液中,恰好完全反应,溶液中形成 、
、 和
和 的共存体系。下列判断错误的是
的共存体系。下列判断错误的是
 热的
热的 浓溶液中,恰好完全反应,溶液中形成
浓溶液中,恰好完全反应,溶液中形成 、
、 和
和 的共存体系。下列判断错误的是
的共存体系。下列判断错误的是A.与 反应的氯气一定为 反应的氯气一定为 |
B.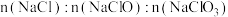 可能为 可能为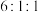 |
C.反应中转移电子物质的量 的范围: 的范围: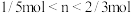 |
D.反应后的溶液中,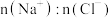 可能为 可能为 |
您最近半年使用:0次
名校
2 . 氯及其化合物在工业生产和人类生活中应用广泛。
(1)实验室利用将氯气通入碱液制备NaClO和 ,装置如图所示:
,装置如图所示:
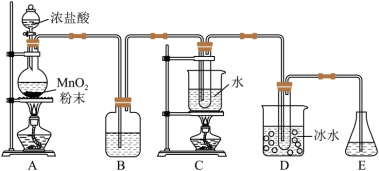
①盛放浓盐酸的仪器名称是______ ,A中发生反应的化学方程式为______ 。
②B的作用是______ 。
③用8.7 g 与足量浓盐酸充分反应,生成
与足量浓盐酸充分反应,生成 的质量为
的质量为______ 。
(2)C中试管内盛放的试剂为______ ,其发生反应反应的离子方程式为:______ 。
(3)实验室可以将氯气通入冷而稀的氢氧化钠溶液获得“84消毒液”,
①制备“84消毒液”的离子方程式______ 。
②空气中喷洒“84消毒液”可以达到对环境消毒的目的,其消毒原理为______ (请结合方程式和文字说明)。
③“84消毒液”与洁厕灵(主要成分为盐酸)混用,会产生黄绿色有毒气体。反应离子方程式为______ 。
④将“84消毒液”与 同时用于织物漂白,效果不佳,原因
同时用于织物漂白,效果不佳,原因______ (用离子方程式表示)。
(4)某同学设计实验探究84消毒液的漂白性。
I.在2 mL 84消毒液中加入2 mL水后,放入红色纸片,观察到纸片慢慢褪色。
II.在2 mL 84消毒液中加入2 mL白醋后,放入红色纸片,观察到纸片迅速褪色。
III.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。
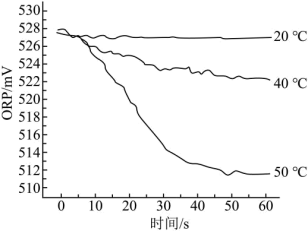
已知:ORP表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
①实验I、II现象不同的原因是为______ 。
②实验III中,随时间的变化ORP值不同的原因可能是______ 。
③针对不同物品的消毒,需将84消毒液稀释到不同的浓度。已知某品牌84消毒液中次氯酸钠的质量分数为12.6%,若取该消毒液100 g,加水稀释为8%的溶液,则需加水的质量为______ g。
(1)实验室利用将氯气通入碱液制备NaClO和
 ,装置如图所示:
,装置如图所示:
①盛放浓盐酸的仪器名称是
②B的作用是
③用8.7 g
 与足量浓盐酸充分反应,生成
与足量浓盐酸充分反应,生成 的质量为
的质量为(2)C中试管内盛放的试剂为
(3)实验室可以将氯气通入冷而稀的氢氧化钠溶液获得“84消毒液”,
①制备“84消毒液”的离子方程式
②空气中喷洒“84消毒液”可以达到对环境消毒的目的,其消毒原理为
③“84消毒液”与洁厕灵(主要成分为盐酸)混用,会产生黄绿色有毒气体。反应离子方程式为
④将“84消毒液”与
 同时用于织物漂白,效果不佳,原因
同时用于织物漂白,效果不佳,原因(4)某同学设计实验探究84消毒液的漂白性。
I.在2 mL 84消毒液中加入2 mL水后,放入红色纸片,观察到纸片慢慢褪色。
II.在2 mL 84消毒液中加入2 mL白醋后,放入红色纸片,观察到纸片迅速褪色。
III.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。

已知:ORP表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
①实验I、II现象不同的原因是为
②实验III中,随时间的变化ORP值不同的原因可能是
③针对不同物品的消毒,需将84消毒液稀释到不同的浓度。已知某品牌84消毒液中次氯酸钠的质量分数为12.6%,若取该消毒液100 g,加水稀释为8%的溶液,则需加水的质量为
您最近半年使用:0次
3 . 用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如下图所示。
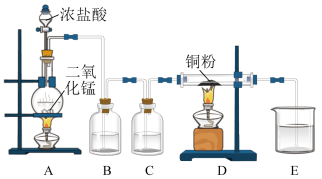
回答下列问题:
(1)写出在A中发生反应的化学方程式为:___________
(2)B中选用的试剂是___________ ,其作用是___________ ;
(3)E中选用的试剂是___________ ,其作用是___________ ;
(4)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是___________
(5)甲同学依次进行了 与①钠、②铜、③氢气、④水反应的实验。上述反应中属于氧化还原反应的是
与①钠、②铜、③氢气、④水反应的实验。上述反应中属于氧化还原反应的是___________ (填序号)。
(6)甲同学探究氯气能否与水发生反应
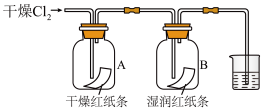
①B中纸条褪色,结合化学方程式解释原因:___________ 。
②装置A的作用是___________ 。
③烧杯中发生反应的化学方程式为___________

回答下列问题:
(1)写出在A中发生反应的化学方程式为:
(2)B中选用的试剂是
(3)E中选用的试剂是
(4)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是
(5)甲同学依次进行了
 与①钠、②铜、③氢气、④水反应的实验。上述反应中属于氧化还原反应的是
与①钠、②铜、③氢气、④水反应的实验。上述反应中属于氧化还原反应的是(6)甲同学探究氯气能否与水发生反应

①B中纸条褪色,结合化学方程式解释原因:
②装置A的作用是
③烧杯中发生反应的化学方程式为
您最近半年使用:0次
名校
4 . 现有氢气与氯气的混合气体0.1mol,经充分反应后,通入60mL 2mol/L的NaOH溶液中,所得溶液中只含有2种溶质,其中NaCl为0.1mol。则原混合气体中氢气的物质的量可能是
| A.0.02mol | B.0.04mol | C.0.06mol | D.0.08mol |
您最近半年使用:0次
2022-04-25更新
|
1333次组卷
|
5卷引用:四川省成都市树德中学2022-2023学年高一上学期期末复习化学试题
四川省成都市树德中学2022-2023学年高一上学期期末复习化学试题上海市七宝中学2021-2022学年高一下学期开学摸底测试化学试题(已下线)第05练 氯及其化合物-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第05练 氯及其化合物-2023年高考化学一轮复习小题多维练(全国通用)上海市洋泾中学2022-2023学年高一上学期期中考试化学试题
名校
5 . 利用 氧化尿素制备
氧化尿素制备 (水合肼)的实验流程如图所示:
(水合肼)的实验流程如图所示: 有强还原性,能与
有强还原性,能与 剧烈反应生成
剧烈反应生成 。
。
下列说法不正确的是
 氧化尿素制备
氧化尿素制备 (水合肼)的实验流程如图所示:
(水合肼)的实验流程如图所示: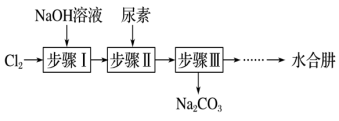
 有强还原性,能与
有强还原性,能与 剧烈反应生成
剧烈反应生成 。
。下列说法不正确的是
| A.步骤Ⅰ中为避免温度过高,可采用冰水浴 |
B.步骤Ⅰ制备 溶液时,测得产物中 溶液时,测得产物中 与 与 的物质的量之比为5∶1,则参与反应的氧化剂与还原剂的物质的量之比为5∶3 的物质的量之比为5∶1,则参与反应的氧化剂与还原剂的物质的量之比为5∶3 |
C.步骤Ⅱ中可将尿素水溶液逐滴滴入 碱性溶液中 碱性溶液中 |
D.生成水合肼反应的离子方程式为ClO﹣+CO(NH2)2+2OH﹣=Cl-+N2H4•H2O+CO |
您最近半年使用:0次
2021-07-24更新
|
1540次组卷
|
9卷引用:四川省成都市树德中学2023-2024学年高一下学期3月月考化学试题
四川省成都市树德中学2023-2024学年高一下学期3月月考化学试题辽宁省铁岭市六校2020-2021学年高二下学期期末联考化学试题山西省运城市2021-2022学年高三上学期期中考试化学试题(已下线)第二章 单元检测-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)2021年北京高考化学试题变式题1-10 河南大学附属中学2022-2023学年高一下学期第一次月考化学试题江苏省南菁高级中学2023-2024学年高一上学期9月阶段性检测化学(创优班)试题江苏省南京市第九中学2023-2024学年高一上学期10月阶段学情调研化学试题江苏省苏州市吴县中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
6 . 某温度下将氯气通入过量 KOH 溶液中,反应后得到 KCl、KClO 和 KClO3的混合溶液。 下列说法中,不正确的是
| A.反应消耗的Cl2与生成的 H2O 的物质的量之比始终为 1:1,与产物组成无关 |
| B.反应消耗的Cl2与 KOH 的物质的量之比取决于反应产物的组成 |
C.若n(ClO-):n( )=11:1,则反应中被还原与被氧化的氯元素的物质的量之比为 4:3 )=11:1,则反应中被还原与被氧化的氯元素的物质的量之比为 4:3 |
D.若n(ClO-):n( )=1:1,则反应消耗的氯气与转移电子数的物质的量之比为 2:3 )=1:1,则反应消耗的氯气与转移电子数的物质的量之比为 2:3 |
您最近半年使用:0次
2020-08-20更新
|
944次组卷
|
5卷引用:四川省泸县第五中学2023-2024学年高三上学期开学考试理综化学试题
四川省泸县第五中学2023-2024学年高三上学期开学考试理综化学试题河南省信阳市罗山县2020届高三毕业班第一次调研化学试题(已下线)小题必刷18 氯及其化合物——2021年高考化学一轮复习小题必刷(通用版)2017年广东和广西高中学生化学竞赛试题(已下线)押新高考卷10题 氧化还原反应-备战2022年高考化学临考题号押题(新高考通版)
7 . 已知:将Cl2通入适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是A.若某温度下,反应后 =11,则溶液中 =11,则溶液中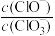 = = |
B.参加反应的氯气的物质的量等于 amol amol |
C.改变温度,反应中转移电子的物质的量ne的范围: amol≤ne≤ amol≤ne≤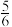 amol amol |
D.改变温度,产物中KC1O3的最大理论产量为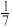 amol amol |
您最近半年使用:0次
2019-01-30更新
|
1790次组卷
|
30卷引用:2016-2017学年四川省成都外国语学校高二上入学考试化学试卷
2016-2017学年四川省成都外国语学校高二上入学考试化学试卷2014年全国普通高等学校招生统一考试理科综合能力测试化学(全国大纲卷)(已下线)2013-2014黑龙江省鹤岗一中高二下学期期末考试化学试卷(已下线)2015届江西省金溪一中高三暑期化学试卷(已下线)2015届甘肃省兰州一中高三9月月考化学试卷(已下线)2015届山西省山西大学附中高三上学期第四次月考化学卷2015届河南省开封市高三冲刺模拟考试(5月)化学试卷2016届湖北省仙桃中学高三8月月考(开学摸底)化学试卷2015-2016学年湖北省襄阳一中高一上学期期中测试化学试卷黑龙江省齐齐哈尔市第八中学2018届高三第二次月考化学试题河北省定州中学2018届高三承智班上学期第二次月考化学试题安徽省六安市第一中学2018届高三上学期第三次月考化学试题【全国百强校】山东师范大学附属中学2017-2018学年高二下学期第八次学分认定(期末)考试化学试题【全国百强校】浙江省萧山中学2018-2019学年高一下学期2月份摸底考试化学试题【全国百强校】山西省山西大学附属中学2018-2019学年高一下学期2月模块诊断化学试题甘肃省甘谷第一中学2018-2019学年高一下学期子才班选拔考试化学试题(已下线)上海市同济中学2017届高三3月月考化学试题黑龙江省鹤岗市第一中学2019-2020学年高一上学期期中考试化学试题山西省应县第一中学校2019-2020学年高一上学期第四次月考化学试题夯基提能2020届高三化学选择题对题专练——氧化还原反应的实际应用(提升练)上海市奉贤区2015届高三上学期期中调研测试化学试题(已下线)小题必刷08 氧化还原反应的规律及应用——2021年高考化学一轮复习小题必刷(通用版)(已下线)【浙江新东方】89.山东省济宁市实验中学2022届高三上学期开学考试化学试题内蒙古海拉尔第二中学2021-2022学年高三上学期第一次阶段考化学试题(已下线)三轮冲刺卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)(已下线)2022年山东省高考真题变式题(单选题)(已下线)第二章 物质的量化学实验基本技能 第8练 化学计算的常用方法上海市黄浦区2015届高三4月模拟考试(二模)化学试题福建省厦门双十中学2023-2024学年高一上学期12月月考化学试题
8 . 以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
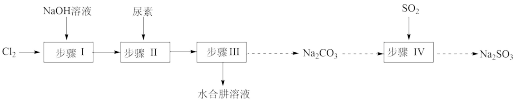
已知:①Cl2+2OH− ClO−+Cl−+H2O是放热反应。
ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________ ;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________ 。
(2)步骤Ⅱ合成N2H4·H2O的装置如图−1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________ ;使用冷凝管的目的是_________________________________ 。

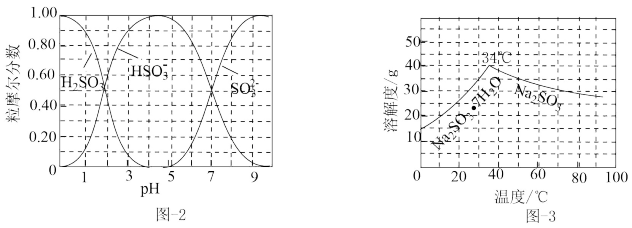
(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、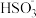 、
、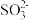 随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________ 。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:_______________________ ,用少量无水乙醇洗涤,干燥,密封包装。

已知:①Cl2+2OH−
 ClO−+Cl−+H2O是放热反应。
ClO−+Cl−+H2O是放热反应。②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为
(2)步骤Ⅱ合成N2H4·H2O的装置如图−1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、
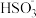 、
、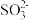 随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:
您最近半年使用:0次
2018-06-10更新
|
6288次组卷
|
17卷引用:四川省射洪县射洪中学2018-2019学年高二上学期开学考试化学试题
四川省射洪县射洪中学2018-2019学年高二上学期开学考试化学试题2018年全国普通高等学校招生统一考试化学(江苏卷)【全国百强校】山西省临汾第一中学2017-2018学年高二下学期期末考试化学试题江西省南昌三中2019届高二下期末考试 化学(已下线)2018年高考题及模拟题汇编 专题15 工艺流程题【全国百强校】河南省实验中学2019届高三上学期质量预测模拟(三)化学试题河南省许昌高级中学2020届高三上学期第一次月考化学试题江西省宜春市万载中学2019-2020学年高二上学期期中考试化学试题(衔接班)河北省石家庄市行唐县三中2020届高三11月月考化学试题甘肃省武威第六中学2020届高三上学期第五次过关考试化学试题2020届高三化学选修4二轮专题练——酸碱中和滴定的曲线分析【精编25题】专题5.2 化学实验的设计与评价(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升河南省洛阳市第一高级中学2021届高三上学期10月月考化学试题(已下线)【一飞冲天】名家原创卷1天津市咸水沽第一中学2023届高三上学期第一次模拟考试化学试题天津西青区2022-2023学年高三上学期期末考试化学试题江苏省南通市通州区金沙中学2022-2023学年高一下学期6月质量监测化学试题
12-13高二上·四川资阳·期末
9 . 氰[(CN)2]为无色可燃气体、剧毒、有苦杏仁味,是拟卤素的一种。拟卤素的性质与卤素相似。
(1)写出氰与苛性钠溶液反应的化学方程式:___________________________________ 。
(2)已知氰分子中键角为180°,分子具有对称性,(CN)2的结构式为____________ ,(CN)2的分子为(填“极性”或“非极性”)________ 分子。
(3)CN-中电子数为_________ 。
(1)写出氰与苛性钠溶液反应的化学方程式:
(2)已知氰分子中键角为180°,分子具有对称性,(CN)2的结构式为
(3)CN-中电子数为
您最近半年使用:0次



