名校
1 . 已知:将一定最的 通入100mL 6
通入100mL 6  NaOH溶液中恰好完全反应,产物中可能有NaCl、NaClO、
NaOH溶液中恰好完全反应,产物中可能有NaCl、NaClO、 ,且
,且 的物质的量浓度与温度高低有关。下列说法正确的是
的物质的量浓度与温度高低有关。下列说法正确的是
 通入100mL 6
通入100mL 6  NaOH溶液中恰好完全反应,产物中可能有NaCl、NaClO、
NaOH溶液中恰好完全反应,产物中可能有NaCl、NaClO、 ,且
,且 的物质的量浓度与温度高低有关。下列说法正确的是
的物质的量浓度与温度高低有关。下列说法正确的是A.反应后溶液中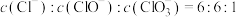 |
B.被氢氧化钠溶液吸收的 的物质的量为1.2mol 的物质的量为1.2mol |
| C.反应中转移的电子的物质的量可能为0.4mol |
D.反应后溶液中 |
您最近半年使用:0次
2023-04-30更新
|
630次组卷
|
4卷引用:黑龙江省大庆铁人中学2023-2024学年高一上学期期末考试化学试题
解题方法
2 . 肼(N2H4)作为火箭发动机的燃料,可通过反应NaClO+2NH3=N2H4+NaCl+H2O制取。某化学兴趣小组尝试在实验室制取N2H4,设计了如图实验:
(1)制备NaClO溶液,装置如图所示。(已知:3Cl2+6NaOH 5NaCl+NaClO3+3H2O)
5NaCl+NaClO3+3H2O)
①仪器A的名称是_____ 。
②连接好装置,装药品之前,必须进行的一项操作是_____ 。
③圆底烧瓶内发生反应的化学方程式为_____ ;当生成71g氯气时,被氧化的HCl为_____ mol,试管内发生反应的离子方程式为______ 。
④饱和食盐水的作用是_____ ,冰水的作用是_____ 。
(2)将NaClO溶液倒入烧杯中,持续通入NH3制取N2H4。通常情况下,1体积水能溶解700体积的氨气,则图装置中漏斗的作用是_____ 。

(3)火箭发射时用N2H4作燃料,用N2O4助燃,燃烧生成两种可参与大气循环的物质,写出该反应的化学方程式_____ 。
(1)制备NaClO溶液,装置如图所示。(已知:3Cl2+6NaOH
 5NaCl+NaClO3+3H2O)
5NaCl+NaClO3+3H2O)
①仪器A的名称是
②连接好装置,装药品之前,必须进行的一项操作是
③圆底烧瓶内发生反应的化学方程式为
④饱和食盐水的作用是
(2)将NaClO溶液倒入烧杯中,持续通入NH3制取N2H4。通常情况下,1体积水能溶解700体积的氨气,则图装置中漏斗的作用是

(3)火箭发射时用N2H4作燃料,用N2O4助燃,燃烧生成两种可参与大气循环的物质,写出该反应的化学方程式
您最近半年使用:0次
名校
解题方法
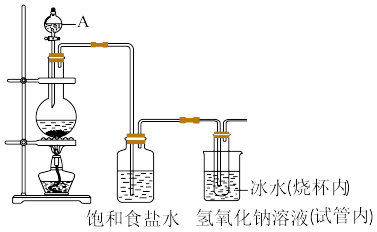
3 . 氯气是一种重要的化工原料,能与多种物质反应。用图所示装置Ⅰ可制取纯净、干燥的氯气,并对其性质进行一系列的实验探究。
回答下列问题:
(1)①装置Ⅰ用于制取纯净、干燥的氯气。其中盛装浓盐酸的仪器名称是________ ,B瓶盛装的液体为________ (写名称)
②实验室利用装置A制氯气,反应的离子方程式是_____________________
(2)利用纯净、干燥的氯气与熔融金属锡反应可制备 ,将装置Ⅰ与装置Ⅱ连接起来可制备
,将装置Ⅰ与装置Ⅱ连接起来可制备 。已知:金属锡熔点为231℃,活泼性与铁相似;
。已知:金属锡熔点为231℃,活泼性与铁相似; 的沸点为114℃;
的沸点为114℃; 易与水反应。
易与水反应。
①装置E的作用是____________________________
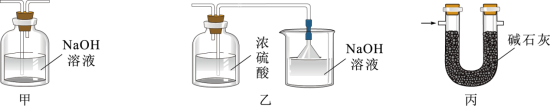
②虚线框可选用下列装置中的_______ (填“甲”“乙”或“丙”)。
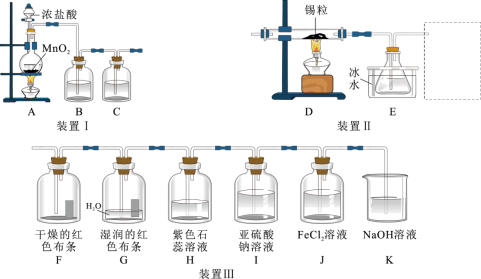
(3)将装置Ⅰ与装置Ⅱ连接起来探究氯气的漂白性及氧化性。
①G中通入 后,观察到的现象是
后,观察到的现象是_________ ,根据F、G现象可得出结论: 无漂白性,
无漂白性, 与水反应生成的
与水反应生成的________ (用化学式填空)有漂白性。
②实验开始后,观察到洗气瓶H中的现象是_______________ -
③装置K的作用是___________ (用化学方程式和相应的文字说明)

回答下列问题:
(1)①装置Ⅰ用于制取纯净、干燥的氯气。其中盛装浓盐酸的仪器名称是
②实验室利用装置A制氯气,反应的离子方程式是
(2)利用纯净、干燥的氯气与熔融金属锡反应可制备
 ,将装置Ⅰ与装置Ⅱ连接起来可制备
,将装置Ⅰ与装置Ⅱ连接起来可制备 。已知:金属锡熔点为231℃,活泼性与铁相似;
。已知:金属锡熔点为231℃,活泼性与铁相似; 的沸点为114℃;
的沸点为114℃; 易与水反应。
易与水反应。①装置E的作用是
②虚线框可选用下列装置中的

(3)将装置Ⅰ与装置Ⅱ连接起来探究氯气的漂白性及氧化性。
①G中通入
 后,观察到的现象是
后,观察到的现象是 无漂白性,
无漂白性, 与水反应生成的
与水反应生成的②实验开始后,观察到洗气瓶H中的现象是
③装置K的作用是
您最近半年使用:0次
名校
解题方法
4 . 二氯异氰尿酸钠(NaC3N3O3Cl2)是一种高效广谱杀菌消毒剂,它常温下为白色固体,难溶于冷水。其制备原理为: 。请选择下列部分装置制备二氯异氰尿酸钠并探究其性质。
。请选择下列部分装置制备二氯异氰尿酸钠并探究其性质。
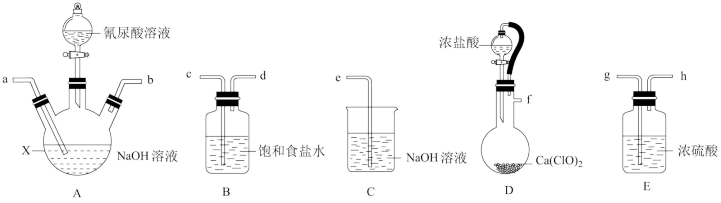
请回答下列问题:
(1)仪器X的名称是___________ 。
(2)装置B的作用是___________ 。
(3)D中发生反应的化学方程式为___________ 。
(4)选择合适装置,按气流从左至右,导管连接顺序为___________ (填字母)。
(5)实验时,先向A中通入氯气,生成高浓度的 溶液后,再加入氰尿酸溶液,并在整个过程中不断通入一定量的氯气,其原因是
溶液后,再加入氰尿酸溶液,并在整个过程中不断通入一定量的氯气,其原因是___________ 。
(6)反应结束后,A中浊液经过滤、___________ 、___________ 得到粗产品mg。
(7)粗产品中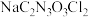 含量测定。将mg粗产品溶于无氧蒸馏水中配制成100mL溶液,取20.00mL所配制溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min。用
含量测定。将mg粗产品溶于无氧蒸馏水中配制成100mL溶液,取20.00mL所配制溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min。用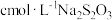 标准溶液进行滴定,加入指示剂,滴定至终点,消耗
标准溶液进行滴定,加入指示剂,滴定至终点,消耗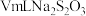 溶液。(假设杂质不与
溶液。(假设杂质不与 反应,涉及的反应为:
反应,涉及的反应为: ,
, )
)
①加入的指示剂是___________ 。
②则 的百分含量为
的百分含量为___________  。(用含m,c,V的代数式表示)
。(用含m,c,V的代数式表示)
 。请选择下列部分装置制备二氯异氰尿酸钠并探究其性质。
。请选择下列部分装置制备二氯异氰尿酸钠并探究其性质。
请回答下列问题:
(1)仪器X的名称是
(2)装置B的作用是
(3)D中发生反应的化学方程式为
(4)选择合适装置,按气流从左至右,导管连接顺序为
(5)实验时,先向A中通入氯气,生成高浓度的
 溶液后,再加入氰尿酸溶液,并在整个过程中不断通入一定量的氯气,其原因是
溶液后,再加入氰尿酸溶液,并在整个过程中不断通入一定量的氯气,其原因是(6)反应结束后,A中浊液经过滤、
(7)粗产品中
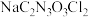 含量测定。将mg粗产品溶于无氧蒸馏水中配制成100mL溶液,取20.00mL所配制溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min。用
含量测定。将mg粗产品溶于无氧蒸馏水中配制成100mL溶液,取20.00mL所配制溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min。用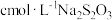 标准溶液进行滴定,加入指示剂,滴定至终点,消耗
标准溶液进行滴定,加入指示剂,滴定至终点,消耗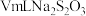 溶液。(假设杂质不与
溶液。(假设杂质不与 反应,涉及的反应为:
反应,涉及的反应为: ,
, )
)①加入的指示剂是
②则
 的百分含量为
的百分含量为 。(用含m,c,V的代数式表示)
。(用含m,c,V的代数式表示)
您最近半年使用:0次
2022-01-23更新
|
1063次组卷
|
4卷引用:黑龙江省哈尔滨市第九中学校2022届高考最后押题卷(一)化学试题
黑龙江省哈尔滨市第九中学校2022届高考最后押题卷(一)化学试题重庆市2022届高三第一次联合诊断测试化学试题重庆市天星桥中学2021-2022学年高三下学期学业质量调研抽测化学试题(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)
名校
5 . 某学生设计如图1实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),据此回答下列问题:
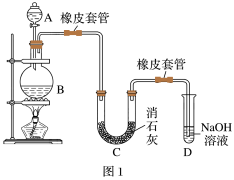
(1)A仪器的名称是___________ ,D的作用是___________ 。
(2)B中发生反应的离子方程式是___________ 。
(3)漂白粉将在U形管中产生,其反应的化学方程式是___________ 。
(4)此实验结果所得Ca(ClO)2产率太低。经分析并查阅资料发现主要原因是在U形管中存在两个副反应。
①温度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是___________ ,有同学测出了反应后溶液中ClO-、ClO 两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为如图2(不考虑氯气和水的反应)。
两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为如图2(不考虑氯气和水的反应)。

a.图2中曲线Ⅰ表示___________ 的物质的量随反应时间变化的关系。
b.所取石灰乳中含有Ca(OH)2的物质的量为___________ mol。
c.另取一份含有等物质的量的Ca(OH)2石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37 mol,则产物中n(ClO-)∶n(ClO )=
)=___________ 。
②试判断另一个副反应是(写出此反应的化学方程式)___________ 。改进措施是___________ 。

(1)A仪器的名称是
(2)B中发生反应的离子方程式是
(3)漂白粉将在U形管中产生,其反应的化学方程式是
(4)此实验结果所得Ca(ClO)2产率太低。经分析并查阅资料发现主要原因是在U形管中存在两个副反应。
①温度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是
 两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为如图2(不考虑氯气和水的反应)。
两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为如图2(不考虑氯气和水的反应)。
a.图2中曲线Ⅰ表示
b.所取石灰乳中含有Ca(OH)2的物质的量为
c.另取一份含有等物质的量的Ca(OH)2石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37 mol,则产物中n(ClO-)∶n(ClO
 )=
)=②试判断另一个副反应是(写出此反应的化学方程式)
您最近半年使用:0次
名校
解题方法
6 . 一定温度下,将 缓缓通入一定浓度的
缓缓通入一定浓度的 溶液中,至两者恰好完全反应,生成物中有三种含氯的离子,其中
溶液中,至两者恰好完全反应,生成物中有三种含氯的离子,其中 和
和 两种离子的物质的量(n)与时间(t)的关系如图所示。下列说法正确的是
两种离子的物质的量(n)与时间(t)的关系如图所示。下列说法正确的是

 缓缓通入一定浓度的
缓缓通入一定浓度的 溶液中,至两者恰好完全反应,生成物中有三种含氯的离子,其中
溶液中,至两者恰好完全反应,生成物中有三种含氯的离子,其中 和
和 两种离子的物质的量(n)与时间(t)的关系如图所示。下列说法正确的是
两种离子的物质的量(n)与时间(t)的关系如图所示。下列说法正确的是
A.溶液中 |
B.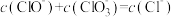 |
C.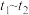 仅发生反应 仅发生反应 |
D.原 溶液中, 溶液中,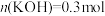 |
您最近半年使用:0次
2021-01-05更新
|
1442次组卷
|
9卷引用:黑龙江省齐齐哈尔市2020-2021学年高一上学期期末考试化学试题
黑龙江省齐齐哈尔市2020-2021学年高一上学期期末考试化学试题黑龙江省牡丹江市第一高级中学2022-2023学年高一上学期11月期中考试化学试题黑龙江省牡丹江市第一高级中学2022-2023学年高一上学期11月期中考试化学试题山西省晋城市(高平一中、阳城一中、高平实验中学)2020-2021学年高一下学期开学考试化学试题辽宁省实验中学2021-2022学年高一上学期11月期中阶段测试化学试题吉林省长春外国语学校2021-2022学年高一下学期期初考试化学试题吉林省四平市第一高级中学2023-2024学年高一上学期第二次月考化学试题江苏省无锡市辅仁高级中学2023-2024学年高一上学期期末复习化学模块综合试卷(一)甘肃省武威市民勤县第一中学2023-2024学年高一下学期开学考试化学试题
名校
解题方法
7 . 在标准状况下H2和Cl2的混合气体aL,经光照反应后,所得气体恰好使bmolNaOH完全转化成盐,a与b的关系不可能的是( )
A.b= | B.b> | C.b< | D.b⩾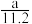 |
您最近半年使用:0次
2020-12-09更新
|
630次组卷
|
11卷引用:黑龙江省哈尔滨市第六中学校2021届高三上学期开学考试化学试题
黑龙江省哈尔滨市第六中学校2021届高三上学期开学考试化学试题(已下线)2010年江西省修水一中高三上学期第一次月考化学试题(已下线)2011-2012学年福建省厦门一中高一上学期期中化学试卷上海市华东师大第一附属中学2017—2018学年高一上学期期中考试化学试题上海交通大学附属中学2016-2017学年高一上学期期中考试化学试题2(已下线)上海市建平中学2014-2015学年高一上学期期中考试化学试题甘肃省天水市甘谷县第四中学2021届高三上学期第二次检测化学试题吉林乾安县第七中学2020-2021学年高一上学期第二次质量检测化学试题上海市向明中学2020-2021学年高一上学期期中考试化学试题上海市吴淞中学2020-2021学年高一上学期期中考试化学试题【2022】【高一上】【学军紫金港】【期中考】【高中化学】【李雪收集】
名校
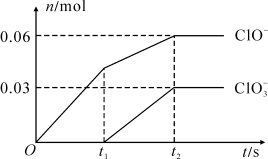
8 . 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是
 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是
| A.原溶液中KOH的物质的量是0.3 mol |
B. 的生成是由氯气的量的多少引起的 的生成是由氯气的量的多少引起的 |
| C.反应中转移电子的物质的量是0.21 mol |
D.依据图象,总的离子反应方程式为10OH-+5Cl2=2C1O-+ +7Cl-+5H2O +7Cl-+5H2O |
您最近半年使用:0次
2020-10-10更新
|
942次组卷
|
4卷引用:黑龙江省大庆实验中学2021届高三上学期第一次月考化学试题
名校
解题方法
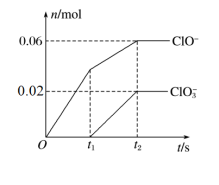
9 . 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有3种含氯元素的离子,其中ClO-和ClO 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
| A.苛性钾中KOH的物质的量为0.24mol |
| B.反应中转移电子的物质的量是0.21mol |
| C.有2.688L氯气参与反应 |
D.酸性条件下ClO-和ClO 可生成Cl2 可生成Cl2 |
您最近半年使用:0次
名校
解题方法
10 . 某研究性学习小组查阅资料:“氯气与硫在加热条件下生成二氯化硫(S2Cl2),该物质遇水迅速反应,他们利用如下仪器和药品制取纯净的氯气与硫反应来制备S2Cl2

实验过程所提供的药品有:浓盐酸、浓H2SO4、MnO2、KMnO4(H+)、饱和NaHCO3溶液、碱石灰、硫磺、NaOH溶液、冰水、饱和食盐水。
回答下列问题:
(1)利用所提供的设备和药品,写出制备Cl2的离子方程式:________________
(2)在该实验过程中两次用到仪器B,第一次装置B中的药品是____________ ,第二次装置B的作用是____________________________________________________ 。
(3)能否省略装置C________ (填“能”或“否”),原因是_________________________________ 。
(4)实验开始后,当_______________________________________________ ,(填现象)点燃D处的酒精灯。
(5)某学生利用装置A制备一定量的Cl2,他收集到的Cl2的体积总比预期的要多,他经过认真分析后,认为应对装置A略作改进,你认为怎样改进:_____________________

实验过程所提供的药品有:浓盐酸、浓H2SO4、MnO2、KMnO4(H+)、饱和NaHCO3溶液、碱石灰、硫磺、NaOH溶液、冰水、饱和食盐水。
回答下列问题:
(1)利用所提供的设备和药品,写出制备Cl2的离子方程式:
(2)在该实验过程中两次用到仪器B,第一次装置B中的药品是
(3)能否省略装置C
(4)实验开始后,当
(5)某学生利用装置A制备一定量的Cl2,他收集到的Cl2的体积总比预期的要多,他经过认真分析后,认为应对装置A略作改进,你认为怎样改进:
您最近半年使用:0次
2020-03-06更新
|
354次组卷
|
2卷引用:哈尔滨市第六中学校2021-2022学年高一上学期期末考试化学试题



