22-23高三上·山东潍坊·阶段练习
解题方法
1 . 某小组同学探究不同条件下氯气与二价锰化合物的反应
资料:i. 在一定条件下被
在一定条件下被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
ii.浓碱条件下, 可被
可被 还原为
还原为 。
。
iii. 的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)
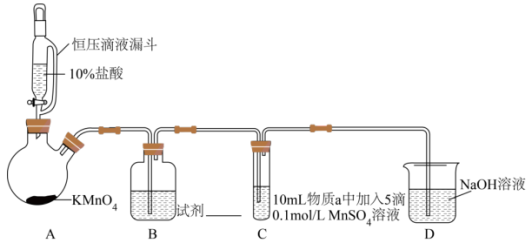
(1)通入 前,II、III中沉淀由白色变为黑色的化学方程式为
前,II、III中沉淀由白色变为黑色的化学方程式为_______ 。
(2)对比实验I、II通入 后的实验现象,对于二价锰化合物还原性的认识是
后的实验现象,对于二价锰化合物还原性的认识是_______ 。
(3)根据资料ⅱ,III中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入 发生反应
发生反应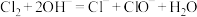 ,导致溶液的碱性减弱。但通过实验测定溶液的碱性变化很小。
,导致溶液的碱性减弱。但通过实验测定溶液的碱性变化很小。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①取III中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_______ ,溶液绿色缓慢加深,原因是 被
被_______ (填“化学式”)氧化,可证明III的悬浊液中氧化剂过量;
②取II中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生的反应是_______ 。
③从反应速率的角度,分析实验III未得到绿色溶液的可能原因_______ 。
资料:i.
 在一定条件下被
在一定条件下被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。ii.浓碱条件下,
 可被
可被 还原为
还原为 。
。iii.
 的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。实验装置如图(夹持装置略)

| 序号 | 物质a | C中实验现象 | |
通入 前 前 | 通入 后 后 | ||
| I | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| II | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| III | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
 前,II、III中沉淀由白色变为黑色的化学方程式为
前,II、III中沉淀由白色变为黑色的化学方程式为(2)对比实验I、II通入
 后的实验现象,对于二价锰化合物还原性的认识是
后的实验现象,对于二价锰化合物还原性的认识是(3)根据资料ⅱ,III中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入
 发生反应
发生反应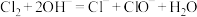 ,导致溶液的碱性减弱。但通过实验测定溶液的碱性变化很小。
,导致溶液的碱性减弱。但通过实验测定溶液的碱性变化很小。原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①取III中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
 被
被②取II中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生的反应是
③从反应速率的角度,分析实验III未得到绿色溶液的可能原因
您最近一年使用:0次
2022·全国·模拟预测
解题方法
2 . 84消毒液(有效成分为NaClO)和双氧水是常态抗疫常用的家用消毒剂。
(1)实验室用Cl2和NaOH溶液制备84消毒液,其反应离子方程式为____ 。
(2)某研究小组用浓盐酸与MnO2混合加热制备氯气,当发现氯气不再逸出时,固液混合物中仍有盐酸和MnO2。反应结束后仍有盐酸和MnO2的原因是____ 。若将该反应过程用电极反应表示,还原反应为____ 。
(3)在研兖物质性质时,研究小组向盛有2mL84消毒液的试管中,逐滴加入10%的双氧水,发现有大量的气泡产生,对此作出以下猜测。
猜测1:双氧水与消毒液发生反应产生气体。
猜测2:____。
①请设计实验证明产生的气体为氧气:____ 。
②猜测2可能为____ 。
③为了验证猜想,设计用如图装置进行实验,注射器中装有20mL10%的双氧水,锥形瓶中装有25mL84消毒液,分5次注入双氧水,产生气体的体积如表所示。
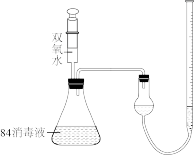
④V=____ ;通过实验得出猜想1正确,其判断依据为____ ;二者发生反应的化学方程式为____ 。
(1)实验室用Cl2和NaOH溶液制备84消毒液,其反应离子方程式为
(2)某研究小组用浓盐酸与MnO2混合加热制备氯气,当发现氯气不再逸出时,固液混合物中仍有盐酸和MnO2。反应结束后仍有盐酸和MnO2的原因是
(3)在研兖物质性质时,研究小组向盛有2mL84消毒液的试管中,逐滴加入10%的双氧水,发现有大量的气泡产生,对此作出以下猜测。
猜测1:双氧水与消毒液发生反应产生气体。
猜测2:____。
①请设计实验证明产生的气体为氧气:
②猜测2可能为
③为了验证猜想,设计用如图装置进行实验,注射器中装有20mL10%的双氧水,锥形瓶中装有25mL84消毒液,分5次注入双氧水,产生气体的体积如表所示。

| 次数 | 注入双氧水的体积/mL | 产生气体的总体积/mL |
| 第1次 | 4 | 125 |
| 第2次 | 4 | 250 |
| 第3次 | 4 | 325 |
| 第4次 | 4 | V |
| 第5次 | 4 | 333 |
您最近一年使用:0次
2020·河北·一模
解题方法
3 . 硫代硫酸钠晶体(Na2S2O3·5H2O)具有脱敏作用,临床上用于氰化物及腈类中毒,它又名“大苏打”、“海波”,易溶于水,难溶于乙醇,水溶液呈微弱的碱性,遇强酸发生剧烈反应。某化学兴趣小组通过查阅资料,对它的制备和性质进行了探究,研究过程如下:
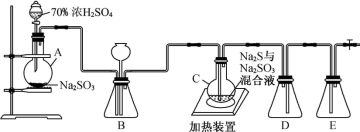
请回答下列问题:
Ⅰ.Na2S2O3的制备:已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)
S(s)+Na2SO3(aq) Na2S2O3(aq)
Na2S2O3(aq)
(1)装置A中发生的化学反应方程式为___________ 。
(2)装置B中盛放浓硫酸,除干燥气体外,还起到的作用有___________ 。
(3)C装置中放入无水乙醇的目的是___________ 。
Ⅱ.测定产品(Na2S2O3·5H2O)的纯度。该小组同学称取m g该产品,用容量瓶配成250 mL溶液。另取c mol·L-1的K2Cr2O7标准溶液V mL,用硫酸酸化后加入过量KI,再加入几滴淀粉溶液,然后用硫代硫酸钠样品溶液滴定至蓝色褪去,且30 s不恢复原色。平行滴定3次所得测定数据如下表:
(4)已知滴定过程中发生的反应: 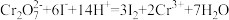 ;
;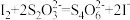 。则样品纯度为
。则样品纯度为___________ (写出化简后表达式)。
Ⅲ.探究硫代硫酸钠(Na2S2O3)在化工上作脱氯剂的原理。下面是该兴趣小组利用制得的硫代硫酸钠样品模拟脱氯的实验装置,回答下列问题:

注:Ksp[BaS2O3]=6.96×10-11
(5)若要证明硫代硫酸钠可以作为脱氯剂,还需要补充的实验操作是___________ 。
(6)装置D作用是吸收Cl2,实验后检测到该溶液中含有ClO-、 等离子,则c(H+)-c(OH-)=
等离子,则c(H+)-c(OH-)=___________ ,若D中ClO-与 的物质的量之比为5︰1,则Cl2与NaOH的离子反应方程式为
的物质的量之比为5︰1,则Cl2与NaOH的离子反应方程式为___________ 。

请回答下列问题:
Ⅰ.Na2S2O3的制备:已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)
S(s)+Na2SO3(aq)
 Na2S2O3(aq)
Na2S2O3(aq)(1)装置A中发生的化学反应方程式为
(2)装置B中盛放浓硫酸,除干燥气体外,还起到的作用有
(3)C装置中放入无水乙醇的目的是
Ⅱ.测定产品(Na2S2O3·5H2O)的纯度。该小组同学称取m g该产品,用容量瓶配成250 mL溶液。另取c mol·L-1的K2Cr2O7标准溶液V mL,用硫酸酸化后加入过量KI,再加入几滴淀粉溶液,然后用硫代硫酸钠样品溶液滴定至蓝色褪去,且30 s不恢复原色。平行滴定3次所得测定数据如下表:
| 实验序号 | 1 | 2 | 3 |
| 消耗样品溶液体积/mL | 24.79 | 22.30 | 24.81 |
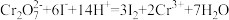 ;
;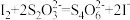 。则样品纯度为
。则样品纯度为Ⅲ.探究硫代硫酸钠(Na2S2O3)在化工上作脱氯剂的原理。下面是该兴趣小组利用制得的硫代硫酸钠样品模拟脱氯的实验装置,回答下列问题:

注:Ksp[BaS2O3]=6.96×10-11
(5)若要证明硫代硫酸钠可以作为脱氯剂,还需要补充的实验操作是
(6)装置D作用是吸收Cl2,实验后检测到该溶液中含有ClO-、
 等离子,则c(H+)-c(OH-)=
等离子,则c(H+)-c(OH-)= 的物质的量之比为5︰1,则Cl2与NaOH的离子反应方程式为
的物质的量之比为5︰1,则Cl2与NaOH的离子反应方程式为
您最近一年使用:0次
2020·北京石景山·一模
名校
解题方法
4 . “84消毒液”广泛应用于杀菌消毒,其有效成分是NaClO。实验小组制备消毒液,并利用其性质探索制备碘水的方法。
资料:i.HClO的电离常数为Ka=4.7×10-8;
H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11。
ii.碘的化合物主要以I-和IO3-的形式存在,IO3-+5I-+6H+=3I2+3H2O。
iii.碘单质能与I-反应:I2+I- I3-(I3-低浓度时显黄色,高浓度时为棕色)。
I3-(I3-低浓度时显黄色,高浓度时为棕色)。
Ⅰ.制备消毒液(夹持装置略)
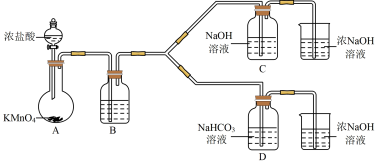
(1)制备NaClO消毒液的装置是__________ (填C或D)。
(2)制备完成后,向C装置的溶液中添加NaOH、Na2SiO3等物质,得到与某品牌成分相同的消毒液,用平衡移动原理解释NaOH的作用___________________ 。
(3)结合资料i,写出D中反应的化学方程式______________________ 。
Ⅱ.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
(4)对比不同方案的实验现象,得出制取碘水的最佳方法要关注的因素是________ 。
(5)针对烧杯3“滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:过量的NaClO将反应生成的I2氧化为IO3-。
设计实验证实了假设1成立。NaClO氧化I2生成IO3-的离子方程式是_____________ 。
假设2:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设2成立,实验a的操作及现象是______________________ 。
(6)某小组检验烧杯3所得溶液中含IO3-:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在IO3-,说明理由______________________ 。
(7)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据________ 。
资料:i.HClO的电离常数为Ka=4.7×10-8;
H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11。
ii.碘的化合物主要以I-和IO3-的形式存在,IO3-+5I-+6H+=3I2+3H2O。
iii.碘单质能与I-反应:I2+I-
 I3-(I3-低浓度时显黄色,高浓度时为棕色)。
I3-(I3-低浓度时显黄色,高浓度时为棕色)。Ⅰ.制备消毒液(夹持装置略)

(1)制备NaClO消毒液的装置是
(2)制备完成后,向C装置的溶液中添加NaOH、Na2SiO3等物质,得到与某品牌成分相同的消毒液,用平衡移动原理解释NaOH的作用
(3)结合资料i,写出D中反应的化学方程式
Ⅱ.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
| 方案 | 操作 | 现象 | 反应后加淀粉溶液 |
| 1 | 烧杯1溶液中加入9gKI固体 | 溶液为橙黄色 | …… |
| 2 | 烧杯2溶液中加入9gKI固体再加入1mo/L盐酸10mL | 溶液颜色快速加深,呈紫红色 | 变蓝 |
| 3 | 烧杯3溶液中加入少量KI固体(小于0.5g) | 振荡后溶液保持无色 | 不变蓝 |
(5)针对烧杯3“滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:过量的NaClO将反应生成的I2氧化为IO3-。
设计实验证实了假设1成立。NaClO氧化I2生成IO3-的离子方程式是
假设2:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设2成立,实验a的操作及现象是
(6)某小组检验烧杯3所得溶液中含IO3-:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在IO3-,说明理由
(7)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据
您最近一年使用:0次
2020-05-07更新
|
449次组卷
|
4卷引用:北京市2019-2020学年高三各区一模化学考试分类汇编:科学探究
(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编:科学探究北京市石景山区2020届高三第一次模拟化学试题北京首都师范大学附属中学2022届高三下学期三模化学试题北京市第八十中学2024届高三上学期10月月考化学试题
2024·广东汕头·一模
名校
解题方法
5 . 微观探析是认识物质的一种途径。设 为阿伏加德罗常数,下列有关说法正确的是
为阿伏加德罗常数,下列有关说法正确的是
 为阿伏加德罗常数,下列有关说法正确的是
为阿伏加德罗常数,下列有关说法正确的是A.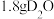 中含有的中子数目为 中含有的中子数目为 |
B.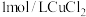 溶液中含有 溶液中含有 的数目小于 的数目小于 |
C.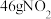 与 与 的混合物中含有的分子数为 的混合物中含有的分子数为 |
D.25℃,101kPa, 与NaOH溶液完全反应,转移电子数目为 与NaOH溶液完全反应,转移电子数目为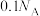 |
您最近一年使用:0次
2024-03-06更新
|
873次组卷
|
4卷引用:选择题11-16
2023·北京顺义·二模
名校
6 . 氯化亚铜(CuCl)是白色粉末,微溶于水,广泛应用于化工和印染等行业。某研究性学习小组模拟热分解CuCl2•2H2O制备CuCl的过程,并进行相关物质转化的探究。
已知:酸性条件下Cu+不稳定

下列说法不正确的是
已知:酸性条件下Cu+不稳定

下列说法不正确的是
| A.X气体是HCl,可抑制CuCl2•2H2O加热时水解 |
| B.途径1中产生的Cl2可以回收利用,也可以通入饱和NaOH溶液中除去 |
C.途径2中200℃时反应的化学方程式为Cu2(OH)2Cl2 2CuO+2HCl↑ 2CuO+2HCl↑ |
D.CuCl与稀硫酸反应的离子方程式为2Cu++4H++SO =2Cu2++SO2↑+2H2O =2Cu2++SO2↑+2H2O |
您最近一年使用:0次
2023-04-12更新
|
1048次组卷
|
7卷引用:专题10 物质的反应及转化
(已下线)专题10 物质的反应及转化北京市顺义区2023届高三下学期第二次化学统练题(已下线)第07练 元素及其化合物基础知识和应用 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)北京师范大学附属实验中学2023-2024学年暑期高三第一次督导化学试题江西省丰城中学2023-2024学年高三上学期开学考试化学试题河南省中原名校联盟2024届高三上学期9月调研考试化学试题陕西省西安市长安区第一中学2023-2024学年高三上学期第三次教学质量检测(期中)化学试题
21-22高三上·河北邢台·阶段练习
解题方法
7 . 将 通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应放热),生成物中有三种含氯元素的离子,其中
通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应放热),生成物中有三种含氯元素的离子,其中 和
和 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是
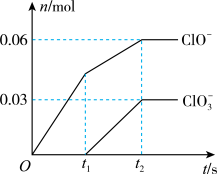
 通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应放热),生成物中有三种含氯元素的离子,其中
通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应放热),生成物中有三种含氯元素的离子,其中 和
和 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是
A. 和苛性钾溶液在不同温度下可能发生不同反应 和苛性钾溶液在不同温度下可能发生不同反应 |
B.原苛性钾溶液中 的物质的量无法确定 的物质的量无法确定 |
C.反应中转移电子数为 |
D.生成物中 的物质的量为 的物质的量为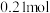 |
您最近一年使用:0次
2021-09-29更新
|
1229次组卷
|
6卷引用:专题02 卤素元素拓展之实验大题-【微专题·大素养】备战2022年高考化学核心突破(元素拓展综合题)
(已下线)专题02 卤素元素拓展之实验大题-【微专题·大素养】备战2022年高考化学核心突破(元素拓展综合题)河北省邢台市2022届高三9月第二次联合考试化学试题山东省济南市商河县第三中学2022届高三10月月考化学试题河南省南阳市2022-2023学年高一上学期1月期末考试化学试题安徽省阜阳市阜南县2022-2023学年高一上学期期末联考化学试题(已下线)专项02 离子反应和氧化还原反应的应用-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
2020·河南信阳·一模
名校
解题方法
8 . 某温度下将氯气通入过量 KOH 溶液中,反应后得到 KCl、KClO 和 KClO3的混合溶液。 下列说法中,不正确的是
| A.反应消耗的Cl2与生成的 H2O 的物质的量之比始终为 1:1,与产物组成无关 |
| B.反应消耗的Cl2与 KOH 的物质的量之比取决于反应产物的组成 |
C.若n(ClO-):n( )=11:1,则反应中被还原与被氧化的氯元素的物质的量之比为 4:3 )=11:1,则反应中被还原与被氧化的氯元素的物质的量之比为 4:3 |
D.若n(ClO-):n( )=1:1,则反应消耗的氯气与转移电子数的物质的量之比为 2:3 )=1:1,则反应消耗的氯气与转移电子数的物质的量之比为 2:3 |
您最近一年使用:0次
2020-08-20更新
|
946次组卷
|
5卷引用:小题必刷18 氯及其化合物——2021年高考化学一轮复习小题必刷(通用版)
(已下线)小题必刷18 氯及其化合物——2021年高考化学一轮复习小题必刷(通用版)(已下线)押新高考卷10题 氧化还原反应-备战2022年高考化学临考题号押题(新高考通版)河南省信阳市罗山县2020届高三毕业班第一次调研化学试题2017年广东和广西高中学生化学竞赛试题四川省泸县第五中学2023-2024学年高三上学期开学考试理综化学试题
20-21高三上·陕西西安·阶段练习
名校
解题方法
9 . 某温度下将氯气通入过量 KOH 溶液中,反应后得到 KCl、KClO 和 KClO3的混合溶液。下列说法中,不正确的是
| A.反应消耗的Cl2与生成的 H2O 的物质的量之比始终为 1∶1,与产物组成无关 |
B.若n(ClO-)∶n (ClO )=1∶1,则反应消耗的氯气与转移电子数的物质的量之比为 2∶3 )=1∶1,则反应消耗的氯气与转移电子数的物质的量之比为 2∶3 |
C.若n(ClO-)∶n(ClO )=11∶1,则反应中被还原与被氧化的氯元素的物质的量之比为 4∶3 )=11∶1,则反应中被还原与被氧化的氯元素的物质的量之比为 4∶3 |
| D.反应消耗的Cl2与 KOH 的物质的量之比取决于反应产物的组成 |
您最近一年使用:0次
2020-12-15更新
|
763次组卷
|
5卷引用:解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练
(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点09 氯及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点09 氯及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)陕西省西安市长安区第一中学2021届高三上学期第二次月考化学试题
10 . 已知:将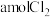 通入含
通入含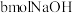 的溶液中两者恰好完全反应,产物中可能有NaCl、NaClO、
的溶液中两者恰好完全反应,产物中可能有NaCl、NaClO、 。温度不同,三者的量也不同。下列说法
。温度不同,三者的量也不同。下列说法不正确 的是
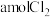 通入含
通入含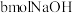 的溶液中两者恰好完全反应,产物中可能有NaCl、NaClO、
的溶液中两者恰好完全反应,产物中可能有NaCl、NaClO、 。温度不同,三者的量也不同。下列说法
。温度不同,三者的量也不同。下列说法A.改变温度,当产物中 的物质的量最大时,发生的离子反应为: 的物质的量最大时,发生的离子反应为: |
B.某温度下,反应后若溶液中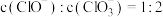 ,发生的离子反应为: ,发生的离子反应为: |
C.参加反应的 与NaOH的物质的量关系一定是 与NaOH的物质的量关系一定是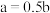 |
D.改变温度,反应中转移电子的物质的量可能为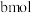 |
您最近一年使用:0次



