名校
解题方法
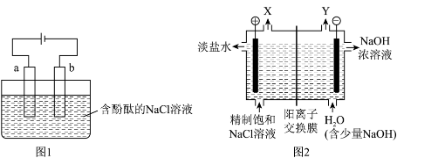
1 . 实验室用石墨电极电解加有酚酞的饱和NaCl溶液,装置如图1所示。氯碱工业用图2所示装置制备NaOH等工业原料。
(1)a为电解池的_____ 极,a处的电极反应式为________ 。
(2)该电解池中发生的总反应的化学方程式为____________ 。
(3)下列与电解饱和食盐水有关的说法,正确的是________ (填字母)。
A.通电使NaCl发生电离
B.在溶液中,阴离子向电极a移动
C.a电极附近溶液变红
Ⅱ.利用实验室装置制备NaOH,不仅有安全隐患,而且存在Cl2与NaOH的副反应,氯碱工业采用改进后的装置,如上图2所示。
(4)气体X和气体Y被阳离子交换膜分隔开,避免混合爆炸。气体X是______ ,气体Y是____ 。
(5)阳离子交换膜避免了Cl2与NaOH发生反应,写出Cl2 与NaOH常温下反应的离子方程式__________ 。
(6)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3混合溶液,经测定ClO-、 的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原与被氧化的氯元素的物质的量之比为_____。
的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原与被氧化的氯元素的物质的量之比为_____。
(1)a为电解池的
(2)该电解池中发生的总反应的化学方程式为
(3)下列与电解饱和食盐水有关的说法,正确的是
A.通电使NaCl发生电离
B.在溶液中,阴离子向电极a移动
C.a电极附近溶液变红
Ⅱ.利用实验室装置制备NaOH,不仅有安全隐患,而且存在Cl2与NaOH的副反应,氯碱工业采用改进后的装置,如上图2所示。
(4)气体X和气体Y被阳离子交换膜分隔开,避免混合爆炸。气体X是
(5)阳离子交换膜避免了Cl2与NaOH发生反应,写出Cl2 与NaOH常温下反应的离子方程式
(6)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3混合溶液,经测定ClO-、
 的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原与被氧化的氯元素的物质的量之比为_____。
的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原与被氧化的氯元素的物质的量之比为_____。| A.21:5 | B.4:1 | C.3:1 | D.11:3 |
您最近一年使用:0次
解题方法
2 . 按要求,回答下列问题:
(1)实验室用二氧化锰和浓盐酸反应制取氯气,反应的离子方程式是___________ 。
(2)氯气可用湿润的淀粉碘化钾试纸检验,请用化学方程式解释原因:___________ 。
(3)由于氯气贮存运输不方便,工业上常将氯气转化为漂白粉,工业上生产漂白粉的主要化学方程式是___________ 。
(4)家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是___________。
(5)某同学在探究漂白粉溶液性质时,在漂白粉溶液中加入几滴无色酚酞溶液,发现溶液呈红色,随后溶液迅速褪色,说明漂白粉溶液呈___________ 性,并具有___________ 性。
(6)实验室也可用 固体和浓盐酸反应制氯气,反应方程式如下:
固体和浓盐酸反应制氯气,反应方程式如下: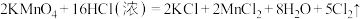 ,若反应中有0.5mol电子转移,被氧化HCl的物质的量为
,若反应中有0.5mol电子转移,被氧化HCl的物质的量为___________ 。
(1)实验室用二氧化锰和浓盐酸反应制取氯气,反应的离子方程式是
(2)氯气可用湿润的淀粉碘化钾试纸检验,请用化学方程式解释原因:
(3)由于氯气贮存运输不方便,工业上常将氯气转化为漂白粉,工业上生产漂白粉的主要化学方程式是
(4)家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是___________。
| A.食醋 | B.食盐 | C.烧碱 | D.纯碱 |
(6)实验室也可用
 固体和浓盐酸反应制氯气,反应方程式如下:
固体和浓盐酸反应制氯气,反应方程式如下: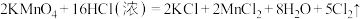 ,若反应中有0.5mol电子转移,被氧化HCl的物质的量为
,若反应中有0.5mol电子转移,被氧化HCl的物质的量为
您最近一年使用:0次
名校
解题方法
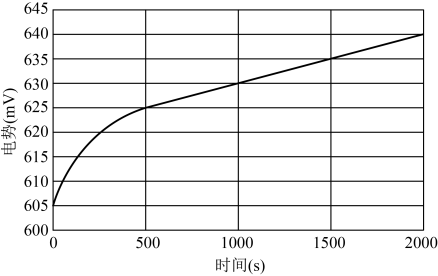
3 . 将漂粉精配成一定浓度的溶液,并将溶液放置在空气中一段时间。在此过程中测定溶液的氧化还原电势变化如图所示。(已知:氧化还原电势越大,氧化性越强。)___________ 。
您最近一年使用:0次
名校
解题方法
4 . 含氯消毒剂在生产生活中被广泛用于杀菌、消毒和漂白。
(1)氯水具有漂白性,其中起漂白作用的物质是____________ (填化学式)。
(2)氯水需要避光保存,原因是__________ 。
(3)通常将Cl2与NaOH或 反应制成便于保存的消毒液或漂白粉。Cl2与NaOH溶液反应的离子方程式为
反应制成便于保存的消毒液或漂白粉。Cl2与NaOH溶液反应的离子方程式为___________ 。
(4)漂白粉[成分为 、
、 和CaCl2]可用于鱼塘的消毒,防治水生生物细菌性疾病。使用注意事项如下:
和CaCl2]可用于鱼塘的消毒,防治水生生物细菌性疾病。使用注意事项如下:
a.不宜用金属容器盛装
b.勿与酸性物质混用
c.水体中铵盐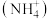 含量高,使用时产生NH3
含量高,使用时产生NH3
d.水体中亚硝酸盐(NO2)含量高,会降低其消毒效果
①注意事项a说明漂白粉具有____________ 性。
②为了验证注意事项b,向漂白粉中滴加稀硫酸,产生黄绿色气体,被还原的微粒是____________ ,作还原剂的微粒是_____________ 。
③注意事项c中NH3产生的原因是____________ (用离子方程式表示)。
④从物质性质的角度解释注意事项d中漂白粉消毒效果降低的原因____________ 。(已知 浓度较高的鱼塘使用漂白粉,会使水中
浓度较高的鱼塘使用漂白粉,会使水中 含量升高,池水富营养化。)
含量升高,池水富营养化。)
(1)氯水具有漂白性,其中起漂白作用的物质是
(2)氯水需要避光保存,原因是
(3)通常将Cl2与NaOH或
 反应制成便于保存的消毒液或漂白粉。Cl2与NaOH溶液反应的离子方程式为
反应制成便于保存的消毒液或漂白粉。Cl2与NaOH溶液反应的离子方程式为(4)漂白粉[成分为
 、
、 和CaCl2]可用于鱼塘的消毒,防治水生生物细菌性疾病。使用注意事项如下:
和CaCl2]可用于鱼塘的消毒,防治水生生物细菌性疾病。使用注意事项如下:a.不宜用金属容器盛装
b.勿与酸性物质混用
c.水体中铵盐
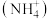 含量高,使用时产生NH3
含量高,使用时产生NH3d.水体中亚硝酸盐(NO2)含量高,会降低其消毒效果
①注意事项a说明漂白粉具有
②为了验证注意事项b,向漂白粉中滴加稀硫酸,产生黄绿色气体,被还原的微粒是
③注意事项c中NH3产生的原因是
④从物质性质的角度解释注意事项d中漂白粉消毒效果降低的原因
 浓度较高的鱼塘使用漂白粉,会使水中
浓度较高的鱼塘使用漂白粉,会使水中 含量升高,池水富营养化。)
含量升高,池水富营养化。)
您最近一年使用:0次
2024-03-24更新
|
83次组卷
|
2卷引用:北京市中关村中学2023-2024学年高一下学期开学考化学试题
5 . 某工厂在山坡坑道的仓库里贮有氯气钢瓶。某天,有一只贮有氯气的钢瓶损坏,造成氯气泄漏,在场工人采取以下措施,请选择。
(1)①处理该钢瓶的方法正确的是_______ 。
A.钢瓶推到坡下的小河里 B.把钢瓶丢到深坑里,用石灰填埋 C.把钢瓶扔到农田中
②若在场工人没有防毒面具,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是_______ 。
A.NaOH B.NaCl C.Na2CO3
(2)为了探究HClO的漂白性,某同学设计了如图的实验:

①将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是_______ ;氯水可作为漂白剂,起主要作用的是氯水中含有的_______ (用化学式表示)。
②为防止氯气尾气污染空气,可用NaOH溶液吸收多余的氯气,原理是_______ (化学方程式);根据这一原理,工业上常用廉价的石灰乳吸收制得漂白粉,漂白粉的有效成分是_______ (填化学式)。
(1)①处理该钢瓶的方法正确的是
A.钢瓶推到坡下的小河里 B.把钢瓶丢到深坑里,用石灰填埋 C.把钢瓶扔到农田中
②若在场工人没有防毒面具,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是
A.NaOH B.NaCl C.Na2CO3
(2)为了探究HClO的漂白性,某同学设计了如图的实验:

①将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
②为防止氯气尾气污染空气,可用NaOH溶液吸收多余的氯气,原理是
您最近一年使用:0次
解题方法
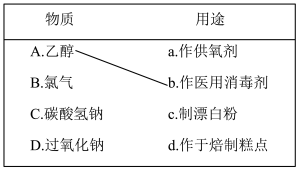
6 . 补齐物质及其用途的连线_________ 。
您最近一年使用:0次
名校
7 . 按要求回答下列问题。
(1)写出重晶石主要成分的化学式_______ 。
(2)写出用氢氧化钠溶液吸收尾气氯气的化学方程式_______ 。
(3)向氯化铁溶液中滴加硫氰化钾溶液,现象是_______ 。
(1)写出重晶石主要成分的化学式
(2)写出用氢氧化钠溶液吸收尾气氯气的化学方程式
(3)向氯化铁溶液中滴加硫氰化钾溶液,现象是
您最近一年使用:0次
2024-03-03更新
|
64次组卷
|
2卷引用:浙江省杭州市浙江大学附属中学2023-2024学年高一上学期期末考试化学试题
名校
8 . 氯气和一些含氯化合物常用作消毒剂。 制备流程可表述如下:
制备流程可表述如下:
① 与
与 作用生成
作用生成 ;
;
②在75℃左右, 进一步完全转化为
进一步完全转化为 ,
,
此步方程式为 (未配平)
(未配平)
(1)写出①生成 的化学方程式
的化学方程式_______ 。漂粉精久置空气中会变质,在变质过程中不会涉及的性质是_______
A. 的酸性 B.HClO的不稳定性 C.HClO的弱酸性 D.HClO的漂白性
的酸性 B.HClO的不稳定性 C.HClO的弱酸性 D.HClO的漂白性
(2)若某学生在上述流程中发现某含钙离子盐的化学式为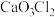 ,试根据盐的定义写出构成这种盐的酸根离子的符号
,试根据盐的定义写出构成这种盐的酸根离子的符号_______ 。
(3)若每一步反应均完全进行,且没有其他副产物,最终 与
与 的物质的量之比为
的物质的量之比为_______ 。
 制备流程可表述如下:
制备流程可表述如下:①
 与
与 作用生成
作用生成 ;
;②在75℃左右,
 进一步完全转化为
进一步完全转化为 ,
,此步方程式为
 (未配平)
(未配平)(1)写出①生成
 的化学方程式
的化学方程式A.
 的酸性 B.HClO的不稳定性 C.HClO的弱酸性 D.HClO的漂白性
的酸性 B.HClO的不稳定性 C.HClO的弱酸性 D.HClO的漂白性(2)若某学生在上述流程中发现某含钙离子盐的化学式为
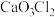 ,试根据盐的定义写出构成这种盐的酸根离子的符号
,试根据盐的定义写出构成这种盐的酸根离子的符号(3)若每一步反应均完全进行,且没有其他副产物,最终
 与
与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
9 . 已知84消毒液是一种常见的含氯消毒剂,广泛用于家庭、医院的消毒。某学习小组对84消毒液的性质进行探究。
查阅资料:①84消毒液的主要成分是NaClO,还含有少量的NaCl;
②单质碘(I2)遇淀粉变蓝。
(1)从物质类别看,NaClO属于________ ,HClO属于________ (填“强”或“弱”)酸,NaClO可能与某些酸反应。
(2)84消毒液具有氧化性,预测的依据(从化合价角度分析)________________________ 。
(3)实验验证:(把表格中的横线补充完整)
(4)该学习小组同学对实验iii进行了如下改进:
①对比iii—1、iii—2的现象,可得到的结论是_________________________________ 。
②对比iii—2、iii—3的现象,产生该现象差异的原因是_________________________ 。
查阅资料:①84消毒液的主要成分是NaClO,还含有少量的NaCl;
②单质碘(I2)遇淀粉变蓝。

(1)从物质类别看,NaClO属于
(2)84消毒液具有氧化性,预测的依据(从化合价角度分析)
(3)实验验证:(把表格中的横线补充完整)
| 实验序号 | 操作 | 现象 | 结论或解释 |
| i | 向稀释后的84消毒液中滴入稍过量的KI溶液和几滴淀粉 | 84消毒液具有氧化性 | |
| ii | 向稀释后的84消毒液中滴入稀盐酸 | 溶液变为黄绿色 | 反应的离子方程式 |
| iii | 向稀释后的84消毒液中通入CO2 | 无明显现象 |
(4)该学习小组同学对实验iii进行了如下改进:
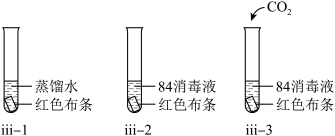
①对比iii—1、iii—2的现象,可得到的结论是
②对比iii—2、iii—3的现象,产生该现象差异的原因是
您最近一年使用:0次
10 . 氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)NaClO中Cl的化合价为______ ,有较强的______ (填氧化、还原)性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式______ 。
(2)黄绿色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为______ ;
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为______ ;
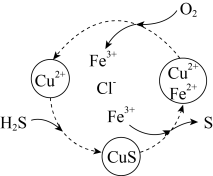
(3)将H2S和空气的混合气体通入FcCl3、FeCl2,CuCl2的混合溶液中反应可以回收S,其物质转化如下图所示。在图示的转化过程中,化合价保持不变的元素有______ (写元素符号),Fe2+和Cu2+反应过程中起______ 作用,该图示的总反应的化学方程式为______ 。
(1)NaClO中Cl的化合价为
(2)黄绿色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为
(3)将H2S和空气的混合气体通入FcCl3、FeCl2,CuCl2的混合溶液中反应可以回收S,其物质转化如下图所示。在图示的转化过程中,化合价保持不变的元素有

您最近一年使用:0次



