名校
1 . 已知钠、氯及其化合物间有如下转化关系,请按要求填空。
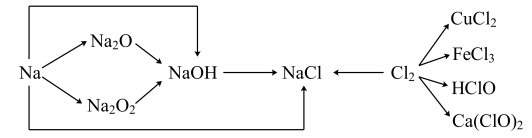
(1)一小块金属钠投入水中反应的化学方程式是___________ 。若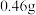 金属钠完全与水反应,可产生标准状况下H2的体积是
金属钠完全与水反应,可产生标准状况下H2的体积是___________ L,若反应后所得溶液为 ,则
,则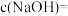
___________  。
。
(2) 常用于呼吸面具中,有关反应的化学方程式为
常用于呼吸面具中,有关反应的化学方程式为___________ 、___________ 。
(3)新制的氯水中加入打磨过的镁条,观察到的现象是___________ ;请写出氯气与水反应的化学方程式:___________ 。
(4)工业上用氯气和石灰乳反应制漂白粉,其化学方程式为___________ 。

(1)一小块金属钠投入水中反应的化学方程式是
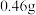 金属钠完全与水反应,可产生标准状况下H2的体积是
金属钠完全与水反应,可产生标准状况下H2的体积是 ,则
,则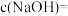
 。
。(2)
 常用于呼吸面具中,有关反应的化学方程式为
常用于呼吸面具中,有关反应的化学方程式为(3)新制的氯水中加入打磨过的镁条,观察到的现象是
(4)工业上用氯气和石灰乳反应制漂白粉,其化学方程式为
您最近一年使用:0次
解题方法
2 . 将一定量 通入1kg质量分数为
通入1kg质量分数为 的
的 溶液中,制成含有
溶液中,制成含有 、
、 和
和 的混合溶液。用此溶液吸收标准状况下
的混合溶液。用此溶液吸收标准状况下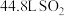 ,恰好形成中性溶液(假设气体均完全反应),请计算:
,恰好形成中性溶液(假设气体均完全反应),请计算:
(1)原 溶液中
溶液中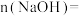
_______  。
。
(2)所通 在标准状况下的体积为
在标准状况下的体积为_______ L。
 通入1kg质量分数为
通入1kg质量分数为 的
的 溶液中,制成含有
溶液中,制成含有 、
、 和
和 的混合溶液。用此溶液吸收标准状况下
的混合溶液。用此溶液吸收标准状况下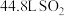 ,恰好形成中性溶液(假设气体均完全反应),请计算:
,恰好形成中性溶液(假设气体均完全反应),请计算:(1)原
 溶液中
溶液中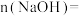
 。
。(2)所通
 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
解题方法
3 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图所示的装置来制取。装置中的离子膜只允许Na+离子通过,已知阳极发生氧化反应,则a口逸出的气体的分子式为_______ 。
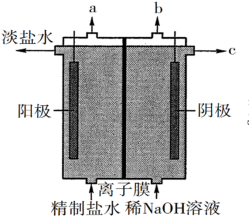
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,请写出氯气与水反应生成HClO的离子方程式_______ 。
(3)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,5ClO +4H+=4ClO2+Cl-+2H2O,每生成1 mol ClO2消耗NaClO2的量为
+4H+=4ClO2+Cl-+2H2O,每生成1 mol ClO2消耗NaClO2的量为_______ mol;产生“气泡”的化学方程式为_______ 。
(4)“84消毒液”的有效成分为_______ ,不可与酸性清洁剂混用的原因是(用离子方程式表示)_______ 。
(5)工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为_______ kg(保留整数)。
(1)氯气是制备系列含氯化合物的主要原料,可采用如图所示的装置来制取。装置中的离子膜只允许Na+离子通过,已知阳极发生氧化反应,则a口逸出的气体的分子式为

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,请写出氯气与水反应生成HClO的离子方程式
(3)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,5ClO
 +4H+=4ClO2+Cl-+2H2O,每生成1 mol ClO2消耗NaClO2的量为
+4H+=4ClO2+Cl-+2H2O,每生成1 mol ClO2消耗NaClO2的量为(4)“84消毒液”的有效成分为
(5)工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为
您最近一年使用:0次
名校
解题方法
4 . 写出下列反应的离子方程式。
(1)硫酸溶液与金属锌的反应___ ;
(2)CuSO4溶液中加入Ba(OH)2溶液___ ;
(3)盐酸溶液与氧化钙的反应___ ;
(4)钠与水的反应___ ;
(5)氯气与NaOH溶液的反应___ ;
(6)CO2通入澄清石灰水使石灰水变浑浊___ 。
(1)硫酸溶液与金属锌的反应
(2)CuSO4溶液中加入Ba(OH)2溶液
(3)盐酸溶液与氧化钙的反应
(4)钠与水的反应
(5)氯气与NaOH溶液的反应
(6)CO2通入澄清石灰水使石灰水变浑浊
您最近一年使用:0次
2021-09-14更新
|
290次组卷
|
2卷引用:江苏省常熟市2021-2022学年高一学生暑期自主学习调查化学试题
2021高三·全国·专题练习
5 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为_______________________________ 。
(2)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为____________ mol;产生“气泡”的化学方程式为__________________ 。
(3)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是_____________________ (用离子方程式表示)。工业上是将氯气通入30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1 000 kg该溶液需消耗氯气的质量为________ kg(保留整数)。
(1)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
(2)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为
(3)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是
您最近一年使用:0次
解题方法
6 . 正误判断
1.1molCa变成Ca2+时失去的电子数为2NA。(_______)
2.1molCl2与足量Fe反应,转移的电子数为3NA。(_______)
3.1molCl2参加反应转移电子数一定为2NA。(_______)
4.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA。(_______)
5.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA。(_______)
1.1molCa变成Ca2+时失去的电子数为2NA。(_______)
2.1molCl2与足量Fe反应,转移的电子数为3NA。(_______)
3.1molCl2参加反应转移电子数一定为2NA。(_______)
4.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA。(_______)
5.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA。(_______)
您最近一年使用:0次
7 . 化学与人类生活密切相关。请按要求回答下列问题:
(1)K2FeO4是一种重要的净水剂,可用下列方法制得:2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O。在该反应中,还原剂是___ ,当反应中有0.5molK2FeO4生成时,消耗Cl2在标况下的体积为____ ,转移电子的数目为___ 。
(2)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式_______ 。
(3)工业上制漂白粉的化学方程式为___ ,新制氯水在阳光照射下产生无色气体,该反应的化学方程式是___ 。
(4)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:___ 。若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是___ 。
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
(1)K2FeO4是一种重要的净水剂,可用下列方法制得:2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O。在该反应中,还原剂是
(2)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式
(3)工业上制漂白粉的化学方程式为
(4)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
8 . 以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
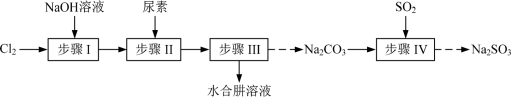
已知:①Cl2+2OH−=ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
步骤I制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为_______ ;实验中控制温度除用冰水浴外,还需采取的措施是_______ 。

已知:①Cl2+2OH−=ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
步骤I制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为
您最近一年使用:0次
20-21高一·浙江·阶段练习
解题方法
9 . 按要求完成下列问题:
(1)请写出NaCl的电子式___________ ,甲烷的结构式___________ 。
(2)用反应方程式表示制备漂白粉的原理为:___________ 。
(3)漂白粉的有效成分是___________ ,小苏打的化学式为___________ 。
(4)除去FeCl3溶液中FeCl2的原理,用离子方程式表示___________ 。
(1)请写出NaCl的电子式
(2)用反应方程式表示制备漂白粉的原理为:
(3)漂白粉的有效成分是
(4)除去FeCl3溶液中FeCl2的原理,用离子方程式表示
您最近一年使用:0次
名校
10 . 按要求填空:
(1)写出钠与水反应的离子方程式:___________ 。
(2)过氧化钠的颜色为:___________ ,其阳离子和阴离子的个数比为___________ ,写出过氧化钠与水反应的化学方程式:___________ 。
(3)写出氯的原子结构示意图:___________ , 写出工业制漂白粉的化学方程式:___________ 。
(4)向碳酸氢钠溶液中滴加少量的氢氧化钙,写出反应的离子方程式:___________ 。
(1)写出钠与水反应的离子方程式:
(2)过氧化钠的颜色为:
(3)写出氯的原子结构示意图:
(4)向碳酸氢钠溶液中滴加少量的氢氧化钙,写出反应的离子方程式:
您最近一年使用:0次



