名校
1 . 氯是海水中含量最丰富的元素,氯的单质及其化合物在生成、生活领域应用广泛。
(1)自来水厂常用液氯进行杀菌消毒。氯气溶于水发生的可逆反应为_____________ (用离子方程式表示)。
(2)用液氯消毒会产生微量有机氯代物,危害人体健康,可以使用二氧化氯(ClO2)代替液氯。工业上以二硫化亚铁(FeS2)、氯酸钠(NaClO3)和硫酸溶液混合制备二氧化氯气体。已知黄铁矿中的硫元素最终氧化成 ,写出制备二氧化氯的离子方程式
,写出制备二氧化氯的离子方程式_______ 。
(3)生产漂白粉工厂的主要设备是氯化塔,塔从上到下分为四层,如图为生产流程示意图。生产漂白粉反应的化学方程式为_______ 。实际生产中,将石灰乳(含有3%~6%水分的熟石灰)从塔顶喷洒而下,氯气从塔的最底层通入。这样加料的目的是_______ 。
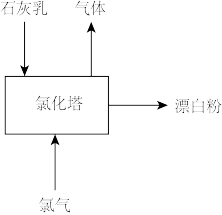
(1)自来水厂常用液氯进行杀菌消毒。氯气溶于水发生的可逆反应为
(2)用液氯消毒会产生微量有机氯代物,危害人体健康,可以使用二氧化氯(ClO2)代替液氯。工业上以二硫化亚铁(FeS2)、氯酸钠(NaClO3)和硫酸溶液混合制备二氧化氯气体。已知黄铁矿中的硫元素最终氧化成
 ,写出制备二氧化氯的离子方程式
,写出制备二氧化氯的离子方程式(3)生产漂白粉工厂的主要设备是氯化塔,塔从上到下分为四层,如图为生产流程示意图。生产漂白粉反应的化学方程式为

您最近一年使用:0次
解题方法
2 . 化学工业为疫情防控提供了强有力的物质支撑。次氯酸钠和二氧化氯(分子式为ClO2,其中Cl元素的化合价为+4价)在水处理等方面有广泛应用,是一种高效安全的灭菌消毒剂。
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备NaClO的化学方程式为_______ ;用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是_______ 。
(2)ClO2的制备方法,有下列两种:
方法Ⅰ:2NaClO3 + 4HCl =2ClO2↑ + Cl2↑+ 2NaCl + 2H2O
方法Ⅱ:2NaClO3 + H2O2 +H2SO4 = 2ClO2↑ + O2↑+ Na2SO4 +2H2O
方法Ⅰ反应中,氧化产物为_______ (填化学式);方法Ⅱ反应中,产生1mol ClO2气体,电子转移_______ mol。
(3)将ClO2溶于水得到溶液,为测定其浓度,进行以下实验操作:
步骤1 取待测ClO2溶液20.00mL于锥形瓶中;
步骤2 用稀硫酸调节溶液至酸性,加入足量的KI晶体充分反应,使ClO2转化为Cl-;发生的反应为:4ClO2 + 20 KI +8H2SO4=4KCl +10I2 + 8 X + 8H2O
步骤3 逐滴加入0.1500mol·L-1的Na2S2O3溶液,发生的反应为:I2 + 2Na2S2O3= Na2S4O6 +2NaI,当将步骤2中反应生成的I2恰好完全反应时,消耗Na2S2O3溶液的体积为24.00mL。
①写出步骤2反应方程式中的X的化学式为_______ ;
②计算:ClO2溶液的物质的量浓度为_______ mol·L-1(写出计算过程)。
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备NaClO的化学方程式为
(2)ClO2的制备方法,有下列两种:
方法Ⅰ:2NaClO3 + 4HCl =2ClO2↑ + Cl2↑+ 2NaCl + 2H2O
方法Ⅱ:2NaClO3 + H2O2 +H2SO4 = 2ClO2↑ + O2↑+ Na2SO4 +2H2O
方法Ⅰ反应中,氧化产物为
(3)将ClO2溶于水得到溶液,为测定其浓度,进行以下实验操作:
步骤1 取待测ClO2溶液20.00mL于锥形瓶中;
步骤2 用稀硫酸调节溶液至酸性,加入足量的KI晶体充分反应,使ClO2转化为Cl-;发生的反应为:4ClO2 + 20 KI +8H2SO4=4KCl +10I2 + 8 X + 8H2O
步骤3 逐滴加入0.1500mol·L-1的Na2S2O3溶液,发生的反应为:I2 + 2Na2S2O3= Na2S4O6 +2NaI,当将步骤2中反应生成的I2恰好完全反应时,消耗Na2S2O3溶液的体积为24.00mL。
①写出步骤2反应方程式中的X的化学式为
②计算:ClO2溶液的物质的量浓度为
您最近一年使用:0次
解题方法
3 . 化学与人类生活密切相关。请按要求,回答下列问题:
(1)氯气是重要的化工原科,实验室常用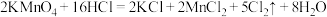 反应制备氯气,该反应的氧化剂是
反应制备氯气,该反应的氧化剂是_______ ;当生成的气体在标准状况下的体积为5.6L时转移的电子数为_______ 个,此时被氧化的物质的物质的量为_______ mol。
(2)“84”消毒液在生活中使用广泛,其有效成分是次氯酸钠。可在常温下将氯气通入NaOH溶液制得,该反应的离子方程式为_______ 。
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为_______ 。
(1)氯气是重要的化工原科,实验室常用
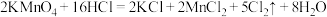 反应制备氯气,该反应的氧化剂是
反应制备氯气,该反应的氧化剂是(2)“84”消毒液在生活中使用广泛,其有效成分是次氯酸钠。可在常温下将氯气通入NaOH溶液制得,该反应的离子方程式为
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为
您最近一年使用:0次
名校
4 . 根据题目信息,完成有关方程式的书写。
(1)制备氢氧化铁胶体的离子方程式为_______ 。
(2) 与石灰乳反应的化学方程式:
与石灰乳反应的化学方程式:_______ 。
(3)用单线桥分析 与水反应中电子转移的方向和数目:
与水反应中电子转移的方向和数目:_______ 。
(4)将 固体(黄色,微溶)加入
固体(黄色,微溶)加入 和
和 的混合溶液里,加热,溶液显紫色(
的混合溶液里,加热,溶液显紫色( 无色)。写出该反应的离子方程式:
无色)。写出该反应的离子方程式:_______ 。
(1)制备氢氧化铁胶体的离子方程式为
(2)
 与石灰乳反应的化学方程式:
与石灰乳反应的化学方程式:(3)用单线桥分析
 与水反应中电子转移的方向和数目:
与水反应中电子转移的方向和数目:(4)将
 固体(黄色,微溶)加入
固体(黄色,微溶)加入 和
和 的混合溶液里,加热,溶液显紫色(
的混合溶液里,加热,溶液显紫色( 无色)。写出该反应的离子方程式:
无色)。写出该反应的离子方程式:
您最近一年使用:0次
名校
解题方法
5 . 2004年4月15日,重庆某化工厂氯气泄露并发生爆炸,爆炸现场弥漫着黄色烟雾,这起事故共造成7人丧生,并致使近15万群众紧急疏散。问题:
(1)爆炸现场弥漫的黄色烟雾,除氯气外,形成雾的主要原因是Cl2与水反应,反应的化学方程式为____ ;形成烟的成分包含Cl2与Fe反应的产物____ ,Cl2是一种有毒气体,为消除毒气,消防部门用消防用水与碱液在外围50米处形成两道水幕进行稀释,写出Cl2与强碱溶液反应的离子方程式____ 。
(2)Cl2及其无机产品常用做消毒剂,如“84消毒液”(NaClO)、“漂白粉”等,它们的消毒原理都是在潮湿的空气中与CO2和水蒸气反应生成了次氯酸,请写出“84消毒液”(NaClO)在空气中发生作用的化学方程式:____ 。
(3)用氯气对饮用水消毒已经有百年的历史,这种消毒的方法中氯气会与水中的有机物发生氯代生成对人体有害的的氯代物,于是世界环保联盟建议推广广谱高效消毒剂二氧化氯(ClO2),制取二氧化氯的其中一种方法是:Na2SO3+2NaClO3+H2SO4=2Na2SO4+2ClO2↑+H2O,若生成1 mol ClO2则转移电子数为____ (NA表示阿伏加德罗常数)。
(1)爆炸现场弥漫的黄色烟雾,除氯气外,形成雾的主要原因是Cl2与水反应,反应的化学方程式为
(2)Cl2及其无机产品常用做消毒剂,如“84消毒液”(NaClO)、“漂白粉”等,它们的消毒原理都是在潮湿的空气中与CO2和水蒸气反应生成了次氯酸,请写出“84消毒液”(NaClO)在空气中发生作用的化学方程式:
(3)用氯气对饮用水消毒已经有百年的历史,这种消毒的方法中氯气会与水中的有机物发生氯代生成对人体有害的的氯代物,于是世界环保联盟建议推广广谱高效消毒剂二氧化氯(ClO2),制取二氧化氯的其中一种方法是:Na2SO3+2NaClO3+H2SO4=2Na2SO4+2ClO2↑+H2O,若生成1 mol ClO2则转移电子数为
您最近一年使用:0次
6 . 氯是重要的非金属元素,研究它的性质及用途对生产, 生活、科研具有重要意义。
(1)一氯胺(NH2Cl)是一种长效缓释水消毒剂,在中性或酸性环境中会发生反应,生成一种具有强烈杀菌作用的物质,该物质为_______ 。工业上可利用NH3和Cl2反应制备一氯胺; 生成1molNH2Cl时,转移的电子数目为_______ 。
(2)Cl2 与NaOH溶液反应可制取“84消毒液。
用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3), 此时ClO-的浓度为c0mol/L;加热时NaClO能转化为NaClO3,测得t时刻溶液中ClO-的浓度为c1 mol/L (不考虑加热前后溶液体积的变化)。
①用24gNaOH配成250mL溶液时,c(NaOH)=_______ mol/L。
②写出溶液中NaClO分解生成NaClO3的化学方程式:_______ 。
③t时刻溶液中c(Cl-)=_______ mol/L(用含c0、c1的代数式表示)。
(1)一氯胺(NH2Cl)是一种长效缓释水消毒剂,在中性或酸性环境中会发生反应,生成一种具有强烈杀菌作用的物质,该物质为
(2)Cl2 与NaOH溶液反应可制取“84消毒液。
用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3), 此时ClO-的浓度为c0mol/L;加热时NaClO能转化为NaClO3,测得t时刻溶液中ClO-的浓度为c1 mol/L (不考虑加热前后溶液体积的变化)。
①用24gNaOH配成250mL溶液时,c(NaOH)=
②写出溶液中NaClO分解生成NaClO3的化学方程式:
③t时刻溶液中c(Cl-)=
您最近一年使用:0次
名校
7 . 氯气是一种重要的化工原料,在生产生活中具有广泛的应用。
(1)实验室常用二氧化锰和浓盐酸共热的方法制取氯气。根据要求回答下列问题。
①写出实验室制取氯气的化学方程式_______ 。若产生标准状况下4.48 LCl2,则反应过程中被氧化的HCl的物质的量是_______ mol。
②为了防止氯气污染环境,需将剩余氯气通入_______ ,发生的化学反应方程式_______ 。
③实验室还可用高锰酸钾快速地制取氯气,反应的化学方程式如下: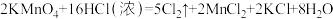 。在此反应中浓盐酸中显示出来的性质是
。在此反应中浓盐酸中显示出来的性质是_______ (填写字母)
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)电解饱和食盐水生产氢气、氯气、氢氧化钠,氯气与石灰乳反应可制取漂白粉。干燥的漂白粉不能发挥漂白效果,请写出漂白粉能发挥漂白效果的化学反应方程式_______ 。
(1)实验室常用二氧化锰和浓盐酸共热的方法制取氯气。根据要求回答下列问题。
①写出实验室制取氯气的化学方程式
②为了防止氯气污染环境,需将剩余氯气通入
③实验室还可用高锰酸钾快速地制取氯气,反应的化学方程式如下:
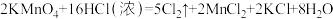 。在此反应中浓盐酸中显示出来的性质是
。在此反应中浓盐酸中显示出来的性质是A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)电解饱和食盐水生产氢气、氯气、氢氧化钠,氯气与石灰乳反应可制取漂白粉。干燥的漂白粉不能发挥漂白效果,请写出漂白粉能发挥漂白效果的化学反应方程式
您最近一年使用:0次
解题方法
8 .  溶液和84消毒液是生活中常用的两种消毒剂。请回答下列问题:
溶液和84消毒液是生活中常用的两种消毒剂。请回答下列问题:
(1)某同学设计如下实验研究 的性质:
的性质:
①理论上 既有氧化性又有还原性,具有还原性的原因是
既有氧化性又有还原性,具有还原性的原因是_______ 。
②能证明 具有还原性的是实验
具有还原性的是实验_______ (填序号)。
(2)84消毒液的有效成分为 。
。
①NaClO中Cl元素的化合价是_______ 。
②84消毒液不能用于钢制器具的消毒,原因是 具有
具有_______ 性。
③84消毒液吸收空气中的 ,其消毒杀菌能力增强,该过程中发生反应的化学方程式为
,其消毒杀菌能力增强,该过程中发生反应的化学方程式为_______ 。
(3)漂白粉在社会生活、工业生产中用途广泛。漂白粉除了具有漂白作用外,还能杀菌、消毒。
已知漂白粉溶于水后加入少量的酸能增强漂白效果。某同学据此将少量漂白粉溶于水后,再加入浓盐酸,观察到有黄绿色气体生成。回答下列问题:
①生成黄绿色气体的化学方程式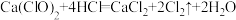 ,用双线桥表示反应电子转移方向和数目:
,用双线桥表示反应电子转移方向和数目:_______ 。
②家庭生活中常使用“84”消毒液进行消毒。这种消毒液和某品牌洁厕净(主要成分为盐酸)_______ (填“能”或“不能”)同时使用,其原因是_______ 。
 溶液和84消毒液是生活中常用的两种消毒剂。请回答下列问题:
溶液和84消毒液是生活中常用的两种消毒剂。请回答下列问题:(1)某同学设计如下实验研究
 的性质:
的性质:| 实验 | 操作 | 现象 |
| i | 向5% 溶液中滴加酸性 溶液中滴加酸性 溶液 溶液 | a.溶液紫色褪去 b.有大量气泡产生 |
| ii | 向5% 溶液中滴加淀粉碘化钾溶液 溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
 既有氧化性又有还原性,具有还原性的原因是
既有氧化性又有还原性,具有还原性的原因是②能证明
 具有还原性的是实验
具有还原性的是实验(2)84消毒液的有效成分为
 。
。①NaClO中Cl元素的化合价是
②84消毒液不能用于钢制器具的消毒,原因是
 具有
具有③84消毒液吸收空气中的
 ,其消毒杀菌能力增强,该过程中发生反应的化学方程式为
,其消毒杀菌能力增强,该过程中发生反应的化学方程式为(3)漂白粉在社会生活、工业生产中用途广泛。漂白粉除了具有漂白作用外,还能杀菌、消毒。
已知漂白粉溶于水后加入少量的酸能增强漂白效果。某同学据此将少量漂白粉溶于水后,再加入浓盐酸,观察到有黄绿色气体生成。回答下列问题:
①生成黄绿色气体的化学方程式
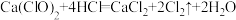 ,用双线桥表示反应电子转移方向和数目:
,用双线桥表示反应电子转移方向和数目:②家庭生活中常使用“84”消毒液进行消毒。这种消毒液和某品牌洁厕净(主要成分为盐酸)
您最近一年使用:0次
解题方法
9 . 按要求书写下列反应的离子方程式。
(1)通常用饱和NaHCO3溶液除去混在CO2中少量的HCl气体,其反应的离子方程式为_______ ;
(2)用氢氧化钠溶液和氯气反应制备84消毒液,反应的离子方程式是_______ 。
(3)若将84消毒液与洁厕灵(通常含盐酸)混合使用,则会产生黄绿色的有毒气体,该反应的离子方程式是_______ 。
(4)锌粒投入稀H2SO4中,溶液里氢离子的量减少,锌离子的量增加,反应的离子方程式是_______ 。
(5)过氧化钠与水反应会产生氧气,写出该反应的离子方程式_______ 。
(1)通常用饱和NaHCO3溶液除去混在CO2中少量的HCl气体,其反应的离子方程式为
(2)用氢氧化钠溶液和氯气反应制备84消毒液,反应的离子方程式是
(3)若将84消毒液与洁厕灵(通常含盐酸)混合使用,则会产生黄绿色的有毒气体,该反应的离子方程式是
(4)锌粒投入稀H2SO4中,溶液里氢离子的量减少,锌离子的量增加,反应的离子方程式是
(5)过氧化钠与水反应会产生氧气,写出该反应的离子方程式
您最近一年使用:0次
解题方法
10 . 生产生活中常用的干燥剂、净水剂有:
①固体氢氧化钠,②变色硅胶(主要成分是二氧化硅,添加少量的无水CoCl2作指示剂),③P2O5(五氧化二磷),④氯化钙,⑤浓硫酸,⑥碱石灰(主要成分是氢氧化钠、氧化钙),⑦明矾,⑧Fe(OH)3胶体。
(1)上述物质中,属于电解质的是_______ 。
(2)下列气体中,能用碱石灰干燥的是_______ 。
a.CO2 b.HCl c.H2 d.Cl2
(3)固体氢氧化钠不能干燥CO2,原因为_______ (用化学方程式表示)。
(4)往胶粒带有正电荷的Fe(OH)3胶体中加入电解质能使胶体凝聚。使一定量的胶体在一定时间内开始凝聚所需电解质的浓度(mmol·L-1),称作“聚沉值”,电解质的“聚沉值”越小,则表示其凝聚能力_______ (填“越强”或“越弱”),实验证明,凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚能力越强,则向Fe(OH)3胶体中加入下列电解质时,其“聚沉值”最小的为_______ 。
a.NaCl b.MgCl2 c.K2SO4 d.Na3PO4
①固体氢氧化钠,②变色硅胶(主要成分是二氧化硅,添加少量的无水CoCl2作指示剂),③P2O5(五氧化二磷),④氯化钙,⑤浓硫酸,⑥碱石灰(主要成分是氢氧化钠、氧化钙),⑦明矾,⑧Fe(OH)3胶体。
(1)上述物质中,属于电解质的是
(2)下列气体中,能用碱石灰干燥的是
a.CO2 b.HCl c.H2 d.Cl2
(3)固体氢氧化钠不能干燥CO2,原因为
(4)往胶粒带有正电荷的Fe(OH)3胶体中加入电解质能使胶体凝聚。使一定量的胶体在一定时间内开始凝聚所需电解质的浓度(mmol·L-1),称作“聚沉值”,电解质的“聚沉值”越小,则表示其凝聚能力
a.NaCl b.MgCl2 c.K2SO4 d.Na3PO4
您最近一年使用:0次



